Espèces non identifiées de Bonamia de divers les huîtres et les emplacements
Sur cette page
Catégorie
Catégorie 3 (pas d'hôte au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Maladie de la microcellule, Bonamiasis, Bonamiosis, maladie hémocytaire des huîtres
Nom scientifique ou affiliation taxonomique
Les espèces de Bonamia, qui ressemblent à Bonamia ostreae, un agent pathogène de l'huître plate européenne Ostrea edulis, Bonamia exitiosa un agent pathogène initialement décrit à partir d'huîtres de pêche de Nouvelle-Zélande Ostrea chilensis mais maintenant connu dans plusieurs espèces d'huîtres du monde entier, Bonamia roughleyi un pathogène décrit à l'origine des huîtres de roche Saccostrea glomerata de Sydney mais actuellement d'identité discutable, et Bonamia perspora un parasite de l'huître à crête de coq ou l'huître pied de cheval Ostrea stentina (=Ostreola equestris) ont été signalées chez diverses espèces d'huîtres dans des endroits éloignés. Hall et al.(2010a,b) ont indiqué que au moins certaines des isolats des espèces de Bonamia d'Argentine, du Chili, d'Australie et de l'est des États-Unis ont des affinités génétiques avec le clade Bonamia exitiosa/Bonamia roughleyi. Avant 2014, on ne savait pas si les microcellules du genre Bonamia exitiosa étaient composées de différentes souches d'une espèce ou si le groupe était constitué de plusieurs espèces (Lormann et al. 2009;). De plus, pour la majorité des microcellules dans ce groupe de type B. exitiosa, on disposait de relativement peu de données sur l'histologie, l'ultrastructure et les séquences moléculaires; ces données n'étaient pas suffisantes pour distinguer les espèces sans équivoque (Hill et al. 2010b). Une analyse moléculaire récente dans la séquence d'un gène, plus précisément des segments de la petite sous-unité (SSU ou 18S) et des espaceurs transcrits internes (ITS1-5.8S-ITS2 qui composent le locus de l'ADNr de l'ITS) du complexe de gènes de l'ADN ribosomique ont révélé que plusieurs des isolats provenant de plusieurs endroits étaient des B. exitiosa (Engelsma et al. 2014, Hill et al. 2014). L'information qui suit est une liste de toutes les microcellules qui ont été rapportées initialement comme étant des espèces Bonamia et des interprétations plus récentes de leur identité. On a attribué à chaque emplacement géographique signalé et aux espèces hôtes correspondantes une lettre code qui est appliquée de manière uniforme à tous les autres renseignements disponibles concernant l'organisme sous chaque en-tête suivant.
Répartition géographique
- Australie-Occidentale, Victoria, Nouvelles-Galles du Sud et Tasmanie, Australie (Hine and Jones 1994, (communications personnelles, Ben Diggles, Ph. D., DigsFish Services).
- Îles Chiloe et Quihua, sud du Chili (Kern 1993; Campalans et al. 2000, Lohrmann et al. 2009, Campalans and Lohemann 2009).
- Baie de San Antonio et zones adjacentes au golfe de San Matías, Patagonie, Argentine (Kroeck et Montes 2005; Kroeck et al. 2008).
- Côte Est des États-Unis, y compris Détroits de Bogue et de Masonboro, Caroline du Nord (Burreson et al. 2004; Carnegie et al. 2005, 2006; Bishop et al. 2006; Wilbur et al. 2008), rivière York (Gloucester Point) et baie de Chesapeake, (Schott et al. 2008).
- Hawaii (Hill et al. 2008, 2014).
- Baie de Tomales, Californie, États-Unis (Hill et al. 2014)
Espèces hôtes
- Ostrea angasi. L'identité de Bonamia est probablement B. exitiosa (Engelsma et Hine 2009a, Hill et al. 2010b).
- Ostrea chilensis (=Tiostrea). Une analyse génétique réalisée par Hill et al.(2014) a indiqué que l'espèce Bonamia chez O. chilensis du Chili est apparue dans le clade B. exitiosa dans les analyses phylogénétiques de l'ADNr de la SSU, mais s'est éloignée de ce clade dans les analyses de l'ADNr de l'ITS. Hill et al.(2014) et Engelsma et al.(2014) en ont donc conclu que l'inclusion des parasites d'O. chilensis au Chili ne serait peut-être pas justifiée, et que l'espèce Bonamia représenterait peut-être de nouvelles espèces.
- Ostrea puelchana. L'espèce Bonania dans cette huitre a maintenant été identifiée comme étant B. exitiosa (Oehrens Kissner et al. 2014, Hill et al. 2014)
- Crassostrea ariakensis, Ostrea stentina (=Ostreola equestris) et probablement Crassostrea virginica. L'analyse génétique a indiqué que l'espèce Bonamia chez C. ariakensis et O. stentina était B. exitiosa (Dungan et al., 2012, Audemard et al., 2014). Notez que B. exitiosa a été détecté chez la même espèce, O. stentina, que Bonamia perspora décrite par Carnegie et al.(2005, 2006). Bien que l'infection n'ait pas été initialement détectée chez le Crassostrea virginica sauvage provenant du même emplacement que les huîtres C. ariakensis infectées et introduites expérimentalement (Carnegie et al. 2006). Wilbur et al.(2008) ont détecté l'ADN de l'espèce Bonamia (par PCR quantitative en temps réel) chez C. virginica dans trois estuaires au sud-est de la Caroline du Nord, sans effets détectables sur la santé des huîtres positives. Les analyses ultérieurs indiquent que B. exitiosa est présent chez C. virginica dans l'est des États-Unis (Engelsma et al., 2014, Hill et al., 2014, et voir les rapports 2012 et 2013 de l'OIE dans les références ci-dessous). L'hybridation in situ (ISH) a été utilisée pour détecter un parasite étroitement apparenté à B. exitiosa dans des matériaux histologiques d'archives d'O. Edulis de la baie de Chincoteague, en Virginie (Hill et al., 2014).
- Dendostrea (=Ostrea) sandvicensis. La séquence sous-unité du gène de l'ADN ribosomique (SSU de l'ADNr) provenant de l'espèce Bonamia putative était unique avec seulement 90 à 91 % de similarité avec les séquences publiées d'autres espèces Bonamia (c.-à-d. B. exitiosa, B. ostreae, et B. perspora) (Hill et al. 2014). Bien que deux sondes d'hybridation in situ étiquetées par fluorescence conçues spécialement se sont hybridées avec l'espèce Bonamia de D. sandvicensis, cela n'a pas été le cas pour des sondes spécifiques B. exitiosa (Hill et al. 2014). De plus, des analyses phylogéniques ribosomales basées sur la région des espaceurs interne transcrit (ITS) ont indiqué que le parasite de D. sandvicensis en Hawaii était une espèce distincte de l'espèce Bonamia (Hill et al. 2014, Engelsma et al. 2014)
- Ostrea edulia. L'espèce Bonamia en O. edulis de la baieTomales en Californie en 2005 était étroitement apparentée à B. exitiosa et Bonamia sp. de O. chilensis au Chili (Hill et al. 2014). Plus particulièrement, Hill et al.(2014) rapportait que la région relativement conservée de l'ADNr de la petite sous-unité avait une ressemblance de 99 à 100 % avec les isolats, mais une similarité de seulement 83 à 86 de la séquence de l'ADNr de l'ITS entre B. exitiosa et les isolats du Chili. Hill et al.(2014) ont conclu que l'inclusion de ce parasite dans exitiosa n'est peut-être pas justifiée, et que ce taxon représenterait peut-être de nouvelles espèces. À remarquer que Bonamia ostreae est également apparu dans O. edulis de la Californie (Hill et al. 2014).
Impact sur les hôtes
- Comme B. ostreae et autre B. exitiosa, ce protozoaire intrahémocytique se répand rapidement à tout le système, le nombre élevé de parasites coïncidant avec la mort de l'huître. Le B. exitiosa chez l'huître O. angasi de Tasmanie provoque une pathologie très différente que B. exitiosa dans Ostrea chilensis de la Nouvelle-Zélande en ce sens qu'elle est épithéliotropique et associée, bien que rarement, à des abcès focalisés (Engelsma and Hine 2009a). Cependant, Heasman et al.(2004) ont observé la présence de l'espèce Bonamia uniquement dans les hémocytes et généralement dans des zones d'hémocytose chez l'huître O. angasi de la Nouvelles-Galles du Sud. Hine et Jones 1994 ont spéculé que l'espèce Bonamia australienne pourrait être issue d'un ancêtre commun de B. exitiosa datant de la fin du Crétacé, lorsque la Nouvelle-Zélande s'est séparée de l'État de Victoria, en Australie. Ce parasite pourrait également avoir évolué en Nouvelle-Zélande; après la mortalité massive des huîtres australiennes à la fin du XIXe siècle, elle aurait été introduite en Australie avec les huîtres de Nouvelle-Zélande qui ont été semées dans les eaux de l'État de Victoria et de la Tasmanie pour la restauration.
- L'importance est inconnue. Bien que des « niveaux » élevés d'infection aient été notés par Kern (1993) et qu'une prévalence pouvant atteindre 20 % ait été détectée par Arzul et al.(2005), aucune mortalité importante n'a été signalée. Campalans et Lohrmann (2009) ont signalé une prévalence plutôt faible (jusqu'à 6 %) dans le sud du Chili, la plus basse (2 %) étant observée en avril (automne) La présence de l'espèce Bonamia indique toujoursune grave infiltration hémocytique dans les tissus conjonctifs du manteau, des branchies et de la glande digestive (Campalans and Lohrmann 2009).
- Cette espèce de Bonamia a été associée à des taux de mortalité élevés (33 % après 18 mois, 80 % après 31 mois et 95 % lorsque O. puelchana a atteint une taille marchande après 32 à 36 mois de culture) et a entraîné l'abandon des efforts de culture (Kroeck et Montes 2005). Kroeck et al.(2008) ont suggéré que l'espèce Bonamia est un parasite enzootique du golfe de San Matías en raison de sa présence dans les populations indigènes d'O. puelchana dans les bancs naturels denses situés à proximité des cultures d'huîtres touchées. Dans les bancs naturels, on n'a constaté aucune différence entre la longueur de la coquille des huîtres parasitées et des huîtres non parasitées, et la probabilité d'infection n'était pas fonction du sexe de l'huître (Kroeck et al. 2008). L'évaluation de l'état de B. exitiosa chez les populations naturelles d'O. puelchana 14 années après l'épizootie révèle que la densité d'huîtres a nettement diminué et que la taille moyenne des huîtres est plus petite, ce qui indique que la bonamiose a contrôlé la structure de la population des huîtres dans les bancs d'huîtres persistants au cours de cette période (Oehrens Kissner et al. 2014).
- La prévalence élevée de l'infection (jusqu'à 100 %) a été associée à un taux de mortalité élevé chez les spécimens triploïdes de C. ariakensis dans les essais expérimentaux sur le terrain au cours du mois suivant le transfert aux sites de grossissement dans le détroit de Bogue, en Caroline du Nord, au cours de l'été 2003. Dans les cohortes se trouvant à un endroit éloigné en Caroline du Nord (détroit de Pamlico) et dans la baie de Chesapeake, en Virginie, il n'y a pas eu de mortalité ni d'infection par l'espèce Bonamia (Burreson et al. 2004). Cependant, Schott et al.(2008) ont signalé une faible prévalence de l'infection (2,7 %) chez les spécimens triploïdes de C. ariakensis élevés expérimentalement près de l'embouchure de la rivière York, dans la baie de Chesapeake. Puisque C. ariakensis n'est pas une espèce indigène de la côte est des États-Unis et qu'elle était reconnue pour être exempte des agents pathogènes infectieux avant les essais sur le terrain, la source (hôte naturel) de cette espèce de Bonamia est inconnue. Cependant, cette espèce de Bonamia a été détectée à une faible prévalence (3,3 %) chez des spécimens d'O. equestris dans le détroit de Bogue, en Caroline du Nord, en juin 2003. Les résultats d'expériences indiquent qu'une salinité inférieure à 30 parties par millier a des effets néfastes sur l'espèce de Bonamia chez l'huître C. ariakensis (Audemard et al. 2005, 2008a) et que des températures chaudes (supérieures à 20 °C) sont associées à la mortalité la plus élevée chez l'hôte, ce qui sous-entend que la température influe sur la pathogénicité de Bonamia (Audemard et al. 2008b). Cependant, l'espèce Bonamia pourrait persister chez C. ariakensis dans des conditions de basses températures combinées à une salinité de méso- à euhaline (Audemard et al. 2008b). En outre, on a constaté que l'activité de Bonamia est saisonnière, la mortalité des huîtres atteignant 100 % au cours des déploiements de la fin du printemps et de l'été, alors que la mortalité est plus faible (entre 17 et 82 %) au cours des déploiements du début de l'automne et qu'aucune infection par Bonamia n'a été décelée dans les déploiements de la fin de l'automne jusqu'au début de l'hiver (à des températures inférieures à 20 °C) (Carnegie et al. 2008). Crassostrea ariakensis peut-être infectée par l'espèce Bonamia après deux semaines d'exposition dans les zones d'enzootie de la Caroline du Nord, et des études en laboratoire indiquent que ce parasite pourrait être transmis directement entre les spécimens de C. ariakensis en laboratoire (Audemard et al. 2008c). Il est à noter que ce parasite a ensuite été identifié comme étant B. exitiosa (Audemard et al., 2014, Engelsma et al., 2014, Hill et al., 2014).
- et f. Aucune infection rapportée.
Techniques de diagnostic
Engelsma et Hine (2009a) ont indiqué que la PCR, les empreintes de tissus du cœur, et l'histologie peuvent être utilisées dans le cadre d'une surveillance ciblée et de diagnostics de présomption, et que le séquençage de l'ADN est la méthode recommandée pour le diagnostic de confirmation. Engelsma et al.(2014) ont présenté un résumé et une discussion sur les différentes techniques de diagnostic pour détecter Bonamia spp.
Impression de tissus (“frottis de coeur”)
Préparer des frottis d'empreinte fixés dans de l'acétone (ou du méthanol) à partir de tissu du cœur (de préférence du ventricule, car les oreillettes contiennent beaucoup de cellules séreuses qui rendent la détection du parasite difficile). Appliquer une coloration Wright, Wright-Giemsa ou une coloration équivalente (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter). Rechercher des organismes (microcellules) sphériques ou ovoïdes de 2 à 5 µm ayant un noyau central (apparence d'œuf au plat) à l'intérieur ou à l'extérieur des hémocytes.
Cette méthode grossit les organismes, comparativement aux préparations fraîches ou histologiques.
Histologie
- Examiner les coupes transversales de tissus colorés à l'hématoxyline et à l'éosine pour déceler la présence de microcellules intracellulaires (2-3 µm de diamètre) dans les hémocytes. Dans les infections de stade avancé, Bonamia se répand systématiquement. Dans les infections précoces, Bonamia est souvent observé dans les hémocytes des infiltrations focales du tissu conjonctif des branchies et du manteau et dans les sinus vasculaires entourant l'estomac et l'intestin.
- Des cellules de l'espèce Bonamia ont été observées dans les tissus conjonctifs (à l'état libre ou dans les hémocytes) des branchies et autour de la glande digestive, de l'estomac, de l'intestin et des gonades. Les signes bruts, les altérations histopathologiques d'O. puelchana et la morphologie cytologique de Bonamia ressemblent à ceux indiqués dans le rapport sur Bonamia exitiosa (Kroeck 2010).
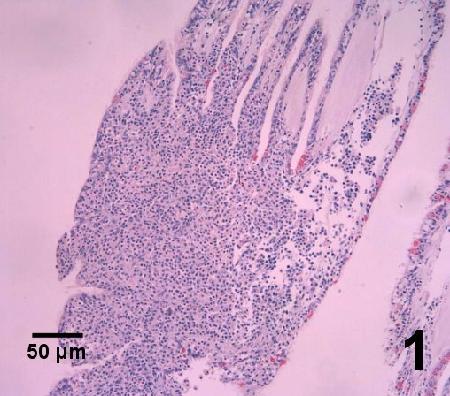
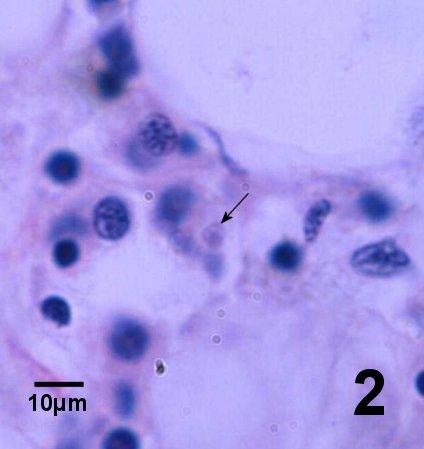
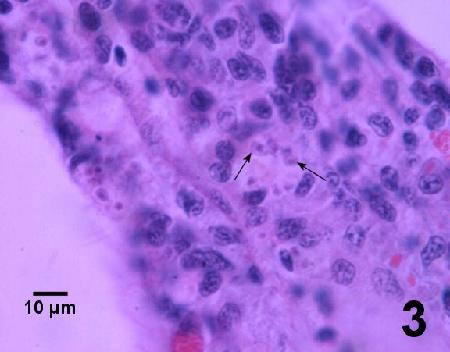
- et f. la présentation histologique du parasite dans chaque hôte était typique de l'infection par la microcellule haplosporidienne Bonamia spp. telle que décrite par Carnegie et Cochennec Laureau (2004). Les cellules parasitaires étaient généralement intrahémocytique, quelquefois extracellulaires là où les hémocytes étaient lysées, sans présenter d'autres formes haplosporidiennes conventionnelle telles que des spores ou les plasmodes multinucléés (Hill et al. 2014). L'intensité des infections était de légère à modérée et une hémocytose était généralement observée comme réaction de l'hôte (Englesma et al. 2014). La perturbation des tissus était plutôt modeste (Hill et al. 2014).
Microscopie électronique
- L'ultrastructure de Bonamia d'Ostrea angasi d'Australie semble conspécifique avec B. exitiosa (Hine et al., 2014).
- Lohrmann et al. (2009) ont examiné l'ultrastructure de l'espèce Bonamia chilienne et formulé les commentaires suivants : 1) la structure ressemble à celle de B. ostreae sur le plan de la taille, du faible nombre de mitochondries et de la prévalence et du nombre moyen de gouttelettes lipidiques; 2) elle diffère de B. ostreae en raison de la prévalence plus élevée d'appareils de Golgi liés à la membrane nucléaire (NM-BG), de l'haplosporogenèse connexe et de la plus petite taille des haplosporosomes; 3) elle ressemble à B. exitiosa en ce qui concerne le nombre d'haplosporosomes, la prévalence des gouttelettes lipidiques, le réticulum endoplasmique anastomosique et le NM-BG, la présence de cercles de réticulum endoplasmique et les citernes cylindriques opposées; 4) elle semble également avoir un cycle de développement semblable à celui de B. exitiosa, des formes de plus grande taille étant observées en hiver (août). D'après les similitudes observées sur le plan de l'ultrastructure et des stades de développement entre l'espèce B. exitiosa et l'espèce Bonamia chilienne, Lohrmann et al. (2009) ont suggéré que les deux espèces sont liées et que l'espèce Bonamia chilienne est soit l'espèce B. exitiosa, soit une sous-espèce de B. exitiosa, soit une espèce distincte étroitement liée à B. exitiosa. Hine et al. (2014) ont indiqué qu'il existait des ressemblances dans le développement d'une étape uninucléée plus importante et l'occurence de citernes cylindriques opposées, des différences ont été signalées entre B. exitiosa chez l'huitre O. chilensis de la Nouvelle-Zélande et Bonamia du Chili dans les mêmes espèces d'huitres du Chili. Plus particulièrement, les Bonamia sont plus petites et exibent un plus petit nombre d'haplosporosomes plus petites, Toutefois, cette caractéristique ne permet pas de bien la distinguer de la B. exitiosa de la Nouvelle-Zélande et la clarification de l'identité de la Bonamia du Chili doit attendre que des études moléculaires soient effectuées (Hine et al. 2014).
- L'ultrastructure de Bonamia d'Ostrea puelchana d'Argentine semble conspécifique avec B. exitiosa (Hine et al., 2014).
- L'ultrastructure de Bonamia de Crassostrea ariakensis de la côte est des États-Unis semble conspécifique avec B. exitiosa (Hine et al., 2014).
Sondes d'ADN
:
- Les séquence de segments du locus d'ARN ribosomique qui comprend des parties de l'ADN ribosomique de la petite sous-unité (ADNr SSU, ou ADNr 18S) gène et les régions de l'espaceur transcrit interne (ITS) (composé de ITS1-5.8S-ITS2) gène a été utilisé pour confirmer que la Bonamia dans O. angasi de l'Australie était B. exitiosa (Corbeil et autres 2006b, Engelsma et al., 2014 , Hill et al., 2014). L'analyse de la PCR en temps réel TaqMan mise au point pour la détection de l'espèce Bonamia a également détecté la présence de Bonamia chez O. angasi (Corbeil et al. 2006a).
- Des séquences partielles des régions de la petite sous-unité (18S) et des espaceurs transcrits internes (ITS) de l'ADN ribosomique (ADNr) donnent à penser que le parasite est étroitement lié, mais distinct de B. ostreae et de B. exitiosa (Arzul et al. 2005; White et al. 2008). Un test PCR conventionnel conçu pour l'amplification spécifique de B. exitiosa (Carnegie et al., 2008) amplifiera également l'ADN de Bonamia. chez O. chilensis du Chili (Engelsma et al., 2014). En outre, le test ISH chromogénique conçu pour détecter uniquement B. exitiosa (Hill et al. 2010b) détectera également la lignée sœur de Bonamia du chilien O. chilensis (Engelsma et al., 2014).
- En se fondant sur l'analyse génétique (parcimonie), White et al.(2008) ont suggéré qu'une espèce unique de Bonamia ressemblant à Bonamia exitiosa pourrait être présente en Argentine, en Australie, en Nouvelle-Zélande et en Caroline du Nord. Cependant, Kroeck (2010) a proposé de traiter l'espèce argentine comme une espèce de B. exitiosa jusqu'à ce que des études moléculaires et ultrastructurelles soient menées afin de déterminer la taxonomie exacte. Plus récemment, Hill et al.(2014) ont déterminé que la Bonamia de O. puelchana et Ostrea stentina en Argentine était B. exitiosa d'après les données de séquence de SSU et de régions d'espacement ITS de l'ADN ribosomique.
- Deux analyses de la réaction en chaîne de la polymérase (PCR) reconnues pour amplifier l'ADNr de la petite sous-unité de diverses espèces de Bonamia (Carnegie et al. 2000 et Cochennec et al. 2000) ont produit des amplicons de la taille prévue de tous les spécimens infectés de C. ariakensis qui ont été testés. Le séquençage des produits a généré une séquence unique de l'ADNr SSU (numéro d'accès Genbank AY542903) qui a été clairement identifiée comme une espèce de Bonamia, mais qui était différente des autres espèces de Bonamia (B. ostreae, B. exitiosa, B. roughleyi) pour lesquelles des données de séquence étaient disponibles (Burreson et al. 2004). L'hybridation in situ avec des sondes propres à Bonamia ont réagi avec l'espèce Bonamia chez l'huître C. ariakensis du détroit de Bogue, en Caroline du Nord. Schott et al.(2008) ont signalé de nouvelles séquences liées à Bonamia ainsi que celles étroitement liées aux espèces de Bonamia décrites précédemment chez l'huître C. ariakensis dans la baie de Chesapeake, aux États-Unis (numéro d'accès Genbank AY923853-AY923857). Plus récemment, Hill et al.(2014) ont déterminé que la Bonamia chez C. ariakensis et Ostrea stentina de la côte est des États-Unis était B. exitiosa d'après les données de séquence de SSU et de régions d'espacement ITS de l'ADN ribosomique.
- L'espèce de Bonamia détectée par PCR spécifique du genre et par examen histologique chez l'huître D. sandvicensis d'Hawaii s'est révélée nouvelle et basale par rapport au reste du clade Bonamia selon les analyses phylogéniques des séquences des gènes de l'ADNr SSU et ITS (Hill et al. 2008, 2014).
- L'hybridation avec l'espèce Bonamia dans l'huitre O. edulis de la Californie a été observée lors d'hybridation in situ en se servant des sondes spécifiques B. exitiosa marquées digoxigénine qui ciblent l'ARNr de la SSU (Hill et al. 2014). De plus, les analyses phylogénétiques des séquences de l'ADNr de la sous-unité indiquaient que ce parasite semblait être dans le clade B. exitiosa. Toutefois, les analyses de l'ADNr de l'ITS indiquaient que le parasite était différent de son clade (Hill et al. 2014). Un test PCR conventionnel conçu pour une amplification spécifique de B. exitiosa (Carnegie et al. 2008), n'amplifiera pas l'ADN de Bonamia sp. chez l'huitre O. edulis de Californie (Engelsma et al. 2014). De plus, le test chromogénique d'hybridation in situ conçu pour détecter seulement B. exitiosa (Hill et al. 2010B), détectera également le taxon sœur de Bonamia sp. chez l'huitre O. edulis de Californie (Engelsma et al. 2014).
Méthodes de contrôle
À ce jour, il n'existe pas de procédure d'éradication ou de contrôle connue. Tant que les méthodes de transmission et la spécificité de l'hôte de ces parasites n'auront pas fait l'objet d'une enquête complète, il faut éviter le déplacement des huîtresà l'extérieur des zones endémiques. Carnegie et al.(2008) ont déterminé que l'infection par l'espèce Bonamia chez Crassostrea ariakensis en Caroline du Nord était saisonnière et fortement influencée par la température. Par conséquent, il sera essentiel d'éviter les pics saisonniers de l'activité de l'espèce Bonamia (de la fin du printemps jusqu'au début de l'automne, lorsque la température de l'eau est supérieure à 20 °C) pour l'élevage de C. ariakensis dans les eaux où cette espèce est enzootique (Carnegie et al. 2008).
Références
Arzul, I., J.-P. Joly, M. Robert, B. Chollet, C. Garcia, L. Miossec, N. Cochennec, N. Carrasco, J. Campalans, M. Campalans et F. Berthe. 2005. Microcells in flat oysters, Ostrea chilensis from Chiloe Island, Chile: a new Bonamia species? Journal of Shellfish Research 24: 639. (Résumé).
Audemard, C., R. Carnegie, N. Stokes, E. Burreson et M. Bishop. 2005. Salinity effects on the susceptibility to and persistence of Bonamia ostreae and Bonamia sp. in Crassostrea ariakensis. Journal of Shellfish Research 24: 639. (Résumé).
Audemard, C., R.B. Carnegie, N.A. Stokes, M.J. Bishop, C.H. Peterson et E.M. Burreson. 2008a. Effects of salinity on Bonamia sp. survival in the Asian oyster Crassostrea ariakensis. Journal of Shellfish Research 27: 535-540.
Audemard, C., R.B. Carnegie, M.J. Bishop, C.H. Peterson et E.M. Burreson. 2008b. Interacting effects of temperature and salinity on Bonamia sp. parasitism in the Asian oyster Crassostrea ariakensis. Journal of Invertebrate Pathology 98: 344–350.
Audemard, C., R.B. Carnegie, K.M. Hill, C.H. Peterson et E.M. Burreson. 2008c. Investigation of Bonamia sp. transmission among, and incident in, Crassostrea ariakensis. Journal of Shellfish Research 27: 986. (Résumé).
Audemard, C., R.B. Carnegie, K.M. Hill, C.H. Peterson and E.M. Burreson. 2014. Bonamia exitiosa transmission among, and incidence in, Asian oyster Crassostrea ariakensis under warm euhaline conditions. Diseases of Aquatic Organisms 110: 143-150.
Bishop, M.J., R.B. Carnegie, N.A. Stokes, C.H. Peterson and E.M. Burreson. 2006. Complications of a non-native oyster introduction: Facilitation of a local parasite. Marine Ecology Progress Series 325: 145-152.
Burreson, E.M., N.A. Stokes et R.B. Carnegie. 2004. Bonamia sp. (Haplosporidia) found in nonnative oysters Crassostrea ariakensis in Bogue Sound, North Carolina. Journal of Aquatic Animal Health 16: 1-9.
Campalans, M. and K.B. Lohrmann. 2009. Histological survey of four species of cultivated molluscs in Chile susceptible to OIE notifiable diseases (Catastro histológico de cuatro especies de moluscos cultivados en Chile susceptibles a enfermedades de declaración obligatoria a la OIE). Revista de Biología Marina y Oceanografía 44: 561-569. (In English, Spanish Abstract).
Campalans, M., P. Rojas et M. Gonzalez. 2000. Haemocytic parasitosis in the farmed oyster Tiostrea chilensis. Bulletin of the European Association of Fish Pathologists 20: 31-33.
Carnegie, R.B. et N. Cochennec-Laureau. 2004. Microcell parasites of oysters: recent insights and future trends. Aquatic Living Resources 17: 519-528.
Carnegie, R.B., B.J. Barber, S.C. Culloty, A.J. Figueras et D.L. Distel. 2000. Development of a PCR assay for detection of the oyster pathogen Bonamia ostreae and support for its inclusion in the Haplosporidia. Diseases of Aquatic Organisms 42: 199-206.
Carnegie, R.B., N.A. Stokes, C. Audemard et E.M. Burreson. 2005. Bonamiasis in the crested oyster Ostrea equestris in North Carolina, USA. Journal of Shellfish Research 24: 644. (Résumé).
Carnegie, R.B., E.M. Burreson, P.M. Hine, N.A. Stokes, C. Audemard, M.J. Bishop et C.H. Peterson. 2006. Bonamia perspora n. sp. (Haplosporidia), a parasite of the oyster Ostreola equestris, is the first Bonamia species known to produce spores. Journal of Eukaryotic Microbiology 53: 232-245.
Carnegie, R.B., N.A. Stokes, C. Audemard, M.J. Bishop, A.E. Wilbur, T.D. Alphin, M.H. Posey, C.H. Peterson et E.M. Burreson. 2008. Strong seasonality of Bonamia sp. infection and induced Crassostrea ariakensis mortality in Bogue and Masonboro Sounds, North Carolina, USA. Journal of Invertebrate Pathology 98: 335–343.
Cochennec, N., F. LeRoux, F. Berthe et A. Gerard. 2000. Detection of Bonamia ostreae based on small subunit ribosomal probe. Journal of Invertebrate Pathology 76: 26-32.
Corbeil, S., I. Arzul, B. Diggles, M. Heasman, B. Chollet, F.C.J. Berthe et M.S.J. Crane. 2006a. Development of a TaqMan PCR assay for the detection of Bonamia species. Diseases of Aquatic Organisms 71: 75-80.
Corbeil, S., I. Arzul, M. Robert, F.C.J. Berthe, N. Besnard-Cochennec et M.S.J. Crane. 2006b. Molecular characterisation of an Australian isolate of Bonamia exitiosa. Diseases of Aquatic Organisms 71: 82-85.
Dungan, C.F., R.B. Carnegie, K.M. Hill, C.B. McCollough, S.E. Laramore, C.J. Kelly, N.A. Stokes and J. Scarpa. 2012. Diseases of oysters Crassostrea ariakensis and C. virginica reared in ambient waters from the Choptank River, Maryland and the Indian River Lagoon, Florida. Diseases of Aquatic Organisms 101: 173-183.
Engelsma, M. and M. Hine. 2009. Infection with Bonamia exitiosa: disease detection, pathogen identification and typing. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen, M. Engelsma (eds), Epidemiology of different agents causing disease in aquatic animals: scientific review and database development, (European Food Safety Authority (EFSA), Parma, Italy), Annexe B, pp. 40-41.
Heasman, M., B.K. Diggles, D. Hurwood, P. Mather, I. Pirozzi et S. Dworjanyn. 2004. Paving the way for continued rapid development of the flat (angasi) oyster (Ostrea angasi) farming industry in New South Wales. Final Report to the Department of Transport & Regional Services, Project No. NT002/0195 June 2004 NSW Fisheries Final Report Series No. 66. NSW Fisheries, Nelson Bay.
Hill, K.M., D.M. White, N.A. Stokes, R.B. Carnegie, N. Aloui-bejaoui, S.C. Webb, P.M. Hine, M.A. Kroeck, R. Ghars alli, R.K. Crockett, T.D. Lewis, K.S. Reece et E.M. Burreson. 2008. New perspectives on the dispersal and evolution of Bonamia species, haplosproidian parasites of oysters. Journal of Shellfish Research 27: 1016. (Résumé).
Hill, K.M., R.B. Carnegie, N. Aloui-Bejaoui, R.E. Gharsalli, D.M. White, N.A. Stokes et E.M. Burreson. 2010. Observation of a Bonamia sp. infecting the oyster Ostrea stentina in Tunisia, and a consideration of its phylogenetic affinities. Journal of Invertebrate Pathology 103: 179–185.
Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen and M. Engelsma. 2010b. Epidemiology of different agents causing disease in aquatic animals: scientific review and database development (Parma, Italy, European Food Safety Authority (EFSA)), 21 p. Annexe E, pp. 109-116.
Hill, K.M., N.A. Stokes, S.C. Webb, P.M. Hine, M.A. Kroeck, J.D. Moore, M.S. Morley, K.S. Reece, E.M. Burreson and R.B. Carnegie. 2014. Phylogenetics of Bonamia parasites based on small subunit and internal transcribed spacer region ribosomal DNA sequence data. Diseases of Aquatic Organisms 110: 33-54.
Hine, P.M. et J.B. Jones. 1994. Bonamia and other aquatic parasites of importance to New Zealand. New Zealand Journal of Zoology 21: 49-56.
Hine, P.M., R.B. Carnegie, M.A. Kroeck, A. Villalba, M.Y. Engelsma and B. EM. 2014. Ultrastructural comparison of Bonamia spp. (Haplosporidia) infecting ostreid oysters. Diseases of Aquatic Organisms 110: 55-63.
Kern, F.G. 1993. Shellfish health inspections of Chilean and Australian oysters. Journal of Shellfish Research 12: 366. (Résumé).
Kroeck, M.A. 2010. Gross signs and histopathology of Ostrea puelchana infected by a Bonamia exitiosa-like parasite (Haplosporidia). Diseases of Aquatic Organisms 89: 229–236.
Kroeck, M.A. et J. Montes. 2005. Occurrence of the haemocyte parasite Bonamia sp. in flat oysters Ostrea puelchana farmed in San Antonio Bay (Argentina). Diseases of Aquatic Organisms 63: 231-235.
Kroeck, M.A., L. Semenas et E.M. Morsan. 2008. Epidemiological study of Bonamia sp. in the native flat oyster, Ostrea puelchana from San Matías Gulf (NW Patagonia, Argentina). Aquaculture 276: 5–13.
Lohrmann, K.B., P.M. Hine et M. Campalans. 2009. Ultrastructure of Bonamia sp. in Ostrea chilensis in Chile. Diseases of Aquatic Organisms 85: 199–208.
Oehrens Kissner, E.M., M.S. Doldan, P.C. Zaidman, E.M. Morsan and M.A. Kroeck. 2014. Bonamiosis status in natural Ostrea puelchana beds in San Matías Gulf (Patagonia, Argentina), 14 years after an epizootic. Diseases of Aquatic Organisms 110: 135-142.
OIE Reports. 2012 & 2013. Bonamia exitiosa detected in Crassostrea virginica from North Carolina (2012) and Massachusetts (2013) with no assocaited disease.
Schott, E.J., J.A. Fernández-Robledo, M.R. Alavi et G.R. Vasta. 2008. Susceptibility of Crassostrea ariakensis (Fujita 1913) to Bonamia and Perkinsus spp. infections: potential for disease transmission between oyster species. Journal of Shellfish Research 27: 541-549.
White, D., N. Stokes, K. Hill, M. Kroeck, P.M. Hine, N. Aloui-bejaoui, R. Carnegie, K. Reece et E. Burreson. 2008. A molecular phylogeny of the genus Bonamia based on internal transcribed spacer region sequences. Journal of Shellfish Research 27: 1063. (Résumé).
Wilbur, A.E., J.D. Gauthier, T.D. Alphin et M.H. Posey. 2008. Preliminary investigations into the occurrence of a novel parasite (Bonamia sp.) associated with the eastern oyster Crassostrea virginica. Journal of Shellfish Research 27: 1064. (Résumé).
Citation
Bower, S.M. (2015) : Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement: Divers espèces de Bonamia des huîtres variées
Date de la dernière révision : février 2015
Faire parvenir les commentaires à Susan Bower
- Date de modification :