Rickettsia des écrevisses
Sur cette page
Catégorie
Catégorie 4 (pas d'hôte au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Infection de type Rickettsia des écrevisses.
Nom scientifique ou affiliation taxonomique
- Organisme de type Rickettsia, probablement Coxiella cheraxi comme le décrivent Tan et Owens (2000).
- Organisme de type Rickettsia, probablement une deuxième espèce, d'après le tropisme tissulaire décrit ci-dessous. Organismes de type Rickettsia - probablement au moins deux espèces, d'après le tropisme tissulaire décrit ci-dessous.
Répartition géographique
Cours d'eau douce du Nord de l'Australie et écloseries du Queensland en Australie et en Équateur.
Espèces hôtes
Cherax quadricarinatus.
Impact sur les hôtes
- Une infection généralisée a contribué aux mortalités élevées enregistrées dans les étangs de grossissement dans des fermes commerciales en Australie (Ketterer et al. 1992, Tan et Owens 2000) et en Équateur (Jiménez et Romero 1997, Romero et al. 2000).
- l'infection décelée chez une C. quadricarinatus moribonde provenant d'une ferme qui subissait des mortalités chroniques d'écrevisses semblait confinée dans l'épithélium du tubule de l'hépatopancréas (Edgerton et Prior 1999).
Techniques de diagnostic
Observations générales
Les signes macroscopiques de l'infection n'avaient été relevés que chez des écrevisses ayant des infections généralisées. Les écrevisses affectées avaient un aspect bleu verdâtre et étaient généralement léthargiques.
Histologie
a) Une importante hyperplasie et une hypertrophie des cellules endothéliales et interstitielles dans les organesde tout le corps, surtout sur les branchies. Les cellules infectées comprennent les hémocytes en circulation et les phagocytes fixés sur le côté extérieur des vaisseaux terminaux de l'hémolymphe hépatique. Le cytoplasme de nombreuses cellules hypertrophiées contient de larges corps d'inclusion granulaires cytoplasmiques, qui sont fortement basophiles (coloration à l'hématoxyline et à l'éosine). Les cellules basophiles sont Gram-négatif, positives à la coloration de Macchiavello et négatives à la coloration de Ziehl-Neelsen. Aucun cas d'infection n'a été observé dans les cellules épithéliales des tubules de l'hépatopancréas.
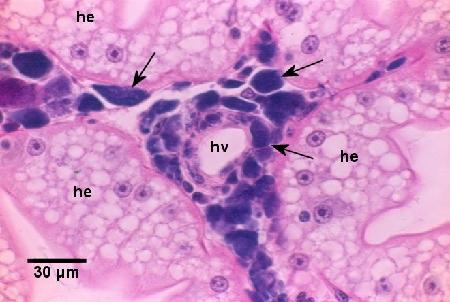
Figure 1. Hémocytes infectés et phagocytes fixés contenant des colonies basophiles de Coxiella cheraxi (flèches) autour d'un vaisseau vertébral (hv) et entourés de cellules épithéliales non infectées de l'hépatopancréas (he). Il convient de noter qu'il n'y a pas de réaction (c.-à-d. réaction mélanique) à l'infection. Coloration à l'hématoxyline et à l'éosine.
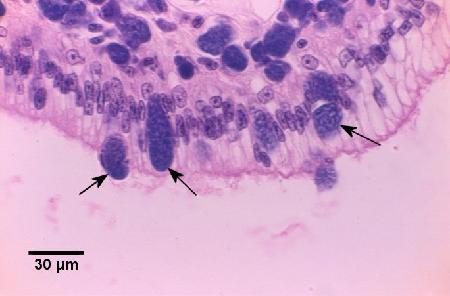
Figure 2. Diapédèse et libération des colonies basophiles de Coxiella cheraxi (flèches) à travers l'épithélium cylindrique de l'œsophage. Il convient de noter que le tissu conjonctif sous-jacent contient plusieurs cellules infectées Coloration à l'hématoxyline et à l'éosine.
b) Les inclusions basophiles ont été observées dans le cytoplasme des tubules des hépatopancréatocytes. Ces inclusions étaient Gram-négatif, se coloraient modérément au PAS, étaient intensément phloxinophiles, et présentaient parfois une zone centrale claire qui contenait de la matière acidophile. Aucune infection n'a été observée dans les autres tissus.
Microscopie électronique
a) Les corps d'inclusions sont constitués de denses agrégats d'organismes de type Rickettsia (de forme allongée) au sein de la vacuole reliée à la membrane. Les différents stades de développement comprennent un corps élémentaire de forme allongée, dense en électrons (de 0,48 à 0,6 µm de longueur et de 0,3 µm de diamètre) et un corps intermédiaire (de 0,75 à 1,1 µm de longueur et de 0,36 à 0,44 µm de diamètre). Certains des corps élémentaires denses en électrons sont apparus comme étant libres dans le cytoplasme des cellules infectées.
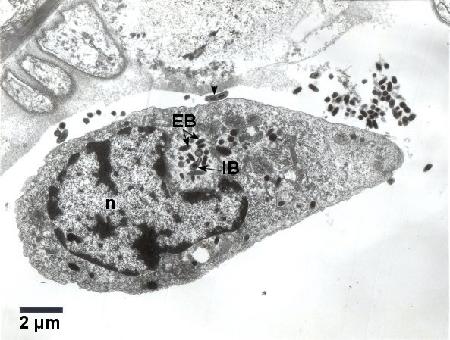
Figure 3. Colonie constituée de corps élémentaires (EB) denses en électrons et de corps intermédiaires (IB) de Coxiella cheraxi adjacents au noyau (n) d'un hémocyte. Un corps intermédiaire (IB) allongé présentant une constriction centrale (pointe de flèche) est identifié en liberté dans l'hémolymphe près de l'hémocyte infecté. Fixateur froid de Karnovsky; Acétate d'uranyle et colorant au citrate de plomb.
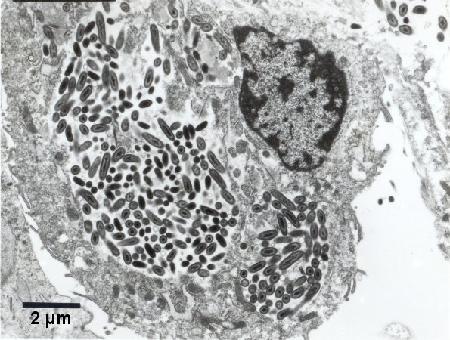
Figure 4. Au moins deux colonies de Coxiella cheraxi à l'intérieur du cytoplasme d'un hémocyte. Fixateur froid de Karnovsky; Acétate d'uranyle et colorant au citrate de plomb.
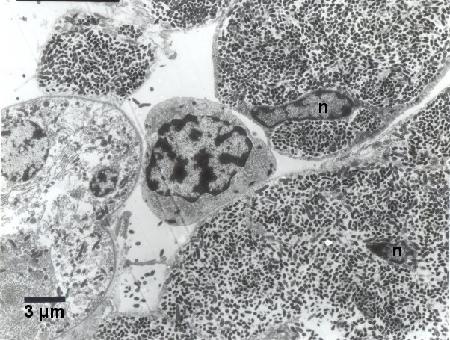
Figure 5. Hémocytes hypertrophiés présentant des noyaux déformés (n) densément infectés par Coxiella cheraxi adjacents à un hémocyte relativement normal (centre de l'image). Fixateur froid de Karnovsky; Acétate d'uranyle et colorant au citrate de plomb.
b) Les inclusions cytoplasmiques étaient constituées de micro colonies de type Rickettsia à l'intérieur des vacuoles liées à la membrane. Ces organismes (de 0,2 à 0,4 µm de longueur) avaient une paroi cellulaire et une membrane plasmique. Ils étaient polymorphes avec des formes rondes plus fréquentes que les formes allongées (Edgerton et Prior 1999).
Méthodes de contrôle
La mauvaise qualité de l'eau (contenant de la matière organique polluée) prédispose probablement les écrevisses à l'encrassement de l'épibionte et contribue à la gravité de la maladie. La transmission verticale, probablement par le contact des fèces contaminées, est considérée comme une voie de contamination normale. Les injections intramusculaires de l'oxytétracycline ont apparemment guéri le stock de reproduction de l'infection (Owens et al. 1992). l'injection des stocks de femelles de reproduction semblait aider à prévenir la transmission verticale de l'infection aux descendants lorsque ceux-ci restaient reliés à leur mère pendant quelques jours après éclosion. Ce traitement était applicable à une échelle commerciale (résultats non publiés, X. Romero, Subsecretaría de Acuacultura, Edif. Gobierno del Litoral Piso 12, Guayaquil, Équateur, courriel : xromero2001@yahoo.com).
Références
Edgerton, B.F. et H.C. Prior. 1999. Description of a hepatopancreatic rickettsia-like organism in the redclaw crayfish Cherax quadricarinatus. Diseases of Aquatic Organisms 36: 77-80.
Edgerton, B.F., P. Henttonen, J. Jussila, A. Mannonen, P. Paasonen, T. Taugbíl, L. Edsman et C. Souty-Grosset. 2004. Understanding the cause of disease in European freshwater crayfish. Conservation Biology 18: 1466-1474.
Jiménez, R. et X. Romero. 1997. Infection by intracellular bacterium in red claw crayfish, Cherax quadricarinatus (Von Martens), in Ecuador. Aquaculture Research 28: 923-929.
Ketterer, P.J., D.J. Taylor et H.C. Prior. 1992. Systemic rickettsia-like infection in farmed freshwater crayfish, Cherax quadricarinatus. In: M. Shariff, R.P. Subasinghe and J.R. Arthur (eds.). Diseases in Asian Aquaculture. I. Fish Health Section, Asian Fisheries Society. Manila, Philippines, p. 173-179.
Owens, L., P. Muir, D. Sutton et M. Wingfield. 1992. The pathology of microbial diseases in tropical Australian Crustacea. In: Shariff, M., R.P. Subasinghe, J.R. Arthur (eds.) Diseases in Asian Aquaculture I. Fish Health Section, Asian Fisheries Society, Manila, Philippines. pp. 165-172.
Romero, X., J.F. Turnbull et R. Jiménez. 2000. Ultrastructure and cytopathology of a rickettsia-like organism causing systemic infection in the redclaw crayfish, Cherax quadricarinatus (Crustacea: Decapoda), in Ecuador. Journal of Invertebrate Pathology 76: 95-104.
Tan, K. et L. Owens. 2000. Infectivity, transmission and 16s rRNA sequencing of a rickettsia, Coxiella cheraxi sp. nov., from the freshwater crayfish Cherax quadricarinatus. Diseases of Aquatic Organisms 41: 115-122.
Citation
Bower, S.M., Romero, X. (2009): Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement: Rickettsia des écrevisses.
Date de la dernière révision : Février 11, 2009
Faire parvenir les commentaires à Susan Bower
- Date de modification :