Infection haplosporidienne des palourdes
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Nom courants et généralement admis de l'organisme ou de l'agent pathogène
Infection haplosporidienne des palourdes et des coques
Nom scientifique ou classification taxonomique
Peu de renseignements sont disponibles sur les espèces d'haplosporidés signalées dans les palourdes. Certaines n'ont pas été signalées depuis leur description d'origine, souvent brève. Cependant, elles semblent être correctement associées au phylum Haplosporidia (Burreson and Ford 2004). Par ailleurs, la taxonomie des haplosporidés doit faire l'objet d'une révision exhaustive (Hines et al. 2009). Ci-dessous figure la liste des parasites ou des signalements classés par espèce ou région géographique.
- Minchinia (=Haplosporidium) tapetis (Joly and Comps 1979, Chagot et al. 1987, Villalba and Navas 1988, Navas et al. 1992, Azevedo 2001) et plasmodes d'haplosporidiens non identifiés (Figueras et al. 1992, Villalba et al. 1999).
- Haplosporidium edule (Carballal et al. 2001 Azevedo et al. 2003).
- Haplosporidian sans nom rapporté par Darriba et al. (2010).
- Haplosporidien sans nom rapporté par Armstrong et Armstrong (1974).
- Haplosporidien sans nom dont la relation avec les parasites indiqués ci-dessus est inconnue (Itoh et al. 2005).
Étant donné que certains des haplosporidés signalés n'ont pas été précisément identifiés, le même code alphabétique a été attribué à tous les rapports pour lesquels la région géographique ou l'espèce est la même, tel qu'il est mentionné ci-dessus. Le même code alphabétique a été attribué aux renseignements de chaque rapport/sur chaque parasite pour chacun des sujets suivants.
Répartition géographique
- Côtes ouest du Portugal et d'Espagne et le Côte méditerranéenne de la France.
- Galice, Espagne.
- Île San Martiño à l'embouchure de la Ría de Vigo, Galice, Espagne. Il semblerait que des parasites aient été signalés dans des espèces apparentées de palourdes du littoral italien.
- Baie Yaquina, Oregon, États-Unis.
- Iwakuni dans la préfecture de Yamaguchi, Japon.
Espèces hôtes
- Tapes (=Ruditapes) decussatus, Venerupis aureus et Venerupis (=Tapes, =Ruditapes) philippinarum d'élevage. Villalba et al. (1999) ont signalé des plasmodes d'un haplosporidien non identifié chez Venerupis rhomboides et Venerupis pullastra de Ria de Arousa, en Galice, en Espagne.
- Cerastoderma edule
- Ensis arcuatus en Espagne et probablement Ensis minor et Ensis sp. sur le littoral italien.
- Tresus capax.
- Venerupis (=Tapes) philippinarum.
Impact sur les hôtes
- La prévalence de l'infection est généralement faible (environ 4 %). Toutefois, M. tapetis était présent dans plus de 97 % des T. decussatus et 25 % des V. aureusen Espagne (Navas et al. 1992). La pathogénicité des plasmodes chez les palourdes est minime, mais le stade de sporulation dans le tissu conjonctif provoque des lésions importantes dans la glande digestive et les branchies.
- On a détecté une faible prévalence d Haplosporidium edule dans des coques d'Espagne dans seulement 2 emplacements sur 34. Les infections les plus graves se trouvaient dans la glande digestive et provoquaient une réponse hémocytique, en particulier lorsque le stade plasmodial était dominant (Carballal et al. 2001).
- En Espagne, l'intensité de l'infection était faible et aucune réaction n'a été observée chez les hôtes. Cependant, en Italie, l'hypothèse qu'un lien existe entre la forme grave d'haplosporidiose observée et certains cas de mortalités de couteaux a été formulée (Darriba et al. 2010).
- Rien à signaler.
- Au Japon, une infection haplosporidienne a été détectée en mai 2002 dans l'une de 40 V. philippinarum japonaises implantées expérimentalement en avril 2002 (dans la préfecture d'Oita au Japon) pour étudier le déclin abrupt des stocks commerciaux de V. philippinarum dans la région de la préfecture de Yamaguchi. C'est le seul cas connu de ce parasite au Japon. Les branchies et le tissu conjonctif de la masse viscérale de la palourde infectée étaient pratiquement complètement remplacés par des plasmodes et des spores, et quelques plasmodes étaient également présents dans les tissus du pied (Itoh et al. 2005).
Bien qu'aucune mortalité n'ait été attribuée à ces parasites, l'effet sur les populations de palourdes est inconnu mais des espèces proches sont fortement pathogènes pour les huîtres sur la côte est de l'Amérique du Nord.
Techniques de diagnostic
Préparation humide
:
- Des spores immatures fraîches présentent une ou deux (trois, dans de rares cas) extensions cytoplasmiques sur l'épispore. Toutefois, après 3 à 5 jours d'incubation dans de l'eau de mer filtrée, les extensions avaient disparu.
- b, c and d. Pas de description
- Des spores matures fraîches examinées sous un microscope à contraste de phase possédaient deux longues extensions de spores (25 à 45 µm de longueur), une à chaque extrémité de la spore ovoïde.
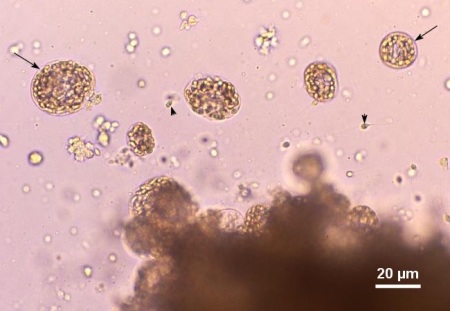
Figure 1. Montage humide de la glande digestive de Venerupis philippinarum provenant du Japon gravement infectée par une espèce non identifiée d'haplosporidien. Plusieurs plasmodes contenant des spores en développement (flèches) et quelques spores libres (têtes de flèches) ont été libérés du tissu infecté. Image fournie par Kazuo Momoyama, Ph. D., Inland Sea Division, Yamaguchi Prefectural Fisheries Research Center, Aio-Futashima, Yamaguchi 754-0893, Japon.
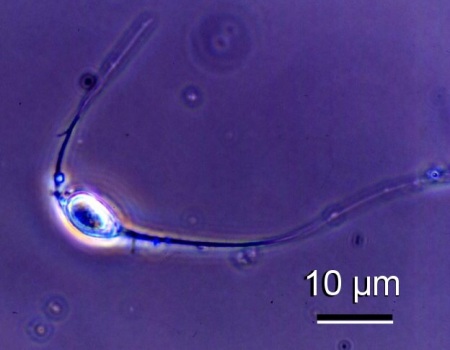
Figure 2. Micrographie au contraste de phase d'une spore d'une espèce d'haplosporidien non définie provenant d'une Venerupis philippinarum du Japon. Image fournie par Kazuo Momoyama, Ph. D., Inland Sea Division, Yamaguchi Prefectural Fisheries Research Center, Aio-Futashima, Yamaguchi 754-0893, Japon.
Histologie
&nbs;:
- Les premiers signes de l'infection sont des plasmodes multinucléés situés généralement dans les épithéliums du tube digestif (Chagot et al. 1987). Les plasmodes de M. tapetis et d'un haplosporidé non identifié de Tapes (=Ruditapes) decussatus en Galice (Espagne) étaient généralement de forme sphérique ou allongée avec un axe longitudinal entre 5,5 et 16 µm. Ces plasmodes contenaient entre 3 et 16 noyaux dont le plus grand (d'un diamètre de 2 à 2.5 µm) renfermait des endosomes (nucléoles) (Villalba et Navas 1988, Figueras et al. 1992). Les plasmodes de la même espèce de mye dans l'Étang de Thau (côte méditerranéenne française) avaient une morphologie similaire (Joly et Comps 1979). Une sporulation intense se produit dans le tissu conjonctif interstitiel situé sous la glande digestive et les branchies. Les spores ovoïdes operculées font de 5 à 6 µm de longueur et de 4 à 6 µm de largeur (Chagot et al. 1987).
- Les plasmodes avaient dans la plupart des cas une forme sphérique ou allongée (longueur de l'axe longitudinal de 16,72 ± 4,84 µm) et contenaient entre deux et plus de 20 noyaux. (Darriba et al. 2010)
- Les plasmodes (de 5 à 6 µm de diamètre), les sporocystes, les sporoblastes (sporocystes, 11 à 15 µm de diamètre) et de nombreuses spores ovoïdes à ellipsoïdales (3,2 µm sur 2,2) étaient les plus abondants dans le tissu conjonctif de la glande digestive, mais étaient également présents dans le tissu conjonctif de la branchie, de la gonade et du manteau (Carballal et al. 2001, Azevedo et al. 2003).
- Les sporocystes consistent en un agrégat massif d'hémocytes hôtes entourés de cellules de type fibroblaste. Dans les sporocystes, de nombreux plasmodes ovales à sphériques, de 10 à 35 µm de longueur et contenant entre 2 et plus de 60 noyaux sphériques. On n'a pas observé de développement et de multiplication des plasmodes, ni de sporogonie, ce qui nuit à une identification formelle.
- Le tissu conjonctif des branchies et la masse viscérale étaient pratiquement entièrement remplacés par des cellules parasites, y compris des spores. Quelques cellules parasites ont également été observées dans les tissus du pied.
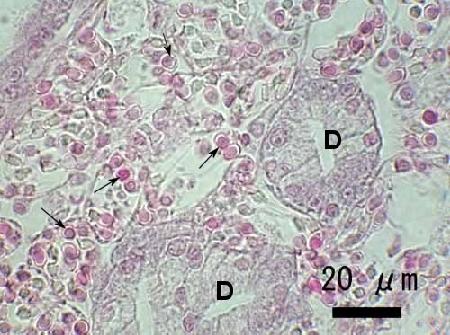
Figure 3. Infection grave d'une espèce d'haplosporidien non identifiée dans le tissu conjonctif d'une Venerupis philippinarum du Japon. Remarquez les nombreuses spores en développement (flèches) dans les plasmodes adjacents aux tubules de la glande digestive (D). Image fournie par Naoki Itoh Ph. D.
Microscopie électronique
- À l'examen aux microscopes électroniques à balayage et à transmission, les spores étaient ellipsoïdes (environ 4,8 µm de long et 3,9 µm de large, n = 30) avec un opercule articulé typique (3,9 µm de large environ) à l'extrémité apicale. Les extensions cytoplasmiques des épispores de spores immatures étaient formées de membranes plasmiques avec une petite quantité de matière exosporoplasmique (cytoplasme de l'épispore) à laquelle il manquait les structures internes cytosquelettiques et n'étaient pas en continuité avec la paroi des spores. Les parois des spores matures possédaient trois couches (une couche extérieure opaque aux électrons épaisse de 25 nm, une couche intermédiaire transparente aux électrons de 10 nm et une couche opaque aux électrons de 15 nm qui était en contact avec la membrane endosporoplasmique) et ne possédaient pas l'ornementation et les structures cytosquelettiques connexes (Azevedo 2001). Outre ces structures, Hine et al. (2009) ont indiqué que les spores présentaient également les caractéristiques ultrastructurelles suivantes : microfilaments sur l'opercule des spores, microtubules sous la membrane plasmique du sporoplasme, réseau microtubulaire perpendiculaire à la membrane sporoplasmique, sporulation dans l'hôte, noyaux évoluant en corps embryonnaires dérivés des sphérules et développant une membrane externe en bourgeonnant pour se muer en haplosporosomes, et spores de queues perdues associées à l'épisporoplasme. Le cytoplasme des plasmodes et des spores contient des ribosomes, des mitochondries, des haplosporosomes et des organites appelés sphérules (Joly et Comps 1979, Chagot et al. 1987).
- Comme d'autres membres du genre Haplosporidium, les spores de H. edule présentaient une ornementation externe composée de matière formant la paroi des spores. Aux microscopes électroniques à balayage et à transmission, la caractéristique distinctive de ces spores est l'ornementation de petites projections (jusqu'à 1,5 µm de long) avec des extrémités bifurquées, ainsi que de nombreux plis parallèles latitudinaux en circonférence allant jusqu'à 0,35 µm de haut (Azevedo et al. 2003).
- et d. Pas de description.
- À l'examen au microscope électronique à transmission, les spores immatures étaient ovoïdes (3,98 ± 0,37 µm par >2,83 ± 0,18 µm, n = 10) et possédaient un opercule apical, des haplosporosomes et de nombreux granules. La paroi des spores était composé de trois couches, et aucun cytoplasme d'épispore n'a été observé, probablement en raison de la mauvaise préservation de l'échantillon (Itoh et al. 2005).
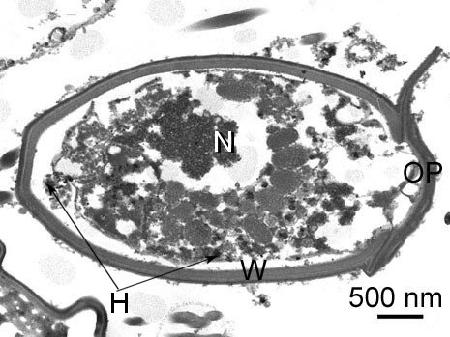
Figure 4. Coupe d'une spore d'une espèce d'haplosporidien non déterminée provenant d'une Venerupis philippinarum du Japon. OP, opercule; H, haplosporosome; N, noyau; et p, paroi de la spore. Image fournie par Naoki Itoh Ph. D.
Méthodes de contrôle
On ne connaît pas de méthode de prévention ou de contrôle.
Références
Armstrong, D.A. et J.L. Armstrong. 1974. A haplosporidan infection in gaper clams, Tresus capax (Gould), from Yaquina Bay, Oregon. Proceedings of the National Shellfisheries Association 64: 68-72.
Azevedo, C. 2001. Ultrastructural description of the spore maturation stages of the clam parasite Minchinia tapetis (Vilela, 1951) (Haplosporida: Haplosporidiidae). Systematic Parasitology 49: 189-194.
Azevedo, C., R.F. Conchas et J. Montes. 2003. Description of Haplosporidium edule n. sp. (Phylum Haplosporidia), a parasite of Cerastoderma edule (Mollusca, Bivalvia) with complex spore ornamentation. European Journal of Protistology 39: 161-167.
Burreson, E.M. and S.E. Ford. 2004. A review of recent information on the Haplosporidia, with special reference to Haplosporidium nelsoni (MSX disease). Aquatic Living Resources 17: 499-517.
Carballal, M.J., D. Iglesias, J. Santamarina, B. Ferro-Soto et A. Villalba. 2001. Parasites and pathologic conditions of the cockle Cerastoderma edule populations of the coast of Galicia (NW Spain). Journal of Invertebrate Pathology 78: 87-97.
Chagot, D., Bachère, E., Ruano, F., Comps, M. et Grizel, H. 1987. Ultrastructural study of sporulated instars of a haplosporidian parasitizing the clam Ruditapes decussatus. Aquaculture 67: 262-263.
Darriba, S., D. Iglesias, M. Ruiz, R. Rodriguez and C. López. 2010. Histological survey of symbionts and other conditions in razor clam Ensis arcuatus (Jeffreys, 1865) (Pharidae) of the coast of Galicia (NW Spain). Journal of Invertebrate Pathology 104: 23-30.
Figueras, A., J.A.F. Robledo et B. Novoa. 1992. Occurrence of haplosporidian and Perkinsus-like infections in carpet-shell clams, Ruditapes decussatus (Linnaeus, 1758), of the Ria de Vigo (Galicia, NW Spain). Journal of Shellfish Research 11: 377-382.
Hine, P.M., R.B. Carnegie, E.M. Burreson and M.Y. Engelsma. 2009. Inter-relationships of haplosporidians deduced from ultrastructural studies. Diseases of Aquatic Organisms 83: 247-256.
Itoh, N., K. Momoyama et K. Ogawa. 2005. First report of three protozoan parasites (a haplosporidian, Marteilia sp. and Marteilioides sp.) from the Manila clam, Venerupis (=Ruditapes) philippinarum in Japan. Journal of Invertebrate Pathology 88: 201-206.
Joly, J.-P. and M. Comp. 1979. Etude ultrastructurale d'une haplosporidie parasite de la palourde Tapes decussatus L. Conseil International pour l'Exploration de la Mer C.M. 1979/F:20: 5 pp. (In French with English abstract).
Navas, J.I., M.C. Castillo, P. Vera et M. Ruiz-Rico. 1992. Principal parasites observed in clams, Ruditapes decussatus (L.), Ruditapes philippinarum (Adam et Reeve), Venerupis pullastra (Montagu) and Venerupis aureus (Gmelin), from the Huelva coast (S.W. Spain). Aquaculture 107: 193-199.
Villalba, A. et J.I. Navas. 1988. Occurrence of Minchinia tapetis and a Perkinsus-like parasite in cultured clams, Ruditapes decussatus and R. philippinarum, from south Atlantic coast of Spain. Preliminary results. In: F.O. Perkins and T.C. Cheng (eds.). Abstracts, Third International Colloquium on Pathology in Marine Aquaculture, 2-6 Oct. 1988, Gloucester Point, VA. Virginia Institute of Marine Science, Gloucester Point, p. 57-58.
Villalba, A., M.J. Carballal, C. López, A. Cabada, L. Corral and C. Azevedo. 1999. Branchial rickettsia-like infection associated with clam Venerupis rhomboides mortality. Diseases of Aquatic Organisms 36: 53-60.
Citation
Bower, S.M. (2014) : Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement : Infection haplosporidienne des palourdes.
Date de la dernière révision : Avril 2014
Faire parvenir les commentaires à Susan Bower
- Date de modification :