Néoplasie hémocytaire des moules
Sur cette page
Catégorie
Catégorie 2 (au Canada et d'intérêt régional)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Néoplasie hémique, hématopoïétique ou hémocytaire (NHC), néoplasie disséminée.
Nom scientifique ou classification taxonomique
Maladie d'origine inconnue, mais qui peut être attribuée à plusieurs causes représentant un complexe de maladies, possiblement liées à un rétrovirus dans certains cas sur la côte ouest de l'Amérique du Nord et en Europe. La plupart des hémocytes néoplasiques chez Mytilus trossulus sont tétraploïdes ou pentaploïdes (Moore et al. 1991). Étant donné que le type de cellules progénitrices n'a pas encore été clairement établi, le nom le plus conservateur, néoplasie disséminée, est probablement plus approprié pour cette maladie.
Répartition géographique
Royaume-Uni, Scandinavie, est et ouest de l'Amérique du Nord, notamment le Canada.
Espèces hôtes
Mytilus edulis, Mytilus trossulus et Mytilus galloprovincialis; les huîtres, et les palourdes sont également touchées, mais l'étiologie pourrait être différente.
Impact sur les hôtes
Les hémocytes néoplasiques (cellules mytilicoles proliférantes) apparaissent dans la circulation et remplacent progressivement les hémocytes normaux ainsi que les processus physiologiques normaux. La prévalence de cette maladie est généralement de moins de 4 % chez les moules d'Europe et de la côte est de l'Amérique du Nord. Toutefois, elle peut excéder 40 % à certains endroits de la côte ouest de l'Amérique du Nord. Chez M. trossulus de la baie Puget, dans l'État de Washington, et en Colombie-Britannique, la néoplasie hémocytaire peut être transmise par la cohabitation, est progressive, perturbe les mécanismes de défense et est mortelle. La mortalité cumulative annuelle dépasse souvent 75 % chez les moules dont la coquille fait plus de 4 cm de longueur. Toutefois, une rémission a été observée chez 10 à 20 % des moules examinées. Même si la néoplasie hémocytaire peut avoir un rôle à jouer dans le taux de mortalité élevé, les stocks de moules de cette région peuvent avoir une courte durée de vie (en comparaison de certains stocks ou espèces de moules sur la côte est du Canada) et un cycle vital au cours duquel la reproduction est suivie d'une sénescence et du décès. Chez ces moules, la néoplasie hémocytaire peut être l'une des nombreuses conséquences de la sénescence. Cette hypothèse est appuyée par le fait qu'il n'y a pas de pénurie de petites moules et que le recrutement des moules est élevé malgré la fréquence de la néoplasie hémocytaire et du taux de mortalité élevé lorsque les moules ont entre 12 et 24 mois. D'autres stocks ou espèces de moules semblent résistants au type de néoplasie hémocytaire de la côte ouest (Brooks 1991). L'idée avancée par Rasmussen (1986), selon laquelle cette néoplasie pourrait être liée à un virus, reste à prouver.
Techniques de diagnostic
Frottis
L'hémolymphe provenant du cœur contient de nombreux hémocytes anormaux, comme cela est décrit dans la section Histologie.
Histologie
&nbs;: Infiltration intense des hémocytes anormaux (très peu de cytoplasme par rapport au nucléoplasme et noyaux hypertrophiés et souvent pléomorphes) et présence évidente de figures mitotiques. La prolifération massive des hémocytes peut provoquer une diapédèse de gros amas de cellules ou une occlusion vasculaire dans les cas les plus graves.
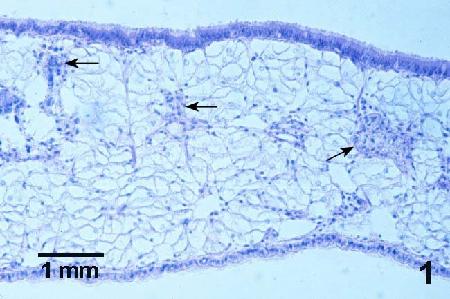
Figure 1. Coupe histologique du manteau d'une moule juvénile normale (sans doute Mytilus trossulus). Les tissus gonadaux non développés (flèches) sont entourés de cellules du tissu conjonctif vésiculaire. Coloration à l'hématoxyline et à l'éosine.
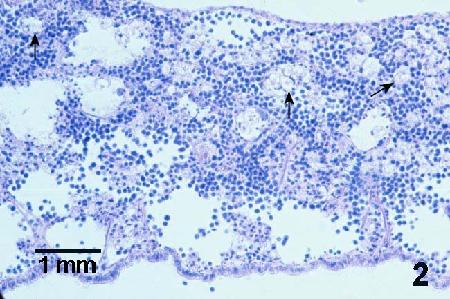
Figure 2. Coupe histologique du manteau d'une moule juvénile (sans doute Mytilus trossulus) à un stade avancé de néoplasie hémocytaire. L'architecture normale du tissu conjonctif est perturbée. Il reste très peu de tissu conjonctif vésiculaire intact (flèches), et il est considérablement envahi d'hémocytes anormaux (qui sont facilement observables à ce faible grossissement par la présence du leur noyau basophile hypertrophié). Coloration à l'hématoxyline et à l'éosine.
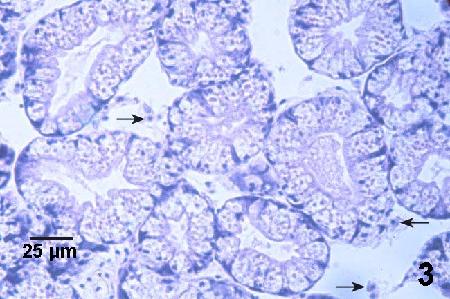
Figure 3. Coupe histologique du manteau de la glande digestive d'une moule normale (sans doute Mytilus trossulus). On peut voir la présence de seulement quelques hémocytes normaux (flèches) dans les espaces entre les tubules. Coloration à l'hématoxyline et à l'éosine.
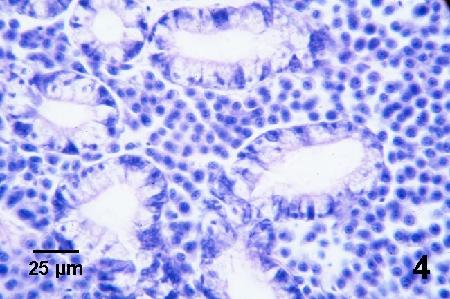
Figure 4. Coupe histologique de la glande digestive d'une moule juvénile (sans doute Mytilus trossulus) à un stade avancé de néoplasie hémocytaire. Une abondance d'hémocytes anormaux, chacun contenant un noyau hypertrophié entouré d'une faible quantité du cytoplasme périphérique avec deux nucléoles ou plus, sont présents dans l'espace entre les tubules. Coloration à l'hématoxyline et à l'éosine.
Histocytologie (hémocytologie)
: Examiner les hémocytes afin de déceler les caractéristiques décrites à la section Histologie. Les hémocytes malades se regroupent et les pseudopodes n'adhèrent pas bien à la lame de microscope.
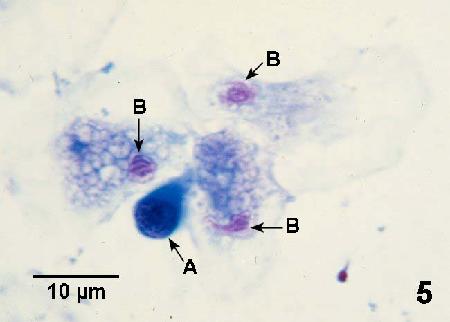
Figure 5. Hémocytes d'une moule (sans doute Mytilus trossulus) à un stade précoce de néoplasie hémocytaire dans une préparation histocytologique. Un hémocyte anormal (A) avec un noyau hypertrophié et très peu de cytoplasme est situé près de trois hémocytes normaux ayant un noyau éosinophilique (B). Le cytoplasme est étalé en une fine couche sur la surface de la lame de verre. Coloration Wright-Giemsa.
Essai immunologique
Les anticorps monoclonaux produits contre les hémocytes néoplasiques de moules de la baie Puget, dans l'État de Washington, n'ont pas réagi avec les cellules normales et ont été proposés comme immunoessai adéquat pour le diagnostic et la qualification de la néoplasie hémocytaire chez les moules (Noël et al. 1991).
Méthodes de contrôle
On ne connaît pas de méthode de prévention ou de contrôle. En raison de la nature clairement contagieuse de la néoplasie hémocytaire, il convient de redoubler d'efforts pour éviter d'introduire un élevage infecté (actuellement ou dans le passé). À ce jour, la possibilité d'une transmission croisée (entre les espèces de bivalves) n'a pas été clairement démontrée. L'effet de la maladie peut être atténué en conservant les populations d'élevage à des densités aussi faibles que possible, en effectuant la récolte avant la période typique de la mortalité accrue (automne et hiver) et en récoltant les stocks le plus tôt possible (puisque la gravité de l'infection semble augmenter avec l'âge).
Références
Barber, B.J. 2004. Neoplastic diseases of commercially important marine bivalves. Aquatic Living Resources 17: 449-466.
Bower, S.M. 1989. The summer mortality syndrome and haemocytic neoplasia in blue mussels (Mytilus edulis) from British Columbia. Canadian Technical Report of Fisheries and Aquatic Sciences 1703: 1-65.
Brooks, K.M. 1991. The genetics and epizootiology of hemic neoplasia in Mytilus edulis. Ph.D. Thesis, School of Fisheries, University of Washington, Seattle, Washington, USA.
Cosson-Mannevy, M.A., C.S. Wong et W.J. Cretney. 1984. Putative neoplastic disorders in mussels (Mytilus edulis) from southern Vancouver Island waters, British Columbia. Journal of Invertebrate Pathology 44: 151-160.
Elston, R.A., M.L. Kent et A.S. Drum. 1988a. Progression, lethality and remission of hemic neoplasia in the bay mussel, Mytilus edulis. Diseases of Aquatic Organisms 4: 135-142.
Elston, R.A., M.L. Kent et A.S. Drum. 1988b. Transmission of hemic neoplasia in the bay mussel, Mytilus edulis, using whole cells and cell homogenate. Developmental and Comparative Immunology 12: 719-727.
Elston, R.A., J.D. Moore et K. Brooks. 1992. Disseminated neoplasia of bivalve molluscs. Reviews in Aquatic Sciences 6: 405-466.
Farley, C.A. 1976. Proliferative disorders in bivalve molluska. Marine Fisheries Review 38(10): 30-33.
Gee, A., J.M. Specht, D. Kerk, J.D. Moore, A.S. Drum et R.A. Elston. 1994. Disseminated neoplastic cells in Mytilus trossulus: verification of host species origin by (16S-like) rRNA sequence comparison. Molecular Marine Biology and Biotechnology 3: 7-12.
Green, M. et D.J. Alderman. 1983. Neoplasia in Mytilus edulis L. from United Kingdom waters. Aquaculture 30: 1-10.
Kent, M.L., R.A. Elston, M.T. Wilkinson et A.S. Drum. 1989. Impaired defense mechanisms in bay mussels, Mytilus edulis, with hemic neoplasia. Journal of Invertebrate Pathology 53: 378-386.
Moore, J.D., R.A. Elston, A.S. Drum et M.T. Wilkinson. 1991. Alternate pathogenesis of systemic neoplasia in the bivalve mollusc Mytilus. Journal of Invertebrate Pathology 58: 231-243.
Noël, D., V. Boulo, D. Chagot, E. Mialhe, F. Paolucci, C. Clavies, E. Hervaud et R. Elston. 1991. Preparation and characterization of monoclonal antibodies against neoplastic hemocytes of Mytilus edulis (Bivalvia). Diseases of Aquatic Organisms 10: 51-58.
Peters, E.C. 1988. Recent Investigations on the disseminated sarcomas of marine bivalve molluscs. American Fisheries Society Special Publication 18: 74-92.
Rasmussen, L.P.D. 1986. Occurrence, prevalence and seasonality of neoplasia in the marine mussel Mytilus edulis from three sites in Denmark. Marine Biology 92: 59-64.
Citation
Bower, S.M. (2006) : Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement Néoplasie hémique des moules.
Date de la dernière révision : Décembre 2006
Faire parvenir les commentaires à Susan Bower
- Date de modification :