Règlement sur les activités d'aquaculture - Document d'orientation
Table des matières
- Objet
- Contexte
- Portée de l'application
- Norme de surveillance de l'aquaculture
- Mise en œuvre
- Conséquences de la non-conformité
- Pour communiquer avec nous
- Guide article par article
- Article 1 : Définitions
- Article 2 : Substances nocives précisées
- Article 3 : Conditions applicables à l’immersion ou au rejet
- Article 4 : Installation d’aquaculture
- Article 5 : Drogues
- Article 6 : Produits antiparasitaires
- Article 7 : Mesures pour minimiser les nuisances
- Article 8 : Renseignements exigés avant immersion ou rejet
- Article 9 : Demande touchant le contour de rayonnement
- Article 10 : Échantillons du substrat et rempoissonnement
- Article 11: Surveillance visuelle du substrat
- Article 12: Avis au Ministre
- Article 13 : Présence de morbidité ou de poissons morts
- Article 14 : Rapport annuel
- Article 15 : Ouvrages, entreprises, activités visés et conditions.
- Article 16 : Rapport annuel
- Article 17 : Alinéa 35(2)a) de la Loi
- Article 18 : Enregistrement
- Annexe 1 : Modèle de rapport du RAA
- Annexe 2 : Application du RAA
- Annexe 3 : Responsables des Bureaux régionaux de gestion de l’aquaculture
- Annexe 4 : Rapport des cas de morbidité ou de mortalité
- Annexe 5: Liste des laboratoires agréés
- Annexe 6: Guide d’échantillonnage pour les drogues et les produits antiparasitaires
- Annexe 7: Norme de surveillance de l'aquaculture
- Annexe 8: Protocoles du Programme de la surveillance de la DBO relatifs à la Surveillance environnementale des poissons à nageoires en Colombie-Britannique
- Acronymes, abréviations et définitions
- 1 Stations de surveillance de la conformité
- 2 Exigences en matière de surveillance du milieu benthique et de présentation de rapports
- 3 Inspection vidéo
- 4 Échantillonnage des sédiments
- 5 Assurance de la qualité et contrôle de la qualité des échantillons de sédiments
- 6 Étalonnage de l’électrode de sulfure d’argent (Ag+/S=)
- 7 Normalisation de l’électrode de platine (Pt)
- 8 Réalisation des analyses statistiques
- Annexe 9: Protocole de surveillance des substrats benthiques dans les exploitations d'élevage de poissons de mer de Terre-Neuve-et-Labrador
- Annexe 10 : Sommaire des mesures requises
- Annexe 11: Glossaire
Document d'orientation à l'intention des propriétaires et des exploitants
Avertissement
Le Document d'orientation relatif au Règlement sur les activités d'aquaculture vise uniquement à fournir des renseignements. Il ne remplace pas la Loi sur les pêches ni ses règlements d’application. Dans l'éventualité d'une incohérence entre ce Document d'orientation et la Loi sur les pêches ou ses règlements d'application, la Loi prévaut toujours. En outre, le Règlement sur les activités d'aquaculture ne remplace ni n'abroge aucune loi provinciale ou fédérale.
Date d'entrée en vigueur et révision
Le Document d'orientation relatif au Règlement sur les activités d'aquaculture entrera en vigueur le même jour que celui du règlement. Il sera actualisé si nécessaire afin de fournir des éclaircissements lorsque le Règlement sera appliqué. La version la plus récente de ce document, ainsi que les autres documents liés au Règlement sur les activités d'aquaculture peuvent être consultés sur le site Web de Pêches et Océans Canada
Objet
Le but du présent Document d'orientation à l'intention des propriétaires et des exploitants est d'expliquer clairement ce que signifie le Règlement sur les activités d'aquaculture, de quelle façon il sera appliqué et ce que les propriétaires et les exploitants doivent faire pour se conformer à ses dispositions.
Outre le Règlement et le présent Document d'orientation, les instruments suivants appuieront l’application du RAA :
- Une norme relative à la surveillance de l'aquaculture (Norme) mentionnée dans le Règlement et devant par conséquent être respectée;
- Un Modèle de rapport du RAA (annexe 1) destiné aux détenteurs de permis; bien qu'il ne soit pas obligatoire de l'utiliser, ce modèle fournit une liste de contrôle pratique pour l'ensemble des exigences en matière de rapports du RAA.
Tous les documents portant sur le RAA sont disponibles sur le site Web de Pêches et Océans Canada en cliquant ici.
Contexte
Au Canada, l'aquaculture est gérée par différents paliers gouvernementaux. La réglementation et l'octroi de baux liés à l'aquaculture (sauf en Colombie-Britannique et à l'Île-du-Prince-Édouard) relèvent de gouvernements provinciaux principalement, tandis que la navigation, la prévention des maladies nuisant au commerce international et l'environnement relèvent du gouvernement fédéral, conformément à la Loi sur les pêches et la Loi sur la santé des animaux.
Le 25 novembre 2013, la Loi sur les pêches a été modifiée pour que la disposition sur la protection des pêches (article 35) porte essentiellement sur les menaces qui pèsent sur la productivité des pêches commerciales, récréatives et autochtones. La disposition relative à la prévention de la pollution (article 36), qui interdit l’immersion ou le rejet de substances nocives dans des eaux où vivent des poissons, à moins qu'ils ne soient autorisés par règlement, n'a pas été modifiée.
En mars 2014, un décret (connu sous le nom de décret de désignation en vertu de l'article 36) délimite clairement les responsabilités d'Environnement Canada (EC) et de Pêches et Océans Canada (MPO) en matière de gestion des menaces dues aux substances nocives (aux termes de l'article 36). En vertu de ce décret de désignation, le ministre de l'Environnement est responsable de toutes les questions liées à l’immersion ou au rejet de substances nocives sauf celles concernant l'utilisation de telles substances aux fins de la gestion de l'aquaculture, de celle des espèces aquatiques envahissantes et de celle des parasites aquatiques. Dans ces domaines, le ministre des Pêches et des Océans est l'autorité responsable.
Le Règlement sur les activités d'aquaculture (RAA) est établi conformément aux pouvoirs de réglementation du Ministère énoncés aux paragraphes 35(3) et 36(5.2) de la Loi sur les pêches. Ce Règlement fondé sur le risque a été élaboré afin de clarifier les aspects juridiques relatifs aux activités courantes d'une installation d’aquaculture : les activités liées à la structure et l'entretien de l'installation elle-même, et celles destinées à protéger les poissons d'élevage des parasites et des agents pathogènes provenant du milieu marin, ainsi qu’à éviter que ces parasites et agents pathogènes ne se transmettent aux poissons sauvages.
Les trois catégories de substances auxquelles s'applique le RAA (drogues, pesticides et matières exerçant une demande biochimique en oxygène [DBO]) sont déjà gérées en grande partie par les autorités provinciales et les autres autorités fédérales. Certaines provinces pratiquant la pisciculture en milieu marin ont déjà défini des limites de DBO afin de minimiser l'effet des dépôts organiques. Comme conditions de permis pour les sites de pisciculture en eau douce, l'Ontario a publié le document « Objectifs en matière de qualité des sédiments, surveillance et intervention de gestion ». De plus, les provinces et Santé Canada ont des responsabilités complémentaires en matière de gestion de l'utilisation des drogues et des pesticides. Le RAA regroupe tous ces textes législatifs provinciaux et fédéraux afin de mieux protéger le poisson et son habitat et de conformer l’aquaculture à l’esprit et l’intention de la Loi sur les pêches.
Portée de l'application
- Application aux aquaculteurs
Le RAA s'applique à toutes les installations d'aquaculture du Canada qui détiennent un permis provincial ou fédéral et dont les activités peuvent entraîner un rejet de substances nocives dans les eaux où vivent des poissons ou causer des dommages sérieux aux poissons qui contribuent à ces pêches et qui font l'objet ou soutiennent une pêche commerciale, récréative ou autochtone. Le Règlement s'applique aux poissons marins et d'eau douce (y compris ceux des écloseries) et aux mollusques et crustacés. Toutefois, les articles 8 à 12 visent seulement les installations qui élèvent du poisson et qui sont situées dans des eaux de marée. Les viviers et parcs à homards, les fascines à hareng et les autres installations de conservation pour les espèces capturées dans la nature ne sont pas visés ou concernés par ce Règlement.
Le Règlement vise à autoriser, sous certaines conditions, toutes les installations visées à réaliser deux types d'activité :
- l’immersion ou le rejet de substances nocives (article 36 de la Loi sur les pêches). Ces propriétaires ou exploitants sont autorisés à immerger ou rejeter uniquement les drogues dont la vente est permise aux termes de la Loi sur les aliments et drogues, les produits antiparasitaires homologués ou autorisés en vertu de la Loi sur les produits antiparasitaires et les matières organiques (par exemple, aliments aquacoles, excréments, biosalissures) utilisées pour la production de poissons d'élevage. Les propriétaires et les exploitants ne peuvent immerger ou rejeter de drogues et de produits antiparasitaires qu'après avoir déterminé qu'ils constituaient le moyen le plus adapté et le plus efficace de lutter contre un parasite ou un agent pathogène du poisson, et que la non-utilisation de ce traitement aurait des conséquences néfastes sur la santé des poissons et créerait un risque de transmission de la maladie.
- des activités opérationnelles susceptibles de causer des dommages sérieux aux poissons qui contribuent à ces pêches et qui font l’objet ou soutiennent une pêche commerciale, récréative ou autochtone (article 35 de la Loi sur les pêches). Ces activités sont autorisées uniquement si l'installation dispose d'un permis et seulement si le propriétaire ou l'exploitant prend des mesures pour minimiser les dommages sérieux causés à ces poissons et à leur habitat.
Étant donné que le Règlement est fondé sur le risque, ce ne sont pas toutes les exigences énoncées dans le RAA qui s'appliqueront à chaque site aquacole. Le tableau de l'annexe 2 fournit une vue d'ensemble de la portée de l'application et indique quels articles du Règlement s'appliquent aux différents types d'installation d’aquaculture. Ces exigences sont également détaillées dans le Modèle de rapport du cadre du RAA (annexe 1).
Le Règlement ne remplace ou n'abroge aucune loi provinciale ou fédérale existante. Le Règlement n'encadre pas l'approbation, l'application ou tout autre aspect de l'utilisation des drogues ou des pesticides, ni l'élimination des déchets de poisson issus de la transformation du poisson.
Le MPO ne délivrera pas de permis en vertu du RAA qui institue plutôt l'autorisation et définit les conditions à remplir pour respecter les articles 35 et 36 de la Loi. Le RAA n'aura pas d'effet sur la manière dont les installations d’aquaculture obtiennent actuellement un permis auprès des autorités provinciales ou territoriales compétentes, ou auprès du MPO en Colombie-Britannique et à l'Île-du-Prince-Édouard. La définition de « permis d'aquaculture » indiquée dans le Règlement reflète ce statu quo.
Toutefois, les installations d’aquaculture qui n'ont pas de permis d'aquaculture (qui peut être provincial ou fédéral et inclut un bail précisant les conditions d'exploitation) ne sont pas couvertes par le RAA et sont donc en tout temps assujetties aux articles 35 et 36 relatifs aux interdictions et au contrôle de l’application de la Loi sur les pêches.
Le MPO est responsable de l’application et du respect du RAA ; il a travaillé à l'élaboration du Règlement en étroite collaboration avec d'autres autorités fédérales et provinciales afin d'éviter les chevauchements de prérogatives et les contradictions. Le Règlement s'harmonise avec les programmes et les régimes de réglementation qui existent déjà dans les instances provinciales et les autres instances fédérales, afin de minimiser la répétition des exigences administratives tout en garantissant l’atteinte des objectifs de protection de l'environnement inscrits à la loi. Les exigences en matière d'atténuation et de surveillance prévues par ce Règlement codifient, autant que faire se peut, les exigences et les pratiques de l'industrie déjà existantes en vertu des régimes de réglementation provinciaux et fédéraux pertinents, tout en introduisant de nouvelles mesures économiques pour permettre au gouvernement fédéral de mieux coordonner la gestion des pesticides et des drogues utilisés pour lutter contre les parasites et les agents pathogènes dans les sites aquacoles.
- Application à l'Agence canadienne d'inspection des aliments
Le Règlement s'applique aussi à l'Agence canadienne d'inspection des aliments (ACIA) : il autorise le président de l'ACIA à immerger ou à rejeter des substances nocives et à éliminer des poissons aux fins de la mise en œuvre de la Loi sur la santé des animaux (par exemple, la lutte contre les biosalissures, les parasites ou les agents pathogènes du poisson dans une installation d’aquaculture). Ces activités sont susceptibles de causer un préjudice au poisson et à l'habitat du poisson en dehors de l'installation et l'ACIA peut demander au propriétaire ou à l'exploitant d'une installation de mener cette activité en son nom. Il peut arriver que les employés de l'ACIA réalisent ces activités eux-mêmes. Dans les deux cas, l'ACIA est également autorisée en vertu des articles 35 et 36 de la Loi sur les pêches.
- Application à l'implantation des installations d’aquacultures
À l'heure actuelle, le RAA exige uniquement des renseignements venant appuyer les décisions d'implantation d'une pisciculture en milieu marin lorsque demandé par les provinces. Pour tous les autres types d'installation, le MPO continuera à suivre les processus existants (exigences communes pour les demandes de site), en collaboration avec les provinces, pour obtenir tout renseignement dont il aurait besoin pour évaluer les menaces potentielles pesant sur le poisson ou l'habitat du poisson (y compris les espèces protégées par la Loi sur les espèces en péril). Que ce soit par l'intermédiaire du RAA ou par d'autres processus de collecte de renseignements, le MPO continuera de recommander aux provinces de soutenir des décisions d'implantation, par le biais des Bureaux régionaux de gestion de l’aquaculture (BRGA) comme guichet unique pour les provinces.
Le Programme de protection des pêches et le Programme des espèces en péril du MPO seront toujours associés au processus relatif à l'emplacement des installations d’aquaculture. Ils continueront à examiner les demandes et à transmettre les conclusions de leurs examens aux autorités qui délivrent les permis, sauf en Colombie-Britannique. Le Règlement ne modifie pas les responsabilités et les obligations des propriétaires et des exploitants prévues par la Loi sur les espèces en péril.
- Examen scientifique
Avec l'évolution des connaissances et de la technologie, d'autres contrôles ou modifications des mesures actuelles d'atténuation et de surveillance s'avéreront peut-être nécessaires. À cette fin, le MPO et ses partenaires fédéraux se sont engagés à réaliser un examen scientifique de trois ans afin de soutenir le processus d’application du RAA. L’engagement du MPO vis-à-vis du processus sera coordonné par la Direction scientifique de l’aquaculture, des biotechnologies et de la santé animale à Ottawa, incluant les experts du Groupe national consultatif sur les contaminants du MPO. L'un des principaux objectifs de cet examen scientifique concerne l'étude des méthodes de surveillance de la matière organique exerçant une DBO dans les sites piscicoles dulcicoles et les sites en milieu marin sur fonds durs, ainsi que les techniques de surveillance relatives aux drogues et pesticides. Les avis scientifiques seront fournis par le Secrétariat canadien de consultation scientifique ; les analyses scientifiques et conseils revus par les pairs seront publiés sur le site Web du MPO du Secrétariat canadien de consultation scientifique (SCCS). Le Ministère tiendra compte des recommandations émises à la suite des résultats de l’examen scientifique revu par les pairs pour modifier le Règlement et/ou la Norme en cas de nécessité.
Norme relative à la surveillance de l'aquaculture
La Norme relative à la surveillance de l'aquaculture (Norme) est un document intégré par renvoi au Règlement sur les activités d'aquaculture. L'« incorporation par renvoi » est une expression utilisée pour décrire le mécanisme qui permet d'intégrer à la réglementation un document qui n'est pas dans le texte du Règlement. Cette intégration pourrait se faire en recopiant mot à mot, dans le Règlement, le texte du document à incorporer. Sinon, il est possible de simplement mentionner le titre du document, rendant ainsi le contenu de ce document « incorporé par renvoi ». La conséquence juridique de l’incorporation par renvoi est que le libellé du document incorporé est intégré au Règlement comme s’il y avait été reproduit intégralement.
On fait référence à la Norme aux articles 8, 9, 10 et 11 du RAA. Afin de se conformer au Règlement, les propriétaires et les exploitants doivent utiliser les procédures décrites dans la Norme lorsqu'ils mènent les activités définies dans ces articles. Les exigences du MPO en matière de surveillance de la DBO dans les provinces de la Colombie-Britannique et de Terre-Neuve-et-Labrador sont décrites plus en détail dans les protocoles figurant aux annexes 8 et 9, respectivement. Les indications sur la surveillance de la DBO dans les autres provinces et territoires sont fournies dans les conditions de permis ou les autres exigences propres à ces régions.
Mise en œuvre
Le RAA sera principalement mis en œuvre par la Direction générale de la gestion de l'aquaculture, notamment les Bureaux régionaux de gestion de l’aquaculture, Conservation et Protection (C et P), le Programme de protection des pêches (PPP) et la Direction des sciences de l'aquaculture, et ce, selon les modalités suivantes :
- Bureaux régionaux de gestion de l’aquaculture (BRGA) :
- Seront le principal point de contact pour la communication avec l'industrie;
- recevront les avis [alinéa 6a), les rapports requis en vertu des articles 8 et 9, ceux relatifs au dépassement des seuils de DBO selon l’article12(3) et les rapports annuels prévus à l'article 16. Les BRGA communiqueront avec C et P, PPP, la Direction des sciences de l'aquaculture et la Gestion des pêches pour déterminer la morbidité ou la mortalité et les exigences en matière d'échantillonnage [par. 13(2)];
- pourront chacun créer une liste des sites aquacoles de la région, avec le nom et les coordonnées du propriétaire ou de l'exploitant. Cette liste peut servir à repérer tout cas de non-conformité concernant les rapports annuels;
- transmettront les questions des propriétaires et des exploitants au sujet du Règlement, du Document d'orientation à l'intention des propriétaires et des exploitants et de la Norme à l'administration centrale de la DGGA aux fins d'interprétation.
- Direction générale de la gestion de l’aquaculture (DGGA) - supervision nationale :
- Veillera à la cohérence de l'interprétation et de la mise en œuvre à l'échelle nationale en actualisant le Document d'orientation;
- créera et gérera la base de données sur les rapports;
- sera responsable de la préparation de l'ensemble des rapports publics.
- Conservation et Protection (C et P)
- Collaborera avec EC pour garantir un transfert approprié et exhaustif des connaissances sur la conformité et l'application pendant la période de transition de trois ans;
- recevra les rapports des propriétaires et des exploitants sur les incidents de morbidité et de mortalité [par. 13(1)], et en consultation avec les BRGA et les autres experts, donnera des instructions sur l'échantillonnage à réaliser [par. 13(2)] conformément à la Norme;
- si nécessaire, et en consultation avec les BRGA, l'agent des pêches pourras effectuer un suivi auprès des propriétaires et des exploitants qui ne remplissent pas leur rapport annuel comme l'exige l'article 16;
- si nécessaire, et en consultation avec les BRGA s'il y a lieu, C et P pourra prendre des mesures d'application de la loi et de conformité telles que des inspections de sites aquacoles, des enquêtes, des avertissements ou des poursuites pour non-conformité. C et P pourra également mener des inspections annuelles de sites aquacoles en fonction de ses priorités ministérielles générales afin de vérifier la conformité avec le RAA;
- C et P pourra prendre des mesures d'application de la loi soit directement en vertu du RAA, soit en vertu des articles 35,36 et 49 de la Loi sur les pêches.
- Programme de protection des pêches (PPP), Programme des espèces en péril (PEP), et Gestion des pêches (GP)
- Fourniront si nécessaire des suggestions au BRGA sur l'emplacement des sites d'aquaculture marine, en se basant sur les données obtenues par l'entremise du RAA (articles 8 et 9);
- concernant les dispositions de l’article35 dans le RAA, le PPP peut fournir au BRGA des conseils spécialisés sur l’interprétation des données.
- Sciences de l’écosystème et de l’océan (SEO)
- La Direction scientifique de l’aquaculture, des biotechnologies et de la santé animale, complétée par l’expertise trouvée auprès du Groupe national consultatif sur les contaminants rattaché à la Direction scientifique de l’environnement et de la biodiversité du MPO, pilotera l'élaboration et la mise en œuvre de l'examen scientifique qui se penchera sur la surveillance des drogues et des produits antiparasitaires après leur immersion ou rejet;
- fournit un avis scientifique relatif à l’impact de la matière organique à l’origine de la DBO, ainsi que sur les protocoles de surveillance de l’aquaculture marine des poissons à nageoires localisée sur des fonds où des échantillons de sédiments ne peuvent être prélevés, ainsi qu’en milieu dulcicole;
- fournit des avis scientifiques concernant les procédures à suive pour la collecte de carcasses de poissons sauvages aux fins d’analyse chimique des ingrédients actifs contenus dans les produits chimiothérapiques utilisés contre les poux du poisson;
- fourniront, par l’intermédiaire de leurs bureaux régionaux, des observations et des avis scientifiques relatifs à la localisation et l’aménagement de sites. Cette prestation fera partie de la consultation que le MPO offrira à la province au titre de la contribution du Ministère au processus provincial de prise de décision d’aménagement de nouveaux sites aquacoles;
- seront impliqués, tant au niveau national que régional, dans le seront impliqués dans le triage du traitement des rejets après immersion pour déterminer les exigences d’échantillonnage en as de morbidité/mortalité [article 13(2)].
Conséquences de la non-conformité
Si l'une des conditions du RAA n'est pas respectée, les articles 35 et 36 de la Loi s'appliquent immédiatement, en fonction de la nature de l'infraction. En conséquence, le MPO ou les agents ayant autorité dans plus d'une compétence dans les provinces intérieures peuvent engager des poursuites pour infraction en vertu de l'article 40 de la Loi. Les infractions sont passibles d'une amende maximale de huit millions de dollars et d'une peine d'emprisonnement maximale de six mois en cas de déclaration de culpabilité par procédure sommaire, et d'une amende maximale de 12 millions de dollars et d'une peine d'emprisonnement maximale de trois ans en cas de déclaration de culpabilité par mise en accusation. Toute contravention répétée du RAA constitue une infraction distincte pour chaque jour de la contravention.
Les Canadiens sont encouragés en tout temps à signaler toute infraction liée aux pêches dont ils sont témoins. Dans toute province ou territoire, il suffit de composer le numéro d'Échec au crime, soit le 1800222TIPS (8477) ou soit le numéro provincial indiqué sur le site Web du MPO.
Pour communiquer avec nous
Les utilisateurs de ce Document d'orientation sont invités à soumettre leurs questions et leurs commentaires aux Bureaux régionaux de gestion de l’aquaculture (voir l'annexe 3 pour les coordonnées). À mesure que le RAA sera appliqué, de nouvelles modifications s'avéreront peut-être nécessaires et des clarifications importantes seront susceptibles d'être publiées à tout moment. Le Document d'orientation sera officiellement révisé une fois par an. Cependant, la version la plus récente du Document d'orientation sera consultable sur le site Web du MPO.
Guide article par article
Article 1 : Définitions
Règlement sur les activités d'aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Définitions |
Certains termes ne sont pas définis dans le Règlement pour l'une des raisons suivantes :
Le Document d'orientation indique un nombre de termes qui font l’objet d’une interprétation. Les mots en gras et en italique sont définis dans le glossaire à l'annexe 11. |
Article 2 : Substances nocives précisées
| Règlement sur les activités d’aquaculture | Directives à l’intention des propriétaires et exploitants |
|---|---|
Substances nocives |
Objectif : Directives : |
Article 3 : Conditions applicables à l’immersion ou au rejet
Règlement sur les activités d’aquaculture |
Directives à l’intention des propriétaires et exploitants |
|---|---|
Immersion ou rejet |
Objectif : Directives :
|
Article 4 : Installation d’aquaculture
Règlement sur les activités d’aquaculture |
Directives à l’intention des propriétaires et exploitants |
|---|---|
Conditions |
Objectif : Directives :
Par « installation d'aquaculture », on entend l'endroit où les activités d'aquaculture sont menées. Elle inclut les parcs en filet, les passerelles, les barges, les structures flottantes, les réservoirs, les navires (par exemple, bateaux ou viviers) et le logement pour le personnel ainsi que les lignes et les ancres connexes. L'équipement utilisé pour l'élevage, la manipulation ou le transport des poissons, ou le nettoyage (y compris le nettoyage des filets à l'extérieur du site) la désinfection et l'entretien des structures physiques de l'exploitation (sous contrat de location ou non) est considéré comme faisant partie de l'installation. |
Article 5 : Drogues
Règlement sur les activités d’aquaculture |
Directives à l’intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : |
Objectif : Directives :
De plus, avant de décider d’utiliser une drogue, les propriétaires et les exploitants doivent tenir compte d’autres technologies, dont certaines sont encore en développement, notamment :
|
Article 6 : Produits antiparasitaires
Règlement sur les activités d’aquaculture |
Directives à l’intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : Résumé des actions exigées |
Objectif : Directives :
Tous les produits pour lutter contre le pou du poisson sont déclarés
En vertu de l’alinéa 6d), tout propriétaire ou exploitant qui prévoit d’immerger ou de rejeter un produit antiparasitaire doit, au moins 72 heures avant l’immersion ou le rejet du produit, aviser le Bureau régional de gestion de l’aquaculture. Le propriétaire ou l’exploitant doit fournir le nom du produit ainsi que de la date, l’heure et l’endroit de l’immersion ou du rejet. L’endroit doit être décrit le plus précisément possible, au moyen des coordonnées GPS ou d’un équivalent.
Le non-respect de l’obligation d’aviser les représentants concernés dans les délais prescrits constitue une violation du RAA. Le cas échéant, le propriétaire ou l’exploitant perd son autorisation en vertu du RAA et peut dès lors, être visé par les dispositions d’application de la Loi sur les pêches(voir la section « Conséquences de la non-conformité»). Si les conditions d’immersion ou de rejet propres aux pesticides sont enfreintes, ou si des pesticides illégaux sont utilisés, l’Agence de réglementation de la lutte antiparasitaire de Santé Canada peut également engager des poursuites en application de la Loi sur les produits antiparasitaires et de la Loi sur les contraventions |
Article 7 : Mesures pour minimiser les nuisances
Règlement sur les activités d’aquaculture |
Directives à l’intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : Fèces et aliments non consommés Consulter : |
Objectif : Directives : |
- Exemples de mesures pour réduire les effets nuisibles des drogues (selon le modèle de rapport du Règlement sur les activités d’aquaculture, section 3a) :
- vaccins servant à minimiser l’utilisation d’antibiotiques ou de drogues pour lutter contre le pou du poisson;
- méthodes antiparasitaires mécaniques ou biologiques visant à minimiser l’utilisation d’antibiotiques ou de drogues pour lutter contre le pou du poisson;
- procédures de manutention et densités de mise en charge visant à minimiser le stress et le risque de blessure chez les poissons et, conséquemment, l’utilisation, l’immersion ou le rejet de drogues;
- suppléments nutritifs et aliments pour poissons servant à maintenir une santé optimale des poissons et à réduire l’utilisation de drogues;
- procédures servant à limiter l’exposition des poissons infectés aux autres poissons sur place ou dans les sites à proximité par la mise en œuvre des mesures d’isolation et de confinement;
- procédures visant à désinfecter le personnel et l’équipement au moyen de produits efficaces pour l’ensemble des engins, du personnel, de l’équipement et des plateformes de travail, y compris les embarcations, au moment des déplacements entre les installations et entre les structures de confinement, comme des parcs en filet ou des réservoirs;
- mesures de contrôle visant à réduire les interactions avec les prédateurs dans le but de réduire le stress pour les poissons, notamment dans le cas d’e l’entreposage des aliments visant à attirer le moins possible les autres animaux, à l’élimination hors site des résidus alimentaires et à l’utilisation de dispositifs d’exclusion physique, ce qui permet de minimiser le besoin de drogues ;
- procédures visant à limiter les déplacements du personnel, des entrepreneurs, des fournisseurs et des visiteurs dans les installations et entre celles-ci, en cas d’épidémie de maladie infectieuse soupçonnée ou avérée;
- procédures visant à limiter le prêt d’équipement ou d’engins, notamment des véhicules, des structures flottantes, des filets et des contenants, entre les sites actifs;
- mise en jachère des zones d’exploitation visant à aider à rompre les cycles de maladie entre les stocks de poissons successifs;
- séparation selon les classes d’âge (un stock d’une classe d’âge de poissons sur une seule zone d’exploitation et dans une zone désignée de la baie afin de minimiser le transfert intergénérationnel d’agents pathogènes ou de parasites entre les poissons ).
- Exemples de mesures pour réduire les effets nuisibles des produits antiparasitaires (selon le modèle de rapport du Règlement sur les activités d’aquaculture, section 3b) :
- utilisation de moyens mécaniques ou biologiques pour la lutte contre les parasites;
- suivi des instructions figurant sur les étiquettes des pesticides se rapportant aux concentrations optimales, à la manière de s’en servir, à la façon d’éviter un déversement et à la prévention d’une nouvelle infection;
- manutention des pesticides par un utilisateur agréé conformément à la réglementation provinciale;
- utilisation de procédures appropriées pour l’entreposage, l’élimination et le nettoyage du matériel afin d’éviter trop de rejets de pesticides ;
- application limitée de pesticides dans un temps précis, et ce, afin de minimiser l’exposition des organismes non ciblés ;
- utilisation de vaccins pour minimiser l’utilisation de produits antiparasitaires ;
- procédures de manutention et densités de mise en charge visant à limiter le stress et le risque de blessure chez les poissons pour minimiser l’utilisation ainsi que l’immersion ou le rejet de pesticide;
- suppléments nutritifs et aliments pour poissons servant à maintenir une santé optimale des poissons pour réduire l’utilisation de produits antiparasitaires;
- procédures servant à minimiser l’exposition des poissons infectés aux autres poissons sur place ou dans les sites à proximité en mettant en œuvre des mesures d’isolation et de confinement ;
- mesures de contrôle visant à réduire les interactions avec les prédateurs dans le but de minimiser le stress pour les poissons, notamment en ce qui a trait à l’entreposage des aliments pour attirer le moins possible les autres animaux, à l’élimination hors site des résidus alimentaires et à l’utilisation de dispositifs d’exclusion physique, ce qui permet de minimiser le besoin de pesticides ;
- mise en jachère des zones d’exploitation visant à aider à rompre les cycles de maladie entre les stocks de poissons successifs;
- séparation selon les classes d’âge (un stock d’une classe d’âge de poissons sur une seule zone d’exploitation et dans une zone désignée de la baie afin de minimiser le transfert intergénérationnel d’agents pathogènes ou de parasites entre les poissons).
- Exemples de mesures pour réduire les effets nuisibles des fèces, des aliments non consommés et autres matières exerçant une DBO (selon le Modèle de rapport du RAA, article 3c) :
- les procédures visant les méthodes d'alimentation, le choix des aliments ou l'équipement sont en place et sont conçues de façon à limiter les rejets de nourriture et à optimiser le taux de conversion des aliments sans compromettre la santé du poisson, y compris :
- l'utilisation de caméras sous-marines ou l'alimentation à la main afin d'observer le ralentissement ou l'arrêt de l'alimentation des poissons;
- l'utilisation d'aliments optimaux pour réduire la quantité donnée afin d'augmenter les taux de conversion des aliments et de réduire le taux et le volume des rejets de matières organiques;
- le stockage d'aliments dans des structures de confinement appropriées pour éviter les déversements.
- les programmes de surveillance des sédiments ou de la qualité de l'eau exigés par la province ou à l'initiative de l'exploitant sont en place;
- les procédures utilisées pour recueillir et conserver l'eau souillée de sang provenant de la collecte, en évitant le plus possible les fuites, et pour l'éliminer devraient être en place au niveau d’une installation de transformation autorisée;
- pour les installations qui déversent des eaux usées de façon localisée, des plans sont en place aux fins suivantes :
- le filtrage aux exutoires localisés afin de retenir les matières organiques à particules plus grosses et de réduire la masse totale rejetée dans les environnements aquatiques;
- la filtration ou d'autres formes de traitement des effluents afin de réduire la masse totale des matières organiques et matières associées rejetées;
- dans le cas des installations piscicoles marines comportant des installations flottantes habitées, les matières organiques exerçant une DBO qui sont produites par les installations habitées et rejetées comme effluent devraient être conservées dans des fosses septiques conçues pour un temps de séjour d’au moins deux (2) jours avant le rejet, ou bien d'autres mesures similaires devraient être employées, et ce, conformément aux règlements fédéraux et provinciaux applicables.
Article 8 : Renseignements exigés avant immersion ou rejet
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : |
Objectif : Lignes directrices :
Le propriétaire ou l'exploitant doit soumettre l'information requise au Bureau régional de gestion de l’aquaculture (voir annexe 3) au moins 300 jours (10 mois) avant la première immersion ou le premier rejet de substances nocives. Ce délai a été fixé en supposant que, pour la plupart des activités piscicoles, il y aurait une période de quatre à six mois entre la date de délivrance du permis et le moment où la matière exerçant une DBO serait concrètement rejetée dans l'eau où vivent des poissons. Après avoir reçu la demande complète, les divers groupes du MPO (Programme de protection des pêches, Programme des espèces et péril, Gestion de l'aquaculture, Sciences) disposent de quatre à six mois pour examiner la demande et transmettre à la province un avis avant que le permis ne soit délivré. Aucune installation ne peut être avitaillée avant que les rapports ne soient présentés. L'information peut être transmise par courriel ou par la poste. Un accusé de réception sera fourni. |
Article 9 : Demande touchant le contour de rayonnement
| Règlement sur les activités d’aquaculture | Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : Protocole de surveillance de la C-B Protocole de surveillance de T-N-L |
Objectif :
Le propriétaire ou l'exploitant doit présenter l'information requise au Bureau régional de gestion de l’aquaculture dans les 30 jours suivant la présentation de la demande à la province. L'information peut être transmise par courriel ou par la poste. Un accusé de réception sera délivré. |
Article 10 : Échantillons du substrat et rempoissonnement
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions Consulter Norme relative à la surveillance de l’aquaculture : procédure de surveillance de sulfures libres |
Objectif : Directives : |
Article 11: Surveillance visuelle du substrat
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions 11. (1) Le présent article s’applique aux installations d’aquaculture où sont élevés des poissons à nageoires dans les eaux visées au paragraphe 10(1) et qui : Consulter Protocole de surveillance de la C-B Protocole de surveillance de T-N-L |
Objectif: |
Article 12: Avis au ministre
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions Consulter: |
Objectif Directives: |
Article 13 : Présence de morbidité ou de poissons morts
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions Consulter : Exigences en matière de drogues et de pesticides à analyser en vertu du RRA Guide d’échantillonnage des drogues et des produits antiparasitaires Résumé des actions exigées |
Objectif : Directives :
Le schéma est une représentation tridimensionnelle d’un réseau de huit parcs montrant le rectangle délimité par les ancres sur le fond marin et la délimitation correspondant à la surface de l'eau.
Remarque : Le propriétaire ou l'exploitant n'est pas tenu d'établir de rapport sur les incidents de morbidité ou de mortalité s'ils se produisent plus de 96 heures après le rejet de pesticides ou de drogues. Toutefois, un propriétaire ou exploitant a le devoir d’informer le MPO ou EC de l’immersion ou le rejet de substances nocives non autorisées par la règlementation, en vertu de l’article38(5) de la Loi sur les pêches. |
Article 14 : Rapport annuel
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Conditions |
Objectif : Directives : |
Article 15 : Ouvrages, entreprises, activités visés et conditions
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Article 35 de la Loi Consulter: |
Objectif : Directives : |
- Exemples de mesures aidant à minimiser les dommages sérieux aux pêches commerciales, récréatives et autochtones (selon le Modèle de rapport du RAA, section 6) :
Les mesures pouvant être prises afin de minimiser les dommages sérieux aux pêches commerciales, récréatives, et autochtones, comprennent, sans y être limitées pour autant, les actions suivantes :
- l'enlèvement régulier des biosalissures des infrastructures et des filets de façon à retirer les organismes lorsqu'ils sont encore de petite taille, ce qui crée un impact moins important si la sédimentation de l'habitat benthique se produit;
- la planification de travaux dans l'eau en fonction des périodes établies pour protéger les poissons, y compris les œufs, les juvéniles et les adultes en frai et les organismes dont ils se nourrissent;
- la limitation du type et de la planification des activités (par exemple, le décorticage, le tri, ou l’écrémage) afin de limiter le plus possible la libération de matières organiques sur le fond marin à la suite de la manipulation des poissons et d'autres activités d'aquaculture;
- la conception et la planification des activités et des travaux dans les plans d'eau de manière à minimiser la perte ou la perturbation de l'habitat aquatique et à éviter les habitats de frai sensibles;
- l'utilisation de la machinerie d'une façon qui minimise la perturbation dans les zones intertidales ou d'autres habitats du poisson;
- l’évitement des ancrages dans un habitat important du poisson et la minimisation de la perturbation de la végétation aquatique submergée au moment de la fixation des structures d'ancrage sur le fond;
- d'autres mesures pertinentes pour éviter de causer des dommages sérieux au poisson et à l'habitat du poisson;
- pour les installations d’aquaculture e conchylicole, des procédures propres aux espèces cultivées sont mises en place afin de limiter le dépôt de matières sur le substrat.
Article 16 : Rapport annuel
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Rapport Consulter : |
Objectif : Lignes directrices : |
Article 17 : Alinéa 35(2)a) de la Loi
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Agence canadienne d’inspection des aliments |
Objectif : |
Article 18 : Enregistrement
Règlement sur les activités d’aquaculture |
Directives à l'intention des propriétaires et exploitants |
|---|---|
Entrée en vigueur |
Annexe 1 : Modèle de rapport du RAA
![]()
Rapport annuel conformément au Règlement sur les activités d’aquaculture
- NOUVEAUX modèles de rapport
- Gabarits additionnels
Annexe 2 : Application du RAA
Type d'installation d'aquaculture |
|||||||
Mollusques et crustacés en eau libre |
Poissons d’eau douce |
Poissons de mer en eau libre |
|||||
Installations en eau libre |
Installations terrestres |
||||||
Exigences du RAA |
Article 5 : Immersion ou rejet de drogues
|
Autorisé à rejeter des drogues et des pesticides |
|||||
Article 6 : Immersion ou rejet de pesticides.
|
|||||||
Article 7 : Mesures en vue de la réduction des effets nuisibles des fèces, aliments, pesticides et/ou médicaments |
Exigé |
||||||
Articles 8 et 9 : Mesures de surveillance de base requises pour les sites piscicoles marins nouveaux (article 8) ou en expansion (article 9). |
Sans objet |
Tel qu'exige par les provinces |
Sans objet |
Exigé (à moins que la biomasse de l’installation soit de 2,5 tonnes ou moins, ou que la production annuelle soit de 5 tonne ou moins)
|
|||
Article 10-12 : Surveillance du rejet de matières exerçant une DBO |
Non exigé, à moins d'une condition de permis à l'échelle provinciale. |
Exigé |
|||||
Article 13 : Avis de toute morbidité/mortalité observée de poissons à l’extérieur de l’installation d’aquaculture |
Exigé |
||||||
Articles 14 et 16 : Présentation du rapport annuel |
Exigé |
||||||
Article 15 : Loi sur les pêches, article 35 : Ouvrages, entreprises, activités visés et conditions |
Autorisé (mais ne s'applique pas là où le Règlement du Pacifique sur l’aquaculture s'applique, c'est.-à-dire en Colombie-Britannique) |
||||||
| Numéros d'article du RAA auxquels les exigences du RAA font référence : | Description | Mollusques et crustacés en eau libre | Poissons d’eau douce installations en eau libre |
Poissons d’eau douce installations terrestres |
Installations de poissons de mer | |
|---|---|---|---|---|---|---|
| Article 5: Immersion ou rejet de médicaments |
1. Conformité à Loi sur les aliments et drogues |
1 |
1 |
1 |
1 |
|
| Section 5: Immersion ou rejet de médicaments |
2. Mesures d’atténuation pour réduire les rejets accidentels |
1 |
1 |
1 |
1 |
|
| Section 5: Immersion ou rejet de médicaments |
3. Évaluation des alternatives aux rejets de médicaments |
1 |
1 |
1 |
1 |
|
| Section 6: Immersion ou rejet de pesticides |
1. Conformité avec la Loi sur les produits antiparasitaires |
1 |
1 |
1 |
1 |
|
| Article 6: Immersion ou rejet des pesticides |
2. Évaluation des alternatives aux rejets de pesticides |
1 |
1 |
1 |
1 |
|
| Article 7 | Mesures en vue de la réduction des effets nuisibles des fèces, aliments, pesticides et/ou médicaments |
2 |
2 |
2 |
2 |
|
| Article 8 | Mesures de surveillance de base requises pour les sites piscicoles marins nouveaux |
3 |
3 |
3 |
6 |
|
| Article 9 | Mesures de surveillance de base requises pour les sites piscicoles marins en expansion |
3 |
3 |
3 |
6 |
|
| Articles 10 à 12 |
Surveillance du rejet de matières exerçant une DBO |
5 |
5 |
5 |
6 |
|
| Article 13 | Avis de toute morbidité/mortalité observée de poissons à l’extérieur de l’installation d’aquaculture |
3 |
2 |
2 |
2 |
|
| Articles 14 et 16 |
Présentation du rapport annuel |
2 |
2 |
2 |
2 |
|
| Article 15 | Article 35 de la Loi sur les pêches: ouvrages, entreprises, activité vises et conditions désignées |
7 |
7 |
7 |
7 |
- Autorisé à rejeter des drogues et des pesticides (soumis aux modalités des articles 5 et 6)
- Exigé
- Sans objet
- Au besoin
- Non exig, à moins d'une condition de permis à l'échelle provinciale
- Exigé (à moins que la biomasse de l’installation soit de 2,5 tonnes ou moins, ou que la production annuelle soit de 5 tonne ou moins)
- Autorisé (mais ne s'applique pas là où le Règlement du Pacifique sur l’aquaculture s'applique, soit la Colombie-Britannique); soumis aux modalités en vertu de l’article 15
Annexe 3 : Responsables des Bureaux régionaux de gestion de l’aquaculture
Utilisez ces informations dans les cas de signalements et de rapports requis dans le RAA en vertu des articles 6, 8, 9, 12 et 16.
| Région | Contact |
|---|---|
Région du Centre et de l'Arctique |
Bureau régional de gestion de l’aquaculture |
Région du Golfe |
Bureau régional de gestion de l’aquaculture |
Région des Maritimes |
Bureau régional de gestion de l’aquaculture |
Région du Pacifique |
Bureau régional de gestion de l’aquaculture |
Région du Québec |
Bureau régional de gestion de l’aquaculture |
Région de Terre-Neuve-et-Labrador |
Bureau régional de gestion de l’aquaculture |
Annexe 4 : Rapport des cas de morbidité ou de mortalité
Utilisez ces numéros de téléphone uniquement pour signaler des cas de morbidité/mortalité en vertu de l’article 13 du RAA
Utilisez ces numéros SEULEMENT dans le cas de signalements de morbidité ou mortalité en vertu de l’article 13 du RAA.
| Province/Territoire | Numéro 1-800 |
|---|---|
| Alberta | 1-800-265-0237 |
| Colombie-Britannique | 1-800-465-4336 |
| Île-du-Prince-Édouard | 1-800-565-1633 |
| Manitoba | 1-800-265-0237 |
| Nouveau-Brunswick | 1-800-565-1633 |
| Nouvelle-Ecosse | 1-800-565-1633 |
| Nunavut | 1-800-265-0237 |
| Ontario | 1-800-265-0237 |
| Québec | 1-800-363-4735 |
| Saskatchewan | 1-800-265-0237 |
| Terre-Neuve-et-Labrador | 1-800-563-9089 |
| Territoires du Nord-Ouest | 1-800-265-0237 |
| Yukon | 1-800-465-4336 |
Annexe 5: Exigences en matière de drogues et de pesticides à analyser en vertu du RRA (article 13)
| Composé | Nom commercial | Drogue (ajoutées à la nourriture) ou pesticide (traitement par bain) |
|---|---|---|
Benzoate d'émamectine a |
SLICE® |
Incorporé aux aliments |
Téflubenzuron a |
Calicide® |
Incorporé aux aliments |
Ivermectine |
Ivomec® |
Incorporé aux aliments |
Deltaméthrine |
Alphamax® |
Traitement en bassin |
Azaméthiphos b |
Salmosan® |
Traitement en bassin |
Cyperméthrine |
EXCIS® |
Traitement en bassin |
Dichlorovos |
Aquaguard® ou Nuvan® |
Traitement en bassin |
aTéflubenzuron (c’est-à-dire Calcide®) et benzoate d’émamectine (c’est-à-dire SLICE®) sont enregistrés pour utilisation sur le poisson au Canada.
bAzaméthiphos (c’est-à-dire Salmosan®) et les produits à base de peroxyde d’hydrogène (par exemple, le Paramove 50®) sont les seuls produits antiparasitaires actuellement autorisés contre les poux du poisson au Canada.
Les échantillons prélevés selon l’annexe 6 : Guide d’échantillonnage pour les drogues et les produits antiparasitaires (c’est-à-dire les tissus du poisson, l’eau de mer et les sédiments marins) peuvent être analysés pour les composés mentionnés ci-dessus, ainsi que pour d’autres drogues et pesticides, si nécessaire.
Lorsque qu’une analyse est exigée, le propriétaire ou l’exploitant recevra une liste de laboratoires agréés par le biais d’une directive relative à l’article 36 de la Loi sur les pêches.
Annexe 6: Guide d’échantillonnage pour les drogues et les produits antiparasitaires
Remarque : l'information qui suit est offerte à titre de directive et peut changer, selon les directives propres à un site de Pêches et Océans Canada.
1 Méthodes générales
- Tous les échantillons d’eau, de sédiment ou de tissu prélevés par le propriétaire ou l’exploitant seront soumis à un laboratoire d’analyse agréé par le Conseil canadien des normes pour ces analyses. Les drogues et produits antiparasitaires devant faire l’objet d’analyses seront déterminés par le MPO (voir l’annexe 5 pour la liste des drogues et pesticides qui peuvent faire l’objet d’une demande d’analyse).
- Préparer tous les moyens d’échantillonnage exigés (produits et matériel) tel que décrit ci-après et les placer juste avant tout traitement dans le bateau de collecte qui devra être prêt à intervenir.
- Des copies des formulaires de notes de terrain et des exigences précises concernant les analyses chimiques devraient être incluses avec l'envoi au laboratoire d'analyse.
- Les formulaires originaux de notes de terrain et les images numériques devraient être conservés dans une armoire sécurisée.
- Les échantillons, produits et équipement d'échantillonnage doivent être conservés dans un environnement propre, éloigné des drogues et produits antiparasitaires afin de réduire le risque de contamination. Il est préférable de conserver les fournitures d'échantillonnage dans des contenants scellés et étanches pour prévenir la contamination.
- Tout l'équipement doit être nettoyé à l'aide de détergents et rincé trois fois avec de l'eau stérilisée entre chaque séquence d'échantillonnage, et aussi lorsqu’il peut y avoir eu une exposition directe aux drogues et, aux produits antiparasitaires, ou à une exposition indirecte à la poussière ou à la vapeur d'eau.
2 Échantillons de poissons
- Si un poisson mort ou moribond à n'importe quel stade biologique était observé, le personnel sur le terrain devrait mobiliser le bateau de collecte pour localiser le poisson et commencer l'échantillonnage, immédiatement après avoir informé un agent des pêches et obtenu les autorisations du MPO.
- Des poissons d'une même espèce et de tailles représentatives du groupe considéré devraient être prélevés, jusqu'à un maximum de 50 poissons par groupe. Un nombre équivalent de poissons-témoins de taille comparable devraient autant que possible, être prélevés dans un secteur hors de la zone dépendante de l’activité d’élevage.
- Les branchises, ainsi que l’intégralité du poisson devra être exempte de toute altération externe. Les lacérations externes constituent des points d'entrée pour la contamination et peuvent entraîner des pertes de fluides et/ou biaiser les résultats d'analyse.
- Enfiler des gants imperméables stériles (en latex ou en nitrile) et placer le poisson sur une feuille d'aluminium propre pour consigner les observations.
- Enregistrer des images numériques de tous les poissons en veillant à inclure pour chaque image, toutes les anomalies morphologiques et les parasites observés, ainsi que les étiquettes d'identification d'échantillon correspondantes
- Emballer le poisson dans une double feuille d’aluminium solide puis doubler le sac stérile de taille appropriée et s’assurer que l'étiquette d'identification de l'échantillon est incluse à l'intérieur du sac extérieur et que les sacs sont scellés à l'aide d'une attache autobloquante. Avant d’emballer le produit, utiliser des morceaux propres de bouchon en liège aux extrémités des épines et aspérités de la carapace.
- Conservez les poissons sur la glace dans une glacière fermée pendant le prélèvement.
- Continuer à retirer les poissons morts ou moribonds observés dans les environs du site aquacole en utilisant de nouveaux gants, un nouveau papier d'aluminium et une gaffe propre pour chaque poisson.
- Une basse température d'entreposage est importante pour préserver les analytes cibles en empêchant leur dégradation. Les poissons devraient être conservés dans des sacs sur la glace pendant le prélèvement et être ensuite congelés sur place dès que possible à une température de -20 °C, puis stockés.
- Dès qu’ils sont congelés à -20 °C, et dans les deux semaines suivant leur prélèvement, les poissons devraient être emballés des glacières contenant de la glace sèche, de la glace classique ou bien des blocs réfrigérants, et expédiés à un laboratoire pour traitement, extraction et analyse des tissus selon le protocole décrit ci-après.
- Pendant le transport au laboratoire, les poissons congelés devraient être placés dans des glacières contenant une quantité suffisante de produit réfrigérant estimée en tenant compte des recommandations du fournisseur de glace sèche, du poids de l'échantillon et du temps d'expédition prévu.
- Dans le cas de glace sèche, se reporter aux conseils de la compagnie de transport.
3 Échantillons de sédiment
- Les prélèvements de sédiment doivent s’effectuer concomitamment à ceux des poissons.
- Le prélèvement de sédiment doit être répété trois fois pour la même station d’échantillonnage (fournissant trois échantillons distincts), selon le protocole de prélèvement de la matière organique pour la mesure de la DBO. Un nombre identique d’échantillons-témoins doit être prélevé au-delà de la zone probable d’exposition
- Toute partie de l’équipement qui entre en contact avec un échantillon doit être composée de métal, de verre ou de polyfluorocarbone non coloré.
- Suivez les procédures pour les prélèvements de carottes de sédiment ou d’échantillons à la benne conformément aux sections respectives de la Norme (annexe 7) concernant l'échantillonnage de la matière organique pour la mesure de la DBO.
- Éliminez les 2 premiers cm de sédiment du tube de la carotte d'échantillonnage.
- Placer les sédiments dans des bocaux de verre ambré de 500 ml. Mettez immédiatement les échantillons au froid en les plaçant dans une glacière contenant de la glace ou de la glace sèche pour le transport et les expédier à un laboratoire agréé par le Conseil canadien des normes pour analyse.
- Les échantillons de sédiments devraient être conservés sous glace et envoyés aux laboratoires agréés pour analyse dans les trois (3) jours suivant le prélèvement.
4 Échantillons d’eau
- Les échantillons de la colonne d'eau de chaque station doivent être prélevés concomitamment à ceux du poisson et du sédiment.
- Dans le cas de l’utilisation de jupes ou de bâche, trois échantillons de la colonne d'eau pour la même station de prélèvement (répétés) seront prélevés:
- à une distance horizontale de 0 m (dans la cage); and
- à une distance horizontale de 100 m de la cage, dans la direction du courant dominant et dans les 10 premiers mètres mesurés à partir de la surface; OU
- Dans le cas de l’utilisation de bateaux viviers, les trois échantillons de la colonne d'eau seront prélevés:
- à une distance horizontale de 0 m (du point de traitement), et
- à une distance de100 m du point de rejet, dans le sens de la trace du rejet, et dans les 10 premiers mètres mesurés à partir de la surface.
- Un nombre équivalent d'échantillons-témoins seront prélevés à la même profondeur que ceux de la station de 100 m.
- Des techniques d'échantillons propres doivent être utilisées dans le cas de prélèvements destinés à l’analyse des composés organiques traces et des éléments inorganiques, en particulier quand la substance cible peut avoir été contaminée pendant les procédures sur le terrain ou en laboratoire à un niveau qui pourrait dépasser les exigences relatives à la qualité des données.
- Choisir un équipement dont les composantes sont faites de métal, de verre ou de polyfluorocarbone incolore si les composants doivent être en contact direct avec les échantillons à analyser pour déterminer s'ils contiennent des composés organiques. Ne pas utiliser de plastiques autres que le polyfluorocarbone incolore.
- Il est préférable d'utiliser une bouteille d'échantillonnage Van Dorn pour obtenir des échantillons de surface distincts, mais toute bouteille d'échantillonnage non contaminante peut être utilisée. Le protocole de prélèvement, de conservation et de transport (vers un laboratoire agréé par le Conseil canadien des normes pour l'analyse) devrait être mentionné dans le Rapport annuel sur le RAA au MPO.
- Les échantillons d’eau devraient être envoyés à des laboratoires agréés pour analyses dans les 24 heures suivant le prélèvement. Le protocole de collecte, conservation et transport doit être inclus dans le rapport annuel du RAA destiné au MPO.
5 Consignation écrite
- Pour une bonne interprétation des résultats d'analyse, il est important de noter toutes les données de terrain essentielles selon une méthode cohérente et normalisée
- Les formulaires de collecte des données devraient inclure les renseignements précis mentionnés ci-dessous. Les étiquettes d'identification séparées qui accompagnent les échantillons pendant l'entreposage et l'expédition devraient être conçues pour que les informations recueillies correspondent à celles des formulaires de collecte des données
- L’utilisation de stylos à encre indélébile et de papier imperméable adapté au travail sur le terrain est recommandée.
6 Les exigences particulières en matière d'information incluent :
- nom de l’entreprise et du site aquacole;
- lieu, date et heure où les poissons ont été observés pour la première fois, ainsi que le nom de l’employé qui les a signalés ;
- nom et coordonnées du gestionnaire du site;
- profondeur et coordonnées GPS du site aquacole;
- espèces, taille et biomasse des poissons sur le site au moment du traitement;
- drogue ou produit antiparasitaire, méthode d'application, concentration du produit appliqué, quantité de produit utilisé et étape de la procédure au moment où les poissons affectés ont été observés;
- Date, heure et emplacement (coordonnées GPS) des prélèvements de poisson et nom des agents chargés des prélèvements
- température de surface de l’eau et de l’air au moment de l'échantillonnage;
- conditions météorologiques;
- méthode de prélèvement;
- numéro d'identification de chaque poisson;
- numéro de la photo;
- mesure de la longueur (cm);
- poids (g);
- espèce prélevée
- état : vivant ou mort et, dans le cas où le poisson est vivant, décrire son comportement;
- anomalies morphologiques observées, notamment les lésions de tissus ou les altérations de croissance, des lacérations, une nécrose des nageoires, des ulcères de la peau, des néoplasmes;
- quantité et type des ectoparasites;
- information concernant les conditions d'entreposage et de transport (temps passé à température ambiante/temps passé dans la glace au moment du prélèvement et temps d'entreposage).
Annexe 7: Norme relative à la surveillance de l'aquaculture
2018
Norme relative à la surveillance de l'aquaculture (PDF 254 Ko)
Introduction
La présente norme relative à la surveillance de l’aquaculture (la Norme) a pour but d’appuyer les exigences en matière de surveillance et d’échantillonnage du Règlement sur les activités d’aquaculture (RAA) établi en vertu de la Loi sur les pêches. Le présent document fournit au propriétaire ou à l’exploitant d’une installation aquacole les renseignements détaillés dont il aura besoin pour générer, dans la mesure du possible, des données uniformes et de haute qualité qui appuieront la mise en œuvre du RAA.
La Norme sera modifiée de temps à autre, au besoin et en consultation avec les provinces.
Définitions
- structure de confinement
- désigne un agencement de cages interreliées qui sont utilisées pour l’élevage du poisson
- vers marins
- désignent un regroupement de polychètes opportunistes qui colonisent des substrats enrichis en matières organiques
- station de référence
- désigne la station d’échantillonnage choisie pour représenter un état naturel. Les stations de référence peuvent être choisies en tant qu’emplacement d’échantillonnage distinct ou peuvent s’étirer le long d’un transect représentant un « gradient » historique dans le cadre d’une démarche axée sur le « contexte »
- station d’échantillonnage
- désigne l’endroit où est effectué l’enregistrement et où sont prélevés les échantillons
- site de fond meuble
- désigne, au-delà de sa définition dans le RAA, un site où des échantillons acceptables peuvent être prélevés dans le substrat benthique en se fondant sur un critère d’acceptabilité de la méthode d’arrachement et sur des options d’échantillonnage reliées aux conditions océanographiques et au type de substrat ou, encore, est classé en tant que fond meuble d’après des critères provinciaux
- transect
- désigne la ligne directionnelle le long de laquelle des stations d’échantillonnage sont établies ou des observations visuelles sont effectuées
I Relevés visant à recueillir de l’information de base sur de nouveaux sites et sur l’expansion de sites actuels [articles 8 et 9 du RAA]
Contours prévus [alinéa 8(1)a) du RAA]
- 1.(1) Calculer le taux de dépôt des matières exerçant une demande biochimique en oxygène (DBO) présentes dans l’installation au moment où la quantité d’aliments quotidienne maximale utilisée est la plus élevée, en utilisant un modèle de dépôt des déchets aquacoles, et tracer les contours des dépôts de 1, 5 et 10 g C/m2/jour.
- (2) Les données océanographiques propres au site seront utilisées comme intrants dans le modèle. En utilisant un modèle de dépôt des déchets aquacoles, les caractéristiques des intrants pour les aliments et les déchets fécaux doivent afficher des valeurs standards acceptées à l’échelle internationale ou être mesurés par l’exploitant. Les simulations du modèle ne sont pas conçues pour inclure des estimations de la remise en suspension des particules après le dépôt.
Relevé du poisson et de l’habitat du poisson [alinéa 8(1)b) du RAA]
- 2.(1) Lorsqu’on effectue des relevés du poisson et de l’habitat du poisson, les stations d’échantillonnage qui se trouvent le long d’un transect ou au sein d’une grille doivent être représentatives des différentes caractéristiques physiques et biologiques de l’habitat du fond au sein des contours des dépôts modélisés de 1 g C/m2/jour et sur le fond marin faisant l’objet du bail, y compris les stations de référence, le cas échéant.
- (2) Il n’est pas nécessaire d’effectuer un échantillonnage dans les zones faisant l’objet d’un bail ou dans les zones délimitées par des contours des dépôts de 1 g C/m2/jour lorsque la profondeur dépasse 300 m.
- (3) Si les données historiques sur le poisson et l’habitat du poisson pour une zone faisant l’objet d’un bail élargie affichent une couverture homogène d’habitat fait de boue ou de sable, alors seule une vidéo du transect au travers de la largeur de l’intégralité de la zone faisant l’objet du bail et dans la direction du courant dominant et sous l’emplacement de la structure de confinement proposée est requise.
- (4) Le relevé benthique du poisson et de l’habitat du poisson doit être effectué de manière à ce que l’on puisse identifier les espèces qui mesurent un centimètre ou plus et pour établir le type d’habitat présent.
- (5) Tous les habitats du poisson et les substrats doivent être relevés.
Relevé bathymétrique [alinéa 8(1)c) du RAA]
- 3.(1) Un relevé bathymétrique doit être effectué avec une résolution minimale des contours de dix mètres de manière à ce qu’on puisse produire des profils de profondeur, liés au zéro des cartes, au sein des contours des dépôts modélisés de 1 g C/m2/jour selon le calcul indiqué au paragraphe 1(1) et doit couvrir l’intégralité de la zone faisant l’objet du bail, y compris les stations de référence, le cas échéant.
- (2) Malgré le paragraphe 3(1), il est permis d’utiliser des cartes bathymétriques du Service hydrographique du Canada qui indiquent les contours du profil des profondeurs par paliers de dix mètres, au lieu d’effectuer un relevé bathymétrique.
- (3) Les échosondeurs, les transducteurs et l’équipement connexe utilisés pour produire le relevé bathymétrique tel que prévu au paragraphe 3(1) doivent être étalonnés conformément aux normes de l’industrie.
- (4) Les mesures permettant de déterminer la position horizontale doivent être prises à l’aide d’un Système mondial de localisation différentiel (DGPS).
Surveillance du substrat benthique [alinéa 8(1)d) du RAA]
- 4.(1) L’information concernant le fond marin sera recueillie au sein d’emplacements représentatifs de l’ensemble de la zone faisant l’objet du bail et au sein des contours des dépôts modélisés de 1 g C/m2/jour, tel que calculé au paragraphe 1(1), y compris les stations de référence, le cas échéant.
- (2) Dans le cas où une installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes :
- du Québec, de la Nouvelle-Écosse, du Nouveau-Brunswick, de l’Île-du-Prince-Édouard ou de Terre-Neuve-et-Labrador, prélever des échantillons du substrat benthique dans le centre et à chaque coin de la zone faisant l’objet du bail
- du Nouveau-Brunswick, prélever des échantillons du substrat benthique à l’extrémité d’un transect de 50 m à partir de la limite de la zone faisant l’objet du bail, dans la direction du courant dominant
- du Québec, de la Nouvelle-Écosse ou de l’Île-du-Prince-Édouard, prélever des échantillons du substrat benthique à des distances de 100 à 300 m de la limite de la zone faisant l’objet du bail, dans la direction du courant dominant
- de la Colombie-Britannique, prélever des échantillons du substrat benthique à au moins deux stations d’échantillonnage (à 30 et 125 m du bord des cages) le long de deux transects qui sont alignés avec la zone où l’impact prévu est le plus important et dans la direction des courants dominants et subdominants
- Si la structure de confinement mentionnée à l’alinéa 4(2)d) mesure plus de 200 m de long et si son axe de longueur est perpendiculaire à la direction du courant dominant, des échantillons supplémentaires doivent être prélevés de la manière suivante :
- pour chaque palier d’augmentation de la longueur jusqu’à 200 m, il convient d’établir des transects supplémentaires comportant des stations d’échantillonnage à 30 et 125 m adjacentes à chaque transect établi en vertu de l’alinéa 4(2)d)
- les transects doivent être parallèles entre eux et se situer à des distances d’au moins 50 m les uns des autres
- d’après le contour des dépôts de 5 g C/m2/jour, tel que calculé au paragraphe 1(1), les transects doivent se trouver dans la direction du dépôt maximal, tel que déterminé par le contour de 5 g C/m2/jour
- (3) Outre les critères précisés au paragraphe 10(2) du RAA, il faut remplir les critères pertinents suivants concernant l’échantillonnage du substrat benthique reposant sur l’utilisation de dispositifs d’arrachement ou de carottes d’échantillonnage :
- Obtenir les coordonnées du DGPS à chaque coin de la structure de confinement et à toutes les stations d’échantillonnage. Les mesures doivent être enregistrées sous forme de degrés décimaux ou de coordonnées de Transverse universelle de Mercator (UTM), à l’aide du Système de référence nord-américain de 1983 (NAD83) comme outil de référence.
- Le dispositif d’échantillonnage doit présenter une taille et un poids permettant de faire en sorte que l’échantillonneur est positionné de façon verticale et directement sous la zone de déploiement, avec aucun signe de dérive (les angles affichés par les lignes ne sont pas consignés).
- Il convient de prélever au moins trois échantillons à chaque station. Il faut attendre d’enregistrer au moins cinq tentatives infructueuses par station et d’avoir documenté celles-ci avant d’abandonner l’échantillonnage des sédiments.
- Des eaux surjacentes sont présentes (ce qui indique qu’il y a des fuites minimes) et doivent être enlevées avant que l’on ne procède au traitement et à l’entreposage par siphonnement, et non par décantation.
- L’eau surjacente est claire et n’affiche pas de turbidité excessive.
- L’interface entre l’eau et les sédiments est intacte et relativement plate, avec aucun signe de d’écoulement préférentiel ou de lessivage des échantillons.
- La perte de sédiments est minime.
- Obtenir des échantillons successifs dans des substrats qui n’ont pas été perturbés par un échantillonnage précédent.
- Éliminer les sédiments en excès de manière à réduire le plus possible le risque que les échantillons suivants ne soient contaminés.
- Prélever au moins un sous-échantillon qui soit représentatif de la couche supérieure de sédiments de deux centimètres au sein de l’échantillonneur.
- Avant de placer la matière dans des récipients aux fins d’analyse, retirer toute la matière non sédimentaire, y compris les gros fragments de coquille, les poissons, les déchets ligneux et les roches.
- Conserver le niveau de l’échantillonneur lorsque l’on conserve les échantillons.
- Enlever rapidement l’eau surjacente des échantillons et éviter, pour le sous-échantillonnage, les zones dans lesquelles des eaux surjacentes pourraient persister.
- L’échantillonneur n’est pas rempli de façon excessive de sorte que la surface des sédiments est en contact avec le haut de l’échantillonneur.
- Le dispositif de prélèvement de carottes d’échantillonnage n’a pas été inséré dans un angle ou incliné au moment de sa récupération.
- Toutes les tentatives d’échantillonnage et les prélèvements de sédiments doivent être clairement documentés par des vidéos ou par des images fixes afin que l’on puisse respecter les critères d’acceptabilité de la démarche d’échantillonnage.
- (4) L’information suivante concernant le fond marin doit être recueillie au moment de prélever les échantillons :
- latitude et longitude en utilisant un DGPS
- profondeur
- date et heure de l’échantillonnage
- texture et couleur des sédiments
- photos des échantillons de sédiments
- présence de bulles de gaz
- estimation de la superficie couverte par des tapis de bactéries
- l’estimation de la superficie couverte par des vers marins
- présence d’excréments de poissons et d’aliments dont se nourrissent les poissons
- présence de matière organique floconneuse
- sulfures libres
- potentiel redox
- taille des grains de sédiments
- matière organique en pourcentage et porosité, seulement au Québec, en Nouvelle-Écosse, au Nouveau-Brunswick, sur l’Île-du-Prince-Édouard et à Terre-Neuve-et-Labrador
- Teneur totale en solides volatils en Colombie-Britannique
- (5) Il faut se conformer aux procédures suivantes lorsqu’on mesure la concentration des sulfures libres, le potentiel redox et la taille des grains de sédiments dans des échantillons de sédiments :
- La concentration des sulfures libres dans les échantillons de sédiments doit être établie dans les 36 heures suivant le prélèvement, sauf en Colombie-Britannique, où les échantillons de sédiments doivent être analysés dans les cinq minutes suivant leur prélèvement.
- Si les mesures de la concentration des sulfures libres ne sont pas prises dans les cinq minutes suivant le prélèvement de l’échantillon, des sous-échantillons doivent être conservés à une température s’échelonnant entre 2 et 5 °C jusqu’à ce qu’ils soient analysés.
- Utiliser une sonde à sulfure d’argent affichant une plage de sensibilité au sulfure allant de 0,000 à 19 900 μM et une précision de ± 5 %, avec une électrode sélective d’ions appropriée ou un mV-mètre approprié présentant une résolution de 0,1 mV.
- La sonde doit être étalonnée en utilisant trois à cinq dilutions progressives d’une solution de sulfure standard, au besoin, en commençant par la solution la plus diluée.
- Les mesures de la répartition de la taille des grains de sédiments doivent être enregistrées conformément à l’échelle des tailles de grains de Wentworth, en tant que pourcentage de la masse totale du sous-échantillon.
- Les mesures du potentiel redox doivent être prises de la manière suivante :
- l’électrode combinée redox doit présenter une électrode sélective d’ions ou un mV-mètre approprié
- l’étalonnage de la sonde doit être effectué avant de prendre les mesures
- les valeurs du potentiel redox et la température doivent être mesurées en même temps que les sulfures libres
- (6) Lorsque les échantillons ne peuvent pas être obtenus tel que précisé aux paragraphes 4(2) et 4(3), il faut effectuer une surveillance visuelle tel que précisé aux articles 5 et 6.
- (7) Il n’est pas nécessaire d’effectuer un échantillonnage dans les zones faisant l’objet d’un bail ou dans les zones délimitées par des contours des dépôts de 1 g C/m2/jour lorsque la profondeur dépasse 300 m.
Exception
Procédures de surveillance visuelle [alinéas 11(2)a), b) et c) du RAA]
- 5. (1) La surveillance visuelle du substrat benthique doit être effectuée de la manière suivante :
- On doit utiliser un appareil photo portable ou immergé, ou une caméra vidéo remorquée, commandée à distance ou utilisée par un plongeur.
- Le poids des dispositifs remorqués doit permettre un déplacement stable à une profondeur appropriée pour ne pas perturber les sédiments du substrat.
- Les appareils utilisés pour la photographie sous-marine doivent illuminer le substrat benthique avec une intensité qui correspond à la sensibilité optique de la lentille afin d’obtenir un champ de vision uniforme.
-
La résolution optique de la lentille de l’appareil doit permettre de distinguer à l’œil nu les organismes dont la taille est supérieure à 1 cm et de les montrer dans un champ de vision horizontal de 0,5 m x 0,5 m. Aux fins d’identification, les espèces observées peuvent être agrandies, au besoin.
- Les caméras vidéo remorquées, commandées à distance ou utilisées par un plongeur doivent être utilisées à une vitesse constante permettant d’identifier avec précision les paramètres visuels.
- La vidéo originale doit pouvoir être transférée sur un support d’enregistrement numérique (c.-à-d. aucune retouche à la suite des relevés vidéo).
Emplacements de la surveillance visuelle [alinéas 11(2)a), b) et c) du RAA]
- 6. (1) Si l’installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes du Québec, de la Nouvelle-Écosse, du Nouveau-Brunswick ou de l’Île-du-Prince-Édouard, des images seront prises aux mêmes stations que celles précisées à l’alinéa 4(2)a).
- (2) Si l’installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de Terre-Neuve-et-Labrador, les images doivent être enregistrées d’après des grilles de 100 m2 au sein de la zone faisant l’objet d’un bail. Au moins une station doit être établie en bordure de la structure de confinement proposée (0 m).
- (3) Si l’installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de la Colombie-Britannique, les images doivent être enregistrées le long de deux transects qui débutent en bordure de la structure de confinement proposée et sont alignés avec la zone où l’impact prévu est le plus important et dans les directions des courants dominant et sous-dominant et s’étendent sur une distance minimale de 140 m, avec un écart maximal de ± 20 % à partir de cet azimut géographique. Des images doivent aussi être prises aux stations de référence durant les relevés servant à établir la ligne de base.
- (4) Il faut consigner les coordonnées géographiques, telles qu’établies par un DGPS, au début et à la fin de chaque transect. Les lectures doivent être enregistrées en degrés minutes en décimales à trois chiffres suivant le point décimal, en utilisant le NAD83 comme référence.
- (5) Il n’est pas nécessaire d’effectuer un échantillonnage dans les zones faisant l’objet d’un bail ou dans les zones délimitées par des contours des dépôts de 1 g C/m2/jour lorsque la profondeur dépasse 300 m.
Exception
Moment de l’échantillonnage [article 8 du RAA]
- 7. Les relevés du substrat benthique ou la surveillance visuelle doivent être effectués avant l’introduction de poissons sur le site.
Enregistrement des renseignements de base recueillis au moyen d’un relevé [paragraphes 8(1), 8(3) et 9(1) du RAA]
- 8. Le rapport des résultats de base du relevé doit comprendre, au minimum, les renseignements suivants :
- Les observations consignées pendant le ou les relevés sous-marins, y compris les images enregistrées non retouchées
- Une carte montrant l’emplacement des transects et fournissant des données sur l’habitat dérivées de ces relevés sur les transects affichant une résolution minimale de 1:5 000; les données bathymétriques sur le fond marin (à une résolution où les contours mesurent 10 m); l’empreinte estimée du dépôt de matières exerçant une DBO, en contours de 1, 5 et 10 g C/m2/jour
- Les résultats de l’échantillonnage des sédiments tels que précisés au paragraphe 4(4) ou des enregistrements de tentatives d’échantillonnage des sédiments ayant échoué, tels que précisés à l’alinéa 3c)
- Les enregistrements visuels non retouchés doivent être soumis avec l’information suivante :
- les données de positionnement, y compris l’ensemble des points de départ et d’arrêt et les points intermédiaires, en utilisant les mesures corrigées du DGPS
- la profondeur à l’endroit où l’enregistrement a été effectué et les profondeurs enregistrées de façon continue sur la vidéo, par intervalle de 10 m, au minimum
- la date et l’heure de l’échantillonnage
- l’estimation de la superficie couverte par des tapis de bactéries
- l’estimation de la superficie couverte par des vers marins
II Procédures pour la surveillance opérationnelle [paragraphe 10(1) du RAA]
Moment où l’échantillonnage doit être effectué [alinéas 10(1)a) et b) du RAA]
- 9.Il faut prélever des échantillons benthiques de surveillance ou réaliser une vidéo à l’installation au moins une fois pendant le cycle de production en mer ou tous les 24 mois pour les fermes dans lesquelles des poissons se trouvent en permanence :
- (1) En Colombie-Britannique, ces opérations doivent être réalisées dans les 30 jours suivant le pic de l’alimentation ou le pic de la biomasse
- (2) Au Québec, en Nouvelle-Écosse, au Nouveau-Brunswick, à l’Île-du-Prince-Édouard ou à Terre-Neuve-et-Labrador, ces opérations doivent être réalisées entre le 1er juillet et le 31 octobre, près du pic de l’alimentation
- (3) Lorsque les conditions météorologiques et l’état des eaux ont peu d’effets négatifs sur la qualité de l’échantillonnage et qu’ils contribuent à la précision de l’échantillonnage effectué aux stations
Surveillance du substrat benthique [alinéas 10(1)a) et b) du RAA]
- 10. (1) Lorsqu’une surveillance du substrat benthique est effectuée, la procédure précisée à l’article 4, sauf celle décrite aux alinéas 4(2)a et b, doit être suivie. Il n’est pas nécessaire d’effectuer un échantillonnage dans les zones faisant l’objet d’un bail ou dans les zones délimitées par des contours des dépôts de 1 g C/m2/jour lorsque la profondeur dépasse 300 m.
- (2) Pour le Québec, la Nouvelle-Écosse, le Nouveau-Brunswick et l’Île-du-Prince-Édouard en particulier, on utilise le tableau 1 pour établir le nombre d’échantillons de sédiments à prélever aux stations et aux transects à zéro mètre.
- (3) Il n’est pas nécessaire de mesurer la taille des grains de sédiments durant la surveillance opérationnelle.
Exception
Surveillance visuelle [alinéas 11(2) a), b) et c)]
- 11. (1) La procédure décrite au paragraphe 5 appuiera la conformité avec les seuils de réempoissonnement de l’installation.
- (2) Dans le cas où une installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de la Nouvelle-Écosse ou du Nouveau-Brunswick :
- Les observations sur chaque transect seront effectuées à 0, 10, 20, 30, 40 et 50 m
- Le nombre de transects est indiqué à la colonne II du tableau 1 en fonction du nombre de poissons repeuplés, tel que précisé à la colonne I du tableau 1
- Les cages qui se trouvent le long du périmètre extérieur de la configuration des cages doivent être celles qui seront sélectionnées pour le positionnement des transects. Les transects seront positionnés en commençant par la cage qui affiche la biomasse la plus importante, puis par ordre descendant et dans la direction du courant dominant
- Les stations qui sont utilisées pour la conformité comprennent toutes les stations dont la profondeur se situe entre 0 et 50 m
- (3) Dans le cas où une installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de Terre-Neuve-et-Labrador :
- Les observations doivent être enregistrées le long d’un nombre minimal de six transects, comprenant deux transects perpendiculaires à chaque coin de la structure de confinement et s’étendant à partir de celle-ci sur une distance de 100 m, par paliers de 20 m
- Les observations sur chaque transect seront effectuées à 0, 20, 40, 60, 80 et 100 m
- Des transects supplémentaires doivent être enregistrés perpendiculairement au milieu de chaque côté d’une structure de confinement, lequel comprend plus de neuf cages alignées
- Les stations qui sont utilisées pour la conformité comprennent toutes les stations dont la profondeur se situe entre 0 et 100 m
- (4) Dans le cas où une installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de la Colombie-Britannique, il convient de suivre les indications figurant au paragraphe 6(3) pour connaître les emplacements d’échantillonnage.
- (5) Il n’est pas nécessaire d’effectuer un échantillonnage dans les zones faisant l’objet d’un bail ou dans les zones délimitées par des contours des dépôts de 1 g C/m2/jour lorsque la profondeur dépasse 300 m.
Exception
Stations de référence [paragraphes 10 et 11 du RAA]
- 12. (1) Au moins une station de référence doit être établie, tel que requis conformément aux critères suivants, dans le cas où une installation aquacole se situe dans des eaux de marée ou dans des eaux adjacentes de la Colombie-Britannique, du Québec, de la Nouvelle-Écosse, du Nouveau-Brunswick, de Terre-Neuve-et-Labrador ou de l’Île-du-Prince-Édouard :
- Consistant en un transect qui s’étend vers l’extérieur à partir de la limite d’une zone faisant l’objet d’un bail ou en une station distincte qui n’est pas exposée à des matières exerçant une DBO qui sont déposées à partir de l’installation
- En Colombie-Britannique, ces stations distinctes se trouvent entre 0,5 et 2 km de l’emplacement de l’installation
- La profondeur de la station de référence est établie à ± 10 m de la plage des profondeurs des stations d’échantillonnage, tel que précisé au paragraphe 4(2) et à l’article 6
- La topographie, le type de fond marin, les régimes de courants et de marées, la taille des grains de sédiments et l’ampleur de l’effet du ruissellement d’eau douce doivent être représentatifs des stations d’échantillonnage
- Si l’on détermine que le fond marin se compose surtout de sédiments meubles, une station de référence au minimum sera établie, avec un nombre minimal de trois échantillons de sédiments prélevés par station
- Si l’on détermine que le fond marin ne se compose pas principalement de sédiments meubles, il faut effectuer une surveillance visuelle, tel que précisé à l’article 11
Enregistrement des renseignements dérivés des relevés opérationnels [sous-article 16 du RAA]
- 13.(1) Enregistrement des relevés benthiques conformément à l’article 8.
- (2) La modélisation de la DBO, les relevés du poisson et de l'habitat du poisson et la cartographie bathymétrique ne sont pas requis pour la surveillance opérationnelle.
Exception
| Colonne I | Colonne II | Colonne III | Colonne IV |
|---|---|---|---|
| Nombre maximal de poissons dans un ensemble de cages durant un cycle de production | Nombre de transects | Nombre de stations d’échantillonnage requises (sans compter les stations de référence) | Nombre d’échantillons (trois échantillons par station pour les sites affichant des fonds meubles à 0 m de la structure de confinement) |
| 1-200 000 | 2 | 2 | 6 |
| 200 001-300 000 | 3 | 3 | 9 |
| 300 001-400 000 | 4 | 4 | 12 |
| 400 001-500 000 | 4 | 5 | 15 |
| 500 001-600 000 | 4 | 6 | 18 |
| 600 001-700 000 | 4 | 7 | 21 |
| 700 001-800 000 | 4 | 8 | 24 |
| 800 001-900 000 | 4 | 9 | 27 |
| 900 000-1 000 000 | 4 | 10 | 30 |
Annexe 8: Protocoles du Programme de la surveillance de la DBO relatifs à la Surveillance environnementale des poissons à nageoires en Colombie-Britannique
Acronymes, abréviations et définitions
- ANOVA
- analyse de variance
- AQCQ
- assurance de la qualité et contrôle de la qualité
- Cu
- concentration de cuivre (exprimée en μg/g de sédiments secs)
- DGPS
- système de positionnement mondial différentiel
- DI
- désionisé
- EDTA
- acide éthylènediaminetétracétique, sel disodique dihydraté
- Eh
- potentiel redox (exprimé en millivolts [mV])
- Endofaune
- animaux vivant à l'intérieur du substrat
- Épifaune
- animaux vivant à la surface du substrat
- Espèces apparentées à Beggiatoa
- espèces de bactéries formant des tapis visibles sur le fond marin dans des zones d'enrichissement organique pouvant être du genre Beggiatoa, mais qui peuvent également comprendre des bactéries de genres différents
- Étale de haute mer
- moment où, à tout endroit, la profondeur de l'eau a atteint son maximum (au-dessus du zéro des cartes) et où tout mouvement de l'eau a cessé, jusqu'à ce que la direction du courant s'inverse. Des annuaires des marées officiels doivent être utilisés pour déterminer l'heure prévue de la hauteur maximale de la marée à la station des marées la plus proche, puis il faut ensuite extrapoler pour l'installation d’aquaculture en particulier.
- GPO
- groupements de vers polychètes opportunistes
- HA
- hypothèse complémentaire
- H0
- hypothèse nulle
- M
- médiane
- Macrofaune
- animaux dont la taille est calculée en millimètres
- Mégafaune
- animaux dont la taille est calculée en centimètres
- µM
- micromole; unité de mesure servant à exprimer les concentrations en sulfure
- MVT
- matières volatiles totales (exprimées en pourcentage)
- n
- taille de l'échantillon
- NAD
- système géodésique nord-américain
- Post-traitement (PT)
- les positions GPS sont corrigées en tenant compte des erreurs satellites et de propagation une fois que les observations ont été faites
- S=
- concentration de sulfures libres (exprimée en micromoles; μM)
- SAOB
- solution tampon antioxydante sulfurée
- SD
- écart-type
- SGS
- granulométrie des sédiments
- Surveillance du milieu benthique
- échantillonnage des sédiments et inspections vidéo réalisées au cours de l’activité d'une installation d’aquaculture de poissons à nageoires. Cela comprend la surveillance opérationnelle ainsi que le contrôle préalable et le suivi de l'empoissonnement.
- Temps réel
- les positions GPS sont corrigées en tenant compte des erreurs satellites et de propagation à mesure que les observations sont faites. Le récepteur de référence envoie les corrections et les observations au récepteur itinérant.
- VTG
- véhicule téléguidé
- x
- moyenne de l'échantillon
1 Stations de surveillance de la conformité
1.1 Établissement des stations ou des zones de surveillance de la conformité
- (a) Utiliser un système de de géolocalisation Global Positioning System (DGPS) pour obtenir des mesures pour chaque coin de l'ensemble de structures de confinement à l'étale de haute mer et veiller à ce qu'elles correspondent à l'emplacement de l'ensemble de structures de confinement qui a été approuvé. Il est à noter que seules les coordonnées d'un système de positionnement mondial différentiel seront acceptées, à moins d'indication contraire du Ministère.
- (b) Avoir recours à la procédure de cartographie électronique afin d'établir les stations ou zones de surveillance de la conformité pour les sites où le substrat est meuble ou dur.
- (c) Localiser les stations ou zones de surveillance de la conformité dans les zones où on s'attend à la concentration de matières organiques d'origine agricole la plus élevée en tenant compte des facteurs suivants :
- (i) les plus récentes données d'échantillonnage et de surveillance de la biomasse de pointe;
- (ii) les données d'échantillonnage et de surveillance historiques;
- (iii) les données de surveillance des cycles internes de l'entreprise;
- (iv) les données de vérification du MPO;
- (v) les données de modélisation;
- (vi) la direction du courant observée à des endroits précis;
- (vii) autres directives émises par le Ministère.
- (d) Localiser les stations ou zones de surveillance de la conformité le long des transects dans la direction des courants dominants ou sous-dominants, à moins d'indication contraire du Ministère. Au moins deux transects doivent être échantillonnés dans chaque ensemble de structures de confinement.
- (e) Si l'ensemble de structures de confinement est perpendiculaire à la direction du courant dominant et fait plus de 200 mètres de long, les procédures suivantes doivent être suivies :
- (i) ajouter deux transects tous les 200 mètres supplémentaires;
(ii) les transects doivent être séparés d'au moins 50 mètres;
(iii) l'emplacement des transects secondaires sera déterminé selon une modélisation ou d'autres méthodes d'évaluation indiquant l'emplacement du contour 5 g C/m2/jour de la manière suivante : - si le contour 5 g C/m2/jour s'étend au-delà de 30 mètres de l'extrémité de l'ensemble de structures de confinement du côté de la terre, les transects doivent traverser le contour à son point le plus éloigné;
- si le contour 5 g C/m2/jour ne s'étend pas au-delà de 30 mètres de l'extrémité de l'ensemble de structures de confinement du côté de la terre, les transects doivent être situés à l'extrémité de l'ensemble de structures de confinement qui donne sur le large.
- (f) Si des structures de confinement adjacentes ou des ensembles de structures de confinement adjacents sont à moins de 60 mètres les uns des autres, ils seront considérés comme un seul système une fois les transects localisés.
- (g) Les stations ou zones de surveillance de la conformité seront définies comme suit :
- (i) les transects situés dans la même direction que le courant dominant seront nommés transects A et C;
- (ii) les transects situés dans la même direction que le courant sous-dominant seront nommés transects B et D;
- (iii) selon les indications du Ministère.
1.2 Établissement des stations de référence
- (a) Établir les stations entre 0,5 et 2 kilomètres de l'ensemble de structures de confinement qui se trouve le plus près de l'installation.
- (b) Les stations de référence doivent être séparées d'au moins 0,5 kilomètre.
- (c) La profondeur moyenne doit être d'au plus 25 % supérieure ou inférieure à la profondeur moyenne de toutes les stations de l'installation. Il pourrait être nécessaire d'ajouter des stations de référence s'il y a des écarts de profondeur importants entre les stations de l'installation.
- (d) Les caractéristiques telles que la topographie, le type de fond marin, les régimes de courants et de marées et la quantité d'eau douce qui s'écoule ainsi que toute autre caractéristique applicable doivent être semblables à celles des stations de l'installation.
- (e) Si les stations de l'installation semblent avoir été influencées par une activité anthropique (par exemple, décharges de grumes), veiller à ce que les stations de référence aient subi des effets semblables.
- (f) Pour les sites où le substrat est meuble, la fraction de limon et d'argile de la granulométrie des sédiments ne doit pas être supérieure ou inférieure à 15 % de la fraction de limon et d'argile des stations de l'installation. Il pourrait être nécessaire d'ajouter des stations de référence s'il y a des écarts dans les fractions de limon et d'argile entre les stations de l'installation.
Remarque : Pour les relevés de référence, les stations de référence requièrent une analyse des sédiments et une collecte de données par vidéo sur au moins 100 m. Pour de plus amples renseignements, veuillez consulter le Document d'orientation sur les demandes.
2 Exigences en matière de surveillance du milieu benthique et de présentation de rapports
2.1 Fréquence et calendrier des activités de surveillance
- (a) La surveillance de la biomasse de pointe doit être effectuée :
- (i) dans les 30 jours de part et d’autre de la biomasse de pointe pour les exploitations dont le cycle de production se termine par la rétention de l’ensemble des poissons;
- (ii) à la fin de chaque période de 24 mois si le cycle de production dure plus de 24 mois;
- (iii) tous les 24 mois dans le cas des exploitations de stocks de géniteurs ou faisant l’élevage de poissons en permanence.
- (b) Avant l'introduction des poissons, une surveillance préalable des stocks doit également être réalisée selon les directives du ministère.
2.2 Méthode de surveillance
- (a) Prélever des échantillons de sédiments en suivant les procédures décrites à la section 4 – Échantillonnage des sédiments, sauf si :
- (i) Des échantillons ponctuels acceptables conformément à la section 4.4 (c, d et e) ne peuvent être prélevés aux stations de 0 ou 30 mètres. Dans ce cas, noter la latitude et la longitude du lieu des tentatives d’échantillonnage et soumettre une photographie de tout sédiment près de l’endroit où la tentative d’échantillonnage a échoué pour confirmer qu’il s’agit d’un substrat dur.
- (ii) Des échantillons ponctuels acceptables conformément à la section 4.4 (c, d et e) ne peuvent être prélevés aux stations de 125 mètres. Dans ce cas, noter le nombre et le lieu des tentatives d’échantillonnage et effectuer des inspections vidéo en respectant le protocole décrit à la section 3 – Inspections vidéo.
- (iii) Le Ministère confirme que le substrat d'une station est dur. Dans ce cas, l'information concernant les tentatives d'échantillonnage n'a pas besoin d'être présentée dans les rapports futurs.
2.3 Fréquence et calendrier des rapports
- (a) Les rapports de surveillance du milieu benthique doivent être présentés :
- (i) dans les 30 jours suivant les activités d'échantillonnage des sédiments pour les sites de substrat meuble;
- (ii) dans les 60 jours suivant les activités d’inspection vidéo visant à localiser des sites de substrat dur et mixte.
- (b) Les rapports de surveillance biologique doivent être présentés :
- (i) dans les 6 mois suivant la collecte d’échantillons soumis à une identification taxonomique;
- (ii) dans les 14 jours suivant la réception des résultats du taxonomiste.
- (c) Tous les rapports précités doivent être présentés au moins 14 jours avant l'empoissonnement prévu du site.
2.4 Contenu et format des rapports
- (a) Les rapports doivent être présentés dans un format acceptable pour le Ministère et comprendre les modèles de données fournis par le Ministère dûment remplis.
- (b) Les cartes qui indiquent le nombre et l’emplacement des structures de confinement doivent être produites à une échelle de 1 :5 000. Elles doivent aussi indiquer l’emplacement des enclos, notamment les enclos de récolte et de transfert, pendant le cycle de production.
- (c) Les cartes doivent indiquer les extrémités des deux segments de chaque transect vidéo et leurs coordonnées DGPS, toutes les stations d’échantillonnage de conformité, les coins de chaque ensemble de structures de confinement, l’emplacement des lignes d’ancrage connexes, la direction du courant dominant et les lignes isobathes de 10 m.
- (d) La biomasse de pointe (en tonnes) doit être déclarée.
- (e) Pour les sites de substrat dur, des DVD à haute résolution doivent être présentés accompagnés des données vidéo et des données de relevé liées à la base de données de classification.
- (f) Pour les sites où le substrat est meuble, toutes les données notées lors de l’échantillonnage et des analyses chimiques connexes doivent être présentées à l’aide du modèle de données sur la chimie des sédiments fourni par le Ministère.
- (g) Un rapport sommaire écrit incluant toutes les analyses statistiques nécessaires doit aussi être présenté pour l'ensemble de la surveillance du milieu benthique.
3 Inspection vidéo
Ces protocoles sont axés sur la méthode acceptée d'exécution d’inspections vidéo continues au moyen d'un véhicule téléguidé (VTG). Les méthodes normalisées d'installation et de positionnement de même que les normes relatives à l'équipement sont exposées en détail.
3.1 Programme de surveillance
- (a) Chaque transect doit débuter au bord de la structure de confinement et s’étendre :
- (i) sur 140 mètres à partir de l’ensemble de structures de confinement;
- (ii) sur 24 mètres ou 6 intervalles de temps [voir la section 3.7 (c)] au-delà d’ l’endroit où il a été observé pour la dernière fois que la couverture des espèces apparentées au Beggiatoa ou de groupements de vers polychètes opportunistes (GPO) était de plus de 10 %, selon la plus grande des distances.
- (b) Chaque transect sera constitué de deux sections décrites comme suit :
- (i) de 0 à 80 mètres;
- (ii) de 80 mètres à l'extrémité du transect, tel qu'il est décrit en (a).
3.2 VTG – Exigences minimales
- (a) Propulseurs horizontaux et verticaux. Un propulseur latéral est également recommandé.
- (b) Au moins deux fois par année :
- (i) les compas des VTG doivent être étalonnés à un niveau de précision de + 3° et les relevés doivent être pris selon le relèvement étalonné;
- (ii) le profondimètre doit être étalonné à un niveau de précision de + 2 % (étalonnage à pleine échelle) en prenant une mesure à au moins 3 profondeurs entre 10 et 100 mètres.
- (c) Lumières auxiliaires couplées :
- (i) placées en position latérale sur le même plan que la caméra et utilisées afin que l’éclairage soit uniforme sur une largeur d’au moins 0,5 mètre pour au moins 75 % du champ de vision;
- (ii) l’intensité de l’éclairage doit être équilibrée avec la sensibilité à la lumière de la caméra;
- (iii) des diffuseurs de lumière doivent être utilisés pour réduire la rétrodiffusion et l’ombrage au besoin.
- (d) Lumières lasers couplées :
- (i) nécessaires pour obtenir une échelle des longueurs et une estimation du champ de vision;
- (ii) la distance entre les lumières doit être consignée puisqu'elle peut varier selon les unités.
3.3 Caméra et enregistrement – Exigences minimales
- (a) La résolution et l’éclairage de la vidéo doivent être tels que le biote mesurant de 1 à 2 centimètres peut être repéré et identifié à l’intérieur d’un champ de vision horizontal de 0,5 mètre.
- (b) Affichage vidéo en temps réel indiquant l’heure, la profondeur et le relèvement du compas.
- (c) On recommande d’indiquer également le numéro d’identification du transect.
- (d) La vidéo originale doit pouvoir être transférée sur un support d’enregistrement numérique (c. à- d. aucune compression à la suite des inspections vidéo).
3.4 Exigences relatives au positionnement
- (a) Un dispositif GPS qui facilite les corrections différentielles en temps réel et post-traitement.
- (b) Un logiciel de positionnement GPS capable d’apporter des corrections différentielles post-traitement aux données du dispositif. Si un tel appareil n’est pas disponible, indiquer la méthode de positionnement utilisée et préciser les positions non corrigées qui sont utilisées ;
- (c) Favoriser l'utilisation d'un système de positionnement acoustique pour cartographier un transect à l'aide du VTG. Sinon, des bouées repères peuvent être utilisées pour naviguer jusqu'au point de départ des transects.
3.5 Conditions et exigences
- (a) Utiliser le VTG pendant l’étale de la marée ou lorsque les courants sont les moins forts afin de l’empêcher le plus possible de dériver.
- (b) Les transects vidéo doivent partir du bord de l’ensemble de structures de confinement.
- (c) Chaque transect doit comprendre deux sections : de 0 à 80 mètres et de 80 à 140 mètres (au minimum).
- (d) Au besoin, à des fins de précision, les facteurs de conformité observés tels que les espèces apparentées au Beggiatoa, les groupements de vers polychètes opportunistes, l’alimentation des poissons ou les excréments de poissons doivent être agrandis pour faciliter leur détection.
- (e) La vitesse optimale du VTG au-dessus du fond marin et de 0,2 m/s. La plage de vitesses acceptable se situe entre 0,15 et 0,25 m/s.
- (f) L'écart maximal par rapport au transect prévu est de ± 10 % de la longueur du transect prévue et de ± 20 % du relèvement du transect prévu.
3.6 Installation
- (a) Installer un câble lesté auquel une bouée repère est attachée proche de l’ensemble de structures de confinement, à l’endroit où le transect doit commencer.
- (b) Installer un second câble lesté auquel une bouée repère est attachée sur le relèvement du transect prévu, à 80 mètres du premier câble, au moyen d’appareils de navigation tels qu’un GPS, un logiciel de navigation et un télémètre pour confirmer la distance.
- (c) Guider le VTG du bateau amarré jusqu’au fond marin en suivant le câble lesté à proximité de l’ensemble de structures de confinement.
- (d) Utiliser un relèvement au compas préétabli pour diriger le VTG vers le câble lesté à 80 mètres. Estimer la distance en fonction du temps et du câble d’attache installé. Ramener le VTG à la surface et calculer les écarts de longueur et de largeur.
- (e) Utiliser un relèvement au compas préétabli et diriger le VTG le long du transect à une distance de 60 mètres supplémentaires (soit à 140 mètres de l'ensemble de structures de confinement). Ramener le VTG à la surface et calculer les écarts de longueur et de largeur.
Remarque : La longueur de la deuxième section du transect dépendra du respect des normes relatives aux GPO et aux espèces apparentées au Beggiatoa.
3.7 Évaluation vidéo
- (a) La classification et l’évaluation vidéo doivent être fondées sur le tutoriel vidéo Hard Seabed Aquaculture Video Monitoring Classification Tutorial DVD, version du 30 juin 2009, revue en février 2011.
- (b) Les données suivantes doivent être notées dans les tableaux de données brutes des rapports de la biomasse de pointe et des rapports d’empoissonnement préalable :
- (i) Paramètres abiotiques
- Le substrat, au moyen d’une échelle granulométrique de Wentworth indiquant le type d’habitat
- L’emplacement des déchets et des débris et le type de déchets et de débris
- (ii) Paramètres biotiques
- Couverture en pourcentage des indicateurs de conformité : espèces apparentées au Beggiatoa et GPO. Toutes les espèces apparentées au Beggiatoa et les groupements de vers polychètes observés doivent être signalés.
- Couverture en pourcentage des déchets et des excréments de poissons
- (iii) Présence et abondance relative des taxons sensibles, opportunistes et de conservation
- (i) Paramètres abiotiques
- (c) Classifier l’imagerie vidéo en segments vidéo de 20 secondes, en supposant que la vitesse sur le fond est de 0,2 m/s, sauf indications contraires. Un segment de 20 secondes correspond à une distance linéaire de 4 mètres; si le VTG ne peut atteindre une vitesse de 0,2 m/s, le temps de chaque segment doit être ajusté de façon que chacun corresponde à 4 mètres linéaires. Un tableau des temps d’arrêt peut être inclus pour justifier la longueur des segments si une vitesse uniforme ne peut être maintenue ou pour inclure les temps d’ascension et de descente du VTG. Diviser chaque segment de 20 secondes en intervalles de 5 secondes afin d’accroître la précision de la classification des segments. Veiller à ce que les catégories de segments vidéo de 20 secondes ne se chevauchent pas.
- (d) Calculer la longueur des transects vidéo selon l’heure de début et de fin, soustraire tous les temps d’arrêt de la caméra de plus de trois secondes et consigner la longueur temporelle qui englobe la zone de conformité.
- (e) Évaluer et consigner seulement les deux tiers inférieurs de l'écran, soit la zone considérée comme étant le « champ proche ».
- (f) Saisir les données dans la base de données Hard Seabed Aquaculture Classification Database, version 2.2 du 30 juin 2009, révisée en février 2011.
Utiliser la fonction de production de rapports de la base de données ainsi que les modèles de rapport pour présenter les données.
4 Échantillonnage des sédiments
Pour les besoins du présent protocole, l'échantillonnage des sédiments sert principalement à vérifier la conformité. La méthode de régression consiste à recueillir les données aux stations le long des transects qui s'étendent à l'extérieur de l'installation dans la direction des courants dominants. Les protocoles à suivre pour choisir une station d'échantillonnage, recueillir et manipuler les échantillons, se servir d'électrodes et produire des données physiques et chimiques sont décrits dans la présente section.
4.1 Programme de surveillance
- (a) Les stations de surveillance de la conformité suivantes doivent être échantillonnées le long de chaque transect :
- (i) au bord de l’ensemble de structures de confinement (station à 0 m);
- (ii) à 30 mètres du bord de l’ensemble de structures de confinement;
- (iii) à 125 mètres du bord de l’ensemble de structures de confinement.
- (iv) Pour les stations de surveillance de la conformité situées à 30 mètres et à 125 mètres qui n’ont pas été préétablies par des points de cheminement, utiliser un télémètre pour localiser les stations. (On recommande d’attacher le navire à l’ensemble de structures de confinement pour conserver la position.)
- (b) Deux stations de référence doivent être échantillonnées si les conditions de permis l’exigent.
- (c) Au moins trois échantillons répétés doivent être prélevés à chacune des stations de surveillance de la conformité requises.
- (d) Les échantillons faisant l’objet d’un rapport doivent être les premiers échantillons qui respectent les normes de qualité (voir la section 4.5).
- (e) Si la concentration en sulfures libres de l’un des trois échantillons dépasse le seuil pour cette station, deux autres échantillons doivent être prélevés et analysés aux fins de détection de sulfures libres et de mesure du potentiel redox.
- (f) Les meilleures pratiques en matière de relevés comprennent le prélèvement d'échantillons pendant l'étale de la marée et lorsque les vents sont faibles afin de minimiser la dérive et de faciliter le prélèvement d'échantillons aux stations de surveillance à conformité préétablie.
4.2 Exigences relatives au matériel
- (a) Les dispositifs acceptables pour l’échantillonnage des sédiments meubles pour les variables physiques, chimiques et biologiques comprennent ceux permettant de recueillir plusieurs échantillons au moyen d’un seul prélèvement, notamment les bennes de Ponar, de Smith-MacIntyre et de Van Veen.
- (b) Des multimètres et des électrodes doivent être utilisés pour mesurer la concentration de sulfures libres (Ag+/S=) et le potentiel redox (Eh). Voir la section 6 pour connaître les procédures de normalisation et d’étalonnage.
- (c) On recommande l'utilisation d'un bossoir à fonctionnement indépendant.
4.3 Préparation de l'échantillonnage et renseignements connexes
- (a) Préparer la solution sulfurée de réserve (10-2 M Na2S) et la solution tampon antioxydante sulfurée (EDTA/NaOH) au préalable (voir la section 6).
- (b) Ajouter l’acide ascorbique à la solution tampon antioxydante sulfurée juste avant l’étalonnage de l’électrode de sulfure d’argent (Ag+/S=).
- (c) S’il faut une solution de remplissage pour l’électrode d’Ag+/S=, veiller à ajouter la solution au moins 30 minutes avant d’utiliser l’électrode afin d’être certain qu’elle est stable.
- (d) Étalonner l'électrode de sulfure d'argent (Ag+/S=) et normaliser l'électrode redox (Eh) juste avant l'échantillonnage (en suivant les protocoles de la section 6).
4.4 Prélèvement et description des échantillons
- (a) Réduire la vitesse de descente à l’approche du fond marin et retirer le dispositif d’échantillonnage à une vitesse suffisamment lente pour éviter d’endommager la structure de la surface sédimentaire de l’échantillon.
- (b) Consigner les renseignements suivants et les inclure dans le modèle du tableau des données brutes présenté avec les rapports de suivi :
- (i) la latitude et la longitude corrigées des échantillons à l’aide d’un DGPS;
- (ii) les relèvements du nord magnétique et du nord vrai des transects (lorsque l’on s’éloigne de la ferme aquacole);
- (iii) la profondeur au point de prélèvement;
- (iv) l’heure de prélèvement de l’échantillon.
- (c) Si l’échantillon semble compromis par un prélèvement précédent (c.-à-d. qu’il a été recueilli dans le trou formé par un échantillonnage précédent), rejeter cet échantillon et recommencer.
- (d) Veiller à jeter l’excédent de sédiments des bennes de façon à ne pas compromettre les prélèvements suivants.
- (e) Vérifier si les échantillons localisés sont acceptables au moyen des indicateurs suivants :
- (i) présence d’eaux sus-jacentes – les fuites et la perturbation qui en découlent sont négligeables;
- (ii) eaux sus-jacentes pas trop troubles – la perturbation des sédiments est négligeable;
- (iii) surface des sédiments relativement plate – la perte de sédiments causée par le lessivage est négligeable;
- (iv) atteinte d’une profondeur de pénétration d’au moins cinq centimètres pour les sédiments de surface.
- (f) Si le dispositif d’échantillonnage est trop plein, retirer une partie ou l’ensemble des poids amovibles ou réduire le rythme de la mise en place.
- (g) Ne pas tenter de prélever un échantillon localisé valable à une station d’échantillonnage donnée plus de quatre fois. Si les tentatives échouent, suivre la procédure ci-dessous :
- (i) déplacer le bateau de un à trois mètres et tenter de prélever un échantillon. Si la première tentative échoue;
- (ii) déplacer le bateau en direction opposée du lieu initial et tenter de prélever un échantillon;
et - (iii) si la tentative échoue de nouveau, consulter la section 2.2.
- (h) Si des échantillons doivent être prélevés pour effectuer une analyse de la macrofaune, siphonner les eaux sus-jacentes de l’échantillon et les conserver aux fins de tamisage.
- (i) Consigner les renseignements suivants et les inclure dans le gabarit du tableau des données brutes présenté avec le rapport de suivi :
- (i) profondeur des sédiments en centimètres;
- (ii) texture des sédiments;
- (iii) couleur des sédiments et présence d'un sédiment noir;
- (iv) odeur sur une échelle de 0 à 4 (4 étant l'odeur la plus forte);
- (v) présence de bulles de gaz;
- (vi) présence d'espèces apparentées au Beggiatoa;
- (vii) présence de groupements de vers polychètes opportunistes (GPO);
- (viii) présence d'aliments pour poissons;
- (ix) présence de fèces de poissons;
- (x) présence de matière organique floconneuse;
- (xi) macrophytes;
- (xii) mégafaune;
- (xiii) matériaux terrigènes;
- (xiv) déchets des exploitations.
- (xv) Prendre une photographie en couleur de l'échantillon et la joindre au rapport de surveillance.
4.5 Préparation des sous-échantillons de sédiments
Effectuer une analyse du Eh et des sulfures dans un délai de cinq minutes après la collecte de l'échantillon en suivant les étapes ci-après :
- (a) Prélever des sous-échantillons en double sur les deux premiers centimètres des sédiments à partir du centre de chaque côté de la benne au moyen d’une spatule en plastique, d’une cuillère peu profonde ou de seringues de coupe en plastique, si la texture des sédiments le permet. Il faut un volume d’au moins 25 ml pour chaque analyse du Eh et des sulfures.
- (b) Mettre les deux sous-échantillons dans un récipient adéquat et retirer toutes les matières non représentatives (par exemple, gros fragments de coquilles, mégafaune, déchets ligneux et roches). Procéder à l’homogénéisation en mélangeant doucement les sédiments.
- (c) Retirer les sédiments nécessaires aux analyses du Eh et des sulfures. Le reste des sédiments doit être placé dans des sacs à languettes ou des coupelles en tissu pour l'analyse en laboratoire. L'analyse des MVT et du taux d'humidité (teneur en eau) peut être effectuée sur le même échantillon.
L'analyse de la granulométrie des sédiments doit être effectuée sur des sous-échantillons distincts. Tous les récipients d'entreposage doivent être gardés au frais et être fermés hermétiquement pour empêcher la dessiccation et l'exposition à un excès d'air.
4.6 Mesure des sulfures
- (a) Pour mesurer les sulfures, le rapport entre le volume de la solution tampon antioxydante sulfurée et celui des sédiments doit être de un pour un.
- (b) Verser 10 ml de la solution tampon anti-oxydante sulfurée dans un petit récipient gradué en plastique ou en verre, puis ajouter les sédiments de la section 4.5 (c) jusqu’à ce que le ménisque soit à 20 ml. (Toujours verser la solution tampon anti-oxydante sulfurée en premier.)
- (c) Remuer un bref instant puis insérer l’électrode d’Ag+/S= dans l’échantillon. Veiller à ce que le bulbe de l’électrode soit entièrement recouvert de bouillie de la solution tampon anti-oxydante sulfurée et de sédiments.
- (e) Déplacer doucement l'électrode dans le coulis jusqu'à ce qu'elle se stabilise. Selon l'électrode, un message indiquant qu'elle est prête apparaîtra à l'écran du multimètre ou un signal sonore sera émis (généralement après une à quatre minutes).
Remarque : Les complexes de sulfures métalliques en phase solide peuvent être solubilisés en milieux alcalins; il faut éviter l'exposition prolongée des sédiments à la solution tampon anti-oxydante sulfurée avant l'enregistrement du potentiel de l'électrode.
- (f) Essuyer délicatement l’électrode pour éliminer tous les sédiments avant de l’insérer dans le prochain échantillon.
- (g) L’électrode doit être exempte de tout résidu huileux avant qu’on l’utilise à nouveau.
- (h) Si les potentiels enregistrés avec l'électrode d'Ag+/S= dans un échantillon de sédiments ne se stabilisent pas après une ou deux minutes, le rendement peut être évalué sans qu'un étalonnage complet soit effectué. La concentration de sulfures peut être mesurée dans l'une des solutions étalons diluées sulfurées si elle a été entreposée au frais, dans un récipient opaque, en laissant le moins d'espace vide possible. Ne pas tenter de corriger les données qui sont erronées en raison de la dérive si les écarts sont inférieurs de 10 à 20 % des valeurs normales prévues. Si l'écart des valeurs mesurées est plus important que la valeur prévue, un étalonnage complet doit être effectué en suivant les protocoles de la section 6.
4.7 Mesure du Eh
- (a) Après avoir retiré le sous-échantillon nécessaire à l’analyse des sulfures indiquée à la section 4.6, insérer l’électrode redox dans le sous-échantillon qui reste et veiller à ce que le bulbe de l’électrode soit en contact avec les sédiments. L’électrode doit être tenue en position et ne doit pas bouger. Il y aura une dérive lorsqu’un potentiel au repos est atteint. Cela se produit lorsqu’une valeur relativement stable (dérive < 10 mV/min) est obtenue (habituellement en trois minutes).
- (b) Consigner la valeur Eh et la température en même temps.
- (c) Corriger la valeur Eh à l’aide des facteurs de correction de température indiqués par le fabricant. Il se peut qu’aucune correction ne soit nécessaire dans le cas de certaines électrodes ou que le multimètre soit muni d’une fonction de correction. (À vérifier auprès du fabricant.)
- (d) Essuyer doucement l’électrode pour éliminer tous les sédiments avant de l’insérer dans le prochain échantillon.
- (e) L'électrode doit être exempte de tout résidu huileux avant qu'on l'utilise à nouveau.
Remarque : Les potentiels redox mesurés sont convertis par rapport à l'électrode standard à hydrogène (ESH) en ajoutant une caractéristique de potentiel pour la solution de remplissage utilisée et la température de l'échantillon. Par exemple, le facteur de correction appliqué à un potentiel mesuré à 20 °C avec une solution de KCl 4 M dans une solution témoin saturée d'Ag/AgCl est +204 mV. Cette valeur est ajoutée au potentiel redox mesuré (que le potentiel soit positif ou négatif) pour calculer le potentiel redox de l'ESH. Les facteurs de correction à utiliser pour les différentes solutions de remplissage sont habituellement indiqués dans le mode d'emploi de l'électrode fourni par le fabricant.
4.8 Échantillonnage biologique
- (a) Tous les sédiments doivent être retirés de la benne en grattant et en rinçant la benne et versés dans des récipients prélavés lorsque des échantillons sont prélevés aux fins d'analyse de la macrofaune benthique. Conserver l'eau de rinçage avec l'échantillon d'endofaune.
Remarque : L'eau de rinçage doit être filtrée au moyen d'un tamis d'au moins 250 µM afin d'en retirer la faune ambiante avant de l'utiliser. - (b) Procédure à suivre pour le tamisage des échantillons biologiques sur le terrain :
- (i) tamiser chaque échantillon de sédiments, filtrer les eaux sus-jacentes et retirer l’eau au moyen d’un tamis de 1,0 mm. Veiller à ne pas endommager la faune par abrasion ou pression de l’eau au moment du tamisage. L’échantillon peut être tamisé en lots, selon son volume;
- (ii) recenser, identifier et photographier la mégafaune, consigner les données, puis remettre la mégafaune dans l’océan en prenant soin de causer le moins de dommages possible;
- (iii) conserver le gros gravier et les cailloux de moins de 2,5 cm de diamètre. Enlever l’épifaune et la joindre à l’endofaune obtenue lors du tamisage de l’échantillon;
- (iv) fixer l’échantillon faunique dans une solution tampon de formaldéhyde à 10 %; et
- (v) après quatre jours, rincer les échantillons fauniques au moyen d’un tamis de 0,5 mm pour éliminer le formaldéhyde, puis les conserver dans de l’alcool isopropylique ou de l’alcool éthylique à 70 %.
Remarque : Le mélange de formaldéhyde et d’eau de rinçage doit être mis dans un récipient et être traité adéquatement avant l’élimination.
- (c) Tous les échantillons biologiques doivent être :
- (i) recensés, la famille doit être identifiée et l’espèce des principaux taxons doit être identifiée;
- (ii) conservés, entreposés et archivés adéquatement pendant au moins cinq ans après leur manipulation.
5 Assurance de la qualité et contrôle de la qualité des échantillons de sédiments
L'assurance de la qualité et le contrôle de la qualité (AQCQ) sont des aspects essentiels d'un programme d'échantillonnage et de surveillance. L'assurance de la qualité peut être définie comme l'« ensemble des actions planifiées et systématiques nécessaires pour fournir une certitude adéquate quant à la pertinence d'un produit ou d'un service par rapport à des exigences définies en matière de qualité ». Le contrôle de la qualité peut être défini comme les « techniques et activités opérationnelles utilisées pour satisfaire aux exigences en matière de qualité », ou encore, un « plan bien documenté garantissant que les résultats sont exacts, à un niveau d'erreur constant ».
Les activités d'AQCQ sont réalisées tant sur le terrain qu'en laboratoire. Les laboratoires commerciaux doivent obtenir la certification de l'Association canadienne des laboratoires d'analyse environnementale (ACLAE), qui leur demande de participer à un programme d'essais d'aptitude inter-laboratoire. Tous les paramètres liés à l'analyse des sédiments marins ne font pas partie de ce programme et, pour ceux-ci, les laboratoires doivent suivre un plan d'assurance de la qualité standard qui comprend l'utilisation d'échantillons à blanc, d'échantillons répétés et de normes de référence.
5.1 AQCQ des échantillons physiques et chimiques
- (a) Potentiel redox
- (i) Veiller à ce que l’électrode redox soit remplie d’une solution de remplissage et procéder à la normalisation selon les normes relatives au potentiel redox recommandées (section 6).
- (ii) À chaque série de 20 échantillons ou une fois par lot si moins de 20 échantillons sont prélevés, mesurer 3 fois le potentiel redox.
- (iii) Si le potentiel n’est pas stable (dérive > 10 mV/min), déterminer un temps d’attente standard (il est conseillé d’attendre trois minutes) et consigner les valeurs après cette période. Prendre note de l’absence de stabilisation et des heures auxquelles les relevés ont été pris.
- (b) Sulfures libres totaux (« S ») présents dans la solution tampon antioxydante sulfurée
- (i) Veiller à ajouter la solution de remplissage à l’électrode d’Ag+/S= quelques heures avant l’étalonnage.
- (ii) Étalonner l’électrode selon les normes et les protocoles énoncés à la section 6.
- (iii) Prendre une autre mesure des sulfures libres totaux dans un échantillon pour chaque lot de 20 échantillons ou une fois par lot si moins de 20 échantillons sont analysés.
- (c) Analyses en laboratoire
- (i) Prélever un sous-échantillon de sédiments supplémentaire tous les 20 prélèvements, ou un par lot si moins de 20 échantillons sont prélevés, pour effectuer des analyses en double des matières volatiles totales (MVT), de la granulométrie des sédiments, du taux d’humidité (teneur en eau) et d’autres paramètres applicables.
- (ii) Veiller à ce que le sous-échantillon soit représentatif de l’échantillon composite, homogénéisé adéquatement et assez gros pour toutes les analyses prévues.
- (iii) À la réception des données des analyses en laboratoire, il faut confirmer ce qui suit :
- l'écart-type relatif de 35 % n'a pas été dépassé pour la granulométrie des sédiments;
- l'écart-type relatif de 20 % n'a pas été dépassé pour les MVT;
5.2 AQCQ des échantillons biologiques
L'AQCQ des échantillons biologiques peut être effectuée de deux façons :
- (a) Remettre les échantillons à soumettre à un examen d’AQ à un taxonomiste sous-traitant. Le laboratoire du taxonomiste doit avoir son propre programme d’AQCQ.
- (b) Le personnel agréé* de l’installation prélèvera les échantillons de macrofaune sur place en suivant les étapes suivantes :
- (i) toutes les dix bennes, une benne supplémentaire doit être recueillie, divisée en deux parties égales et tamisée, et la faune doit être retirée des deux parties et être préservée. Le personnel de l’installation doit recenser et identifier la macrofaune présente dans une moitié de l’échantillon; l’autre moitié sera transmise à un laboratoire reconnu qui se chargera d’effectuer une analyse semblable;
- (ii) les résultats obtenus par le personnel de l'installation et le laboratoire de taxonomie reconnu doivent être similaires à au moins 70 %. Les résultats du laboratoire sous-traitant doivent être communiqués directement au Ministère.
Remarque : *Le personnel doit être agréé par un établissement d'enseignement reconnu pour son expertise en identification taxonomique des familles de macrofaune.
6 Étalonnage de l’électrode de sulfure d’argent (Ag+/S=)
Les électrodes d'Ag+/S= servent à mesurer les ions de sulfures libres (S= ou « S ») dans les échantillons de sédiments traités à l'aide d'une solution tampon antioxydante sulfurée. L'exposition des sédiments à un milieu alcalin créé par la solution tampon (pH de 12 et plus) peut solubiliser une certaine fraction des « S » en phase solide (pyrite et autres complexes métalliques) dans un échantillon. Par conséquent, les « S » peuvent être définis, d'un point de vue opérationnel, comme les ions de « S » totaux mesurés dans les échantillons de sédiments tamponnés avec la solution tampon antioxydante sulfurée. Les électrodes d'Ag+/S= doivent être étalonnées avant chaque prélèvement et être réétalonnées au moins toutes les trois heures pendant l'analyse.
Les protocoles suivants s'appliquent à tous les types d'électrode d'Ag+/S=. Étant donné que les exigences peuvent être légèrement différentes selon les modèles, l'exploitant doit bien connaître le modèle avant d'étalonner l'électrode. Si elles sont régulièrement utilisées, les électrodes d'Ag+/S= combinées doivent être remplacées environ tous les deux ans, car elles ont tendance à devenir moins précises avec l'usure normale
6.1 Matériel et équipement
- (a) Les potentiels des électrodes sont mesurés à l’aide d’électrodes combinées d’Ag+/S= et d’un multimètre adéquat. Tout multimètre en millivolts doté de connecteurs convenant à l’électrode peut être utilisé.
- (b) Le choix de la solution de remplissage a une incidence sur les potentiels de l'électrode (par exemple, si une électrode combinée Sure-Flow 96-16BNWP d'Orion est utilisée, la solution de remplissage témoin appropriée sera la solution de remplissage Optimum Results A 900061 d'Orion). Le niveau de la solution de remplissage de l'électrode doit toujours être maintenu juste en dessous du bouchon de remplissage du baril.
6.2 Tableau récapitulatif des solutions requises
Solutions |
Période de péremption |
Solution tampon antioxydante sulfurée |
3 heures |
Solution tampon antioxydante sulfurée sans acide ascorbique |
7 jours |
Solution sulfurée de réserve, 10 000 µM (10-2 M Na2S)* |
48 heures (solution exempte d'air conservée au frais dans un contenant) |
Solution étalon sulfurée, 1 000 µM (10-3 M Na2S)* |
3 heures |
Solution étalon sulfurée, 100 µM (10-4 M Na2S)* |
3 heures |
Remarque : Les trois solutions étalon (*) présentées dans le tableau sont recommandées pour l'étalonnage selon une procédure en trois points. Si les concentrations de « S » des échantillons sont censées être inférieures à 100 µM, ou si elles le sont, une solution étalon de 10 µM doit être préparée afin de créer une série d'étalonnages selon une procédure en trois points, soit à 10 µM, à 100 µM et à 1 000 µM. Les solutions sulfurées sous 100 µM sont instables et ces valeurs se situent également au niveau minimal de sensibilité de la plupart des électrodes combinées d'Ag+/S= offertes sur le marché.
6.3 Préparation des solutions
- (a) Solution tampon anti-oxydante sulfurée
- (i) Matériel
- 20,0 g de NaOH (cristaux d’hydroxyde de sodium)
- 17,9 g d’EDTA (acide éthylènediaminetétracétique, sel disodique dihydraté)
- 8,75 g d’acide ascorbique
- Eau désionisée dégazée - (ii) Procédure
- Dissoudre les cristaux de NaOH dans 250 ml d’eau désionisée dégazée (utiliser une fiole jaugée).
- Ajouter l’EDTA à la solution de NaOH et remuer jusqu’à dissolution complète.
- Verser la solution dans un bocal en plastique à couvercle vissé. On peut préparer de plus grandes quantités de solution au besoin, pourvu que les proportions d’agents réactifs soient respectées.
- Ajouter l’acide ascorbique tout juste avant de procéder à l’étalonnage ou aux analyses des échantillons. Conserver la solution préparée dans un endroit sombre, à 4 °C.
- La température de l’eau désionisée dégazée doit être à peu près la même que celle des sédiments à prélever. - (b) Solution sulfurée de réserve de 10 000 µM
- (i) Matériel
- 0,2402 g de Na2S·9H2O (10 000 µM) (pesé au préalable et conservé dans des ampoules plongées dans l’azote, l’argon ou l’hélium).
- Eau désionisée dégazée. - (ii) Procédure
- Sous une hotte ou dans un endroit bien aéré, verser le Na2S·9H2O (0,2402 g) dans une fiole jaugée contenant 100 ml d'eau désionisée dégazée. Remuer jusqu'à dissolution complète. Conserver dans une bouteille opaque hermétique en laissant le moins d'espace vide possible.
- Préparer une dissolution en série (10 000 µM, 1 000 µM, 100 µM et 10 µM, selon les besoins) immédiatement avant d'étalonner l'électrode combinée d'Ag+/S=en versant 10 ml de solution de réserve de 10 000 µM de Na2S dans la fiole jaugée et en diluant le mélange avec 90 ml d'eau désionisée dégazée. Répéter cette étape en séquence en utilisant 10 ml de chaque solution obtenue et en la diluant avec 90 ml d'eau désionisée dégazée.
- La température de l'eau désionisée dégazée doit être à peu près la même que celle des sédiments à prélever.
6.4 Procédure d'étalonnage
- (a) Fréquence et manipulation
- (i) L’électrode combinée d’Ag+/S= doit être réétalonnée au moins toutes les trois heures et chaque fois qu’un échantillonnage a lieu dans une nouvelle exploitation aquacole.
- (ii) Avant chaque étalonnage, il faut nettoyer le bulbe de l’électrode en le frottant doucement avec une bande abrasive ou en l’immergeant dans une solution détergente. S’il est difficile d’obtenir la pente prévue pour la relation entre le potentiel en mV et les concentrations logarithmiques de solution sulfurée [voir la sous-section (b) ci-dessous], il faudra peut-être procéder à un nettoyage pour enlever les dépôts accumulés sur le bulbe de l’électrode.
- (iii) Il faudrait également vérifier si l’électrode contient suffisamment de solution de remplissage et en rajouter au besoin, ou remplacer la solution par de l’électrolyte frais (dans ce dernier cas, il faudra attendre au moins 30 minutes avant d’utiliser l’électrode, le temps que celle-ci se stabilise).
- (b) Étalonnage de l’électrode
- (i) L’étalonnage de l’électrode combinée d’Ag+/S= doit se faire en ordre croissant, de la plus faible concentration à la concentration la plus forte, selon une procédure en trois points normalisée. Un volume fixe de la solution étalon est dilué dans une part égale de solution tampon antioxydante sulfurée (rapport de volume 1 :1) tout juste avant de mesurer chaque potentiel.
- (ii) La plage de concentrations des solutions étalons utilisées pour l’étalonnage en trois points doit correspondre à la plage de concentrations de sulfures que devraient contenir les échantillons de sédiments.
- (iii) Les valeurs en mV des potentiels sont enregistrées par le multimètre une fois qu’elles sont stables (ce qui prend d’une à trois minutes selon l’appareil utilisé).
- (iv) Lorsque les valeurs de la troisième solution sont enregistrées, obtenir du multimètre le calcul de la pente des concentrations. La pente théorique est de -28 mV pour chaque multiple de 10 de la concentration de sulfures, mais en raison de la sensibilité à la température et des différences dans les électrodes, la plage de valeurs acceptée se situe entre -27 et -33 mV. Si la valeur de la pente ne respecte pas cette plage, procéder à un nouvel étalonnage en utilisant des solutions étalons fraîches (vérifier aussi la propreté de la sonde, le niveau de solution de remplissage et le fonctionnement de la pile, entre autres, avant de réétalonner l’électrode).
- (v) Lorsque l'étalonnage est terminé, rincer l'électrode avec de l'eau désionisée et bien assécher l'électrode avant de mesurer le premier échantillon.
- (vi) Lorsque les mesures des sédiments ont été prises, rincer l'électrode et la vider de sa solution de remplissage (sauf si l'électrode doit être utilisée dans la même semaine).
7 Normalisation de l’électrode de platine (Pt) de mesure du potentiel redox
L'électrode de platine est utilisée pour mesurer les potentiels EhESH afin de déterminer les potentiels redox dans les échantillons de sédiments. Les valeurs n'indiquent pas les réactions thermodynamiques qui sont en cause dans la création des potentiels mesurés.
Les protocoles décrits ci-dessous sont des protocoles généraux de normalisation du potentiel redox de l'électrode de platine. Les exigences peuvent varier légèrement selon les modèles, de sorte que l'exploitant doit connaître le modèle avant de procéder à l'étalonnage de l'électrode.
7.1 Matériel et équipement
- (a) Tout multimètre à électrode pour ions spécifiques ou mV-mètre doté de connecteurs convenant à une électrode combinée Pt offert sur le marché peut être utilisé pour déterminer les potentiels EhESH (redox).
- (b) Les électrodes redox combinées (référence interne) sont rechargeables ou remplies de gel et sont dotées d’un connecteur BNC permettant de les brancher à un mV-mètre muni d’un connecteur du même type. On recommande d’utiliser des électrodes rechargeables, de préférence dotées à leur extrémité d’un mince disque de platine (environ 1 cm2 de surface) plutôt qu’un bulbe.
- (c) L’électrode rechargeable doit être remplie avec la solution de référence. Pour les échantillons marins, on recommande l’utilisation d’une solution de KCl 4 M saturée avec de l’Ag/AgCl.
- (d) Il faut utiliser au moins une solution redox de référence pour effectuer la normalisation de l’électrode de platine. On peut acheter ce type de solution auprès du fabricant de l’électrode.
- (e) Des bandes abrasives peuvent être utilisées pour nettoyer (polir) le disque de platine de l’électrode si des dépôts s’y sont accumulés pendant l’utilisation. Le nettoyage peut aussi se faire à l’aide d’un détergent en poudre très fine.
7.2 Procédure
- (a) L’électrode de platine doit être ré-étalonnée au moins toutes les trois heures et chaque fois qu’un échantillonnage a lieu dans une nouvelle exploitation aquacole.
- (b) Si une électrode rechargeable est utilisée, la remplir de solution de remplissage (KCl 4 M saturée d’Ag/AgCl) au moins 24 heures avant de l’utiliser.
- (c) Le compartiment de référence de l’électrode doit être complètement rempli. Vérifier s’il y a de la solution de remplissage autour de la jonction du compartiment de référence.
- (e) Étalonner l’électrode en la plaçant dans une solution étalon dont la température se rapproche de la température prévue des échantillons de sédiments. Consigner la température réelle immédiatement avant de prendre les mesures. Les valeurs mV devraient se stabiliser rapidement (en moins de 30 secondes) en raison des fortes réactions couplées d’oxydoréduction qui se produisent dans la solution étalon. Consigner la valeur du potentiel pour la comparer à la valeur étalon prévue de +220 mV (potentiel d’une solution étalon contenant un couple triiodure/iodure à 20 °C). La valeur mesurée doit se situer à + 5 mV de la valeur étalon. Si ce n’est pas le cas, réétalonner l’électrode conformément aux instructions données dans le manuel pertinent.
- (f) Lorsque les mesures des sédiments sont prises, rincer l'électrode rechargeable et la vider de sa solution de remplissage (sauf si l'électrode doit être utilisée dans la même semaine).
8 Réalisation des analyses statistiques
Dans le but de vérifier la conformité des installations situées dans une zone de sédiments meubles, des analyses statistiques sont réalisées pour déterminer s'il y a des écarts importants (p < 0,05) entre les concentrations moyennes de sulfures libres (« S ») et les normes de conformité établies. Des tests non paramétriques peuvent être effectués pour évaluer les écarts entre les stations quant aux concentrations moyennes de « S » des stations de l'installation et des stations de référence.
8.1 Méthodes statistiques permettant d'établir si les exigences sont respectées
Les concepts d'étude et les tests statistiques suivants servent à déterminer si les installations respectent les exigences chimiques et biologiques.
Remarque : les résultats de traitement statistique peuvent différer légèrement selon les progiciels utilisés. Les données suivantes sont présentées à titre d'exemple seulement et ont été obtenues à partir de logiciels de calcul statistique en accès libre.
Exemple d'un ensemble de données
| Station | Rap 1 | Rap 2 | Rap 3 | Rap 4 | Rap 5 |
|---|---|---|---|---|---|
| 30 m | 1 200 | 1 500 | 3 000 | 1 900 | 800 |
| 125 m | 900 |
700 |
1 000 |
600 |
800 |
| Réf. 1 | 100 |
150 |
175 |
||
| Réf. 2 | 200 |
300 |
250 |
||
| 30 m après la mise en jachère | 800 |
650 |
1 100 |
540 |
200 |
(a) Statistiques descriptives (obligatoires)
Ces statistiques descriptives résument les données obtenues à chaque station.
(i) Calculer les statistiques sommaires, y compris le nombre d'échantillons, la valeur moyenne, la valeur médiane et l'écart-type pour toutes les stations.
| Station | Nombre | Moyenne | Médiane | Écart-type |
|---|---|---|---|---|
| 30 m | 5 |
1 680 |
1 500 |
841 |
| 125 m | 5 |
800 |
800 |
158 |
| Réf. 1 | 3 |
142 |
150 |
38 |
| Réf. 2 | 3 |
250 |
250 |
50 |
(ii) Créer un tracé en rectangle et moustaches illustrant toutes les stations. Les tracés en rectangle et moustaches montrent la valeur médiane (au centre du rectangle), les 25e et 75e centiles (aux extrémités du rectangle), les valeurs minimales et maximales (à l'extrémité des moustaches) et les observations aberrantes (points).
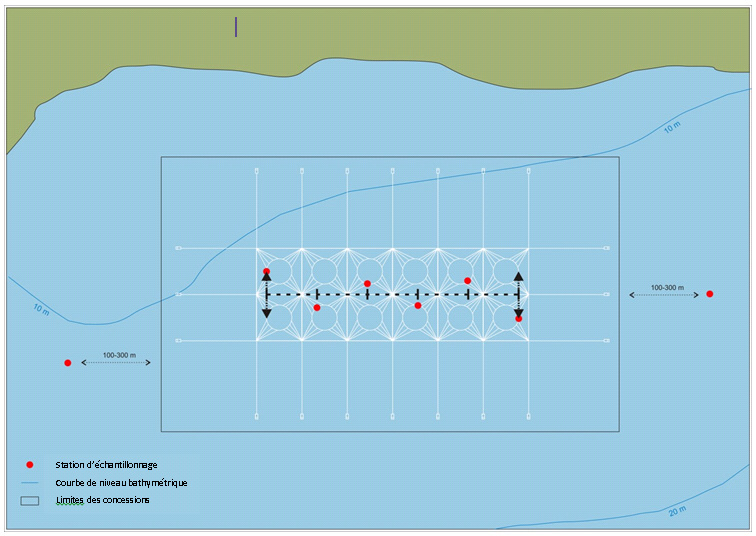
Figure 1. Tracé en rectangle et moustaches
Test statistique visant à déterminer le taux de conformité (obligatoire)
Le test t de Student à un seul échantillon est un test paramétrique servant à comparer les mesures d'une valeur seuil unique. Il est admis que trois à cinq points de données par station seulement ne fournissent pas suffisamment de renseignements pour déterminer si toutes les hypothèses du test t de Student sont confirmées. Toutefois, il n'existe pas de test non paramétrique équivalent. Le test t de Student sera donc la principale méthode employée pour évaluer la conformité. L'hypothèse nulle est rejetée si la valeur prédictive est inférieure au niveau de signification admis (α = 0,05).
(i) Effectuer un test t de Student unilatéral à un seul échantillon pour vérifier si la concentration moyenne de sulfures libres à la station de surveillance de la conformité située à 30 m est statistiquement supérieure à 1 300 µM ou 4 500 µM.
Exemple :
H0 = la moyenne vraie est égale à 1 300 µM
HA = la moyenne vraie est supérieure à 1 300 µM
Résultats :
t = 1,011, nu = 4, valeur prédictive = 0,185
Rien ne permet de penser que la concentration moyenne de sulfures libres à la station située à 30 m est statistiquement supérieure à la norme de 1 300 µM (p > 0,05).
(ii) Effectuer un test t de Student unilatéral à un seul échantillon pour vérifier si la concentration moyenne de sulfures libres à la station de surveillance de la conformité située à 125 m est statistiquement supérieure à 700 µM.
Exemple :
H0 = la moyenne vraie est égale à 700 µM
HA = la moyenne vraie est supérieure à 700 µM
Résultats :
t = 1,414, nu = 4, valeur prédictive = 0,115
Rien ne permet de penser que la concentration moyenne de sulfures libres à la station située à 125 m est statistiquement supérieure à la norme de 700 µM (p > 0,05).
Annexe 9: Protocole de surveillance des substrats benthiques dans les exploitations d'élevage de poissons de mer de Terre-Neuve-et-Labrador
Objectifs
Le Protocole de surveillance pour les sites à fonds durs des substrats benthiques dans les exploitations d'élevage de poissons de mer à T.-N.-L. expose les lignes directrices relatives à l’échantillonnage des impacts sur l'habitat benthique du poisson de l’activité d’aquaculture utilisant des parcs en filet de pisciculture marine, afin de permettre l'évaluation des effets sur la nutrification résultant de l'immersion ou du rejet de matières exerçant une demande biochimique en oxygène (DBO) (excréments de poissons, aliments pour poissons non consommés et biosalissures d'origine naturelle).
Le protocoledécrit les procédures d'échantillonnage benthique visuel effectuées à la biomasse courante nécessaires pour démontrer la conformité aux conditions autorisant l'immersion ou le rejet de substances nocives dans une installation d’aquaculture en vertu du Règlement sur les activités d'aquaculture. Il remplace les dispositions des rapports de surveillance sur la période de jachère pour le poisson conçues dans le but d'évaluer l'efficacité de la mise en jachère comme principale mesure d'atténuation pour maintenir la productivité de l'habitat du poisson.
Le protocole s'applique aux cas où la nature du substrat benthique dans une installation d’aquaculture empêche la mesure du sulfure dans les sédiments et où l'interprétation des données de référence de caractérisation du site, normalement recueillies au cours du processus de délivrance de permis du site aquacole, permettent de conclure que plus de 50 % de la zone visée par le bail est à fond dur, composée d'une paroi rocheuse, d'un substrat rocheux, de blocs, de gravats, de galets, de gravier ou de substrats plus fins compactés. On s'attend à ce qu'il soit appliqué pour la plupart des sites de pisciculture marine de Terre-Neuve-et-Labrador.
Portée
Le Règlement sur les activités d'aquaculture, en vertu de la Loi sur les pêches, autorise et établit les dispositions en vertu desquelles les activités d’aquaculture peuvent immerger ou rejeter des drogues, des pesticides et des matières exerçant une DBO dans le cadre de leurs opérations normales en vertu des mesures des articles 35 et 36 de la Loi sur les pêches visant à protéger les pêches et l'habitat du poisson. Le Règlement complète les mesures législatives fédérales et provinciales existantes et s'appuie sur des critères de sélection de sites, des mesures d'atténuation et des mesures de gestion de production établis.
À T.-N.-L., on procède depuis toujours à la réduction de l'immersion et du rejet de matières exerçant une DBO ainsi qu'à l'évitement et à l'atténuation des changements benthiques dans les sites marins d'élevage en cages par l'intermédiaire de l'application de critères de sélection des sites avant l'établissement des sites, l'adoption de pratiques exemplaires pendant le cycle de production et l’établissement d’une période de mise en jachère surveillée entre les cycles de production afin de permettre l'assimilation des dépôts organiques par l'entremise des processus naturels. Parmi ces mesures figurent :
- Positionner les cages à une profondeur d'eau de plus de 30 m
- Éviter d'établir des installations dans des herbiers de zostère, des bancs de varech et d'autres habitats vulnérables
- Éviter le chevauchement avec des aires de pêche commerciale connues
- Utiliser des caméras et des registres quotidiens pour l'alimentation dans le but de minimiser le gaspillage d'aliments excédentaires
- Appliquer un minimum de mise en jachère d'un an après chaque cycle de production
- Retirer des sites les rebuts d'aliments et de poissons morts
- Retirer et nettoyer les filets à l’extérieur, dans une installation centralisée
- Mettre en œuvre un « Code de confinement des salmonidés d'élevage de T.-N.-L. »
- Enlever l’équipement après le cycle de production
- Rédiger des rapports sur la surveillance de la période de mise en jachère de poissons à nageoires
Termes et définitions
- aire de la cage
- aire du fond marin directement sous la cage
- aquaculture
- élevage de poissons, mollusques ou crustacés
- benthique
- associé au fond marin
- biomasse courante
- biomasse totale d'une exploitation aquacole à un moment donné
- cage
- cadre flottant auquel est attaché un sac en filet qui isole le poisson et fait partie intégrante de l'exploitation aquacole
- épidémie
- détection d'un agent pathogène ou d'une maladie qui entraîne la mise en quarantaine d'un site par les autorités fédérales et provinciales ou tel qu'il est indiqué par un vétérinaire
- fond dur
- substrat composé de substrat rocheux ou de grandes constructions maritimes fixes ou établies sur des roches comme des quais et des pipelines
- fond meuble
- en lien avec une étendue d'eau, un fond ou un plancher composé de particules non agrégées comme de l'argile, de la vase, du maërl, du sable, des galets, du gravier, des coquillages ou des pierres de petite taille
- espèces indicatrices
- espèces benthiques qui définissent une caractéristique ou une caractéristique de l'environnement ou qui servent de mesure des conditions environnementales existantes dans un emplacement donné
- macrofaune
- animaux de fond conservés sur une grille à mailles de 0,5 mm ou dont la taille des ouvertures est de 1 mm
- matière exerçant une demande biochimique en oxygène
- toute matière organique qui contribue à la consommation d'oxygène dissoute dans l'eau ou dans des sédiments
Norme – s'entend de la Norme relative à la surveillance de l'aquaculture et de ses versions modifiées, de temps à autre, qui sont produites par le ministre et tenues à jour sur le site Web de Pêches et Océans Canada - programme de surveillance
- ensemble de mesures courantes de paramètres décrivant les effets environnementaux des exploitations de poissons à nageoires
- site d'exploitation aquacole
- emplacement géographiquement défini pour l'aquaculture
- surveillance de base
- échantillonnage d'une zone d'influence qui n'a pas auparavant été utilisée pour la production de poisson
- surveillance des transects
- documentation des changements qualitatifs et quantitatifs sur une distance
- surveillance environnementale
- observation systématique, mesure et calcul de l'état de l'environnement, du niveau d'émission de polluants ou des populations et des espèces qui sont nécessaires à l'évaluation de l'état de l'environnement, à l'élaboration de politiques environnementales et à la planification de mesures de protection de l'environnement, ainsi qu'au contrôle de l'efficacité de ceux-ci
- valeur de seuil
- valeur d'un paramètre régissant une répartition entre différents niveaux d'incidence définis dans un programme de surveillance
Méthode
Mise en place des stations d'échantillonnage
- Les stations d'échantillonnage doivent être établies en bordure des cages ou des structures de confinement, à proximité de ces bordures et à une distance définie, dans les limites de la zone d'effet prévue ou anticipée de l'exploitation.
- Aucun échantillonnage ne doit avoir lieu sur quelque site que ce soit lors d'une flambée épidémique ou d'une période de rétablissement, tel qu'il a été convenu en consultation avec le MPATNL – Division de la santé des animaux aquatiques. Tout l'équipement doit être désinfecté conformément aux protocoles de biosécurité approuvés.
Les visites de sites sont interdites dans les circonstances suivantes :
- Lorsqu'une quarantaine a été imposée
- Pendant la quarantaine, lors d'un cas de maladie à déclaration obligatoire, sauf dans le cadre de procédures normales d'exploitation (PNE) approuvées
- Lorsque des engins ou de l'équipement associés à une maladie à déclaration obligatoire sont toujours présents sur le site
- S'il y a détection, sur le site, d'un agent pathogène important relevant de la compétence provinciale ou d'un épisode de mortalité inexpliqué
- Lorsque des travaux de diagnostic sont en cours sur un site et que le vétérinaire sur place juge que ce site constitue une menace à la biosécurité
Les visites de sites sont permises dans les circonstances suivantes :
- Si l'on a communiqué avec MPATNL – Division de la santé des animaux aquatiques avant la visite et s'il n'y a aucune épidémie ou menace à la biosécurité ayant été rapportée
- Si l'on respecte les procédures opérationnelles normalisées en matière de biosécurité en ce qui a trait aux visites du site
- S'il n'y a pas une multitude de visites d'entreprise ou de site le même jour
- S'il n'y a pas une multitude de visites de zones de gestion des baies le même jour
Mise en place des stations de référence
Les critères suivants seront appliqués lors de la mise en place d'une station de référence :
- L'emplacement ne doit pas être exposé à l'immersion ou au rejet de matières exerçant une DBO émanant de l'installation ou d'installations adjacentes, comme l'indiquent la modélisation prédictive, les données historiques ou les résultats de l'échantillonnage;
- La profondeur ne doit pas avoir plus de 10 m d'écart avec la fourchette des profondeurs des stations d'échantillonnage;
- La topographie, le type de fond de mer, les régimes de marées et de courants, les influences exogènes, la taille des grains de sédiments et la quantité d'eau douce qui s'écoule doivent être représentatifs de la station d'échantillonnage;
- La station de référence devrait être située dans le même plan d'eau contigu.
Méthode d'échantillonnage
- La surveillance doit être effectuée lorsque les conditions d'eau et météorologiques réduisent au maximum les effets néfastes sur la qualité de l'échantillonnage et facilitent un échantillonnage précis aux stations (par exemple, pendant l'étale de la marée, lorsque le vent est faible et la visibilité est bonne).
- L'échantillonnage doit être effectué au cours de la période pendant laquelle l'utilisation de l'alimentation quotidienne, réelle ou prévue, est à son maximum, pendant le cycle de production de l'installation.
- L'échantillonnage visuel doit être réalisé conformément à la procédure normalisée d'exploitation (PNE) pour le système de caméra vidéo sous-marine (2012).
- Il est possible d'enregistrer la vidéo au moyen d'une caméra sous-marine (câble). Le périmètre de la zone sous chaque cage doit être enregistré sur bande vidéo. Il faut filmer la plus grande superficie possible.
- La date de l'échantillonnage doit être enregistrée sur la vidéo, sans oublier que les références doivent être précises, de façon à ce qu'une personne qui la visionne puisse évaluer les conditions de chaque lieu d’échantillonnage.
- La vidéo doit être équilibrée sur le plan du foyer de l'image, de la clarté, de l'équilibre des couleurs et de l'éclairage.
- La vidéo doit également être accompagnée de tableaux de renseignements dûment remplis (annexe 1). Bien s'assurer que figure dans les tableaux une description de l'emplacement exact du site, des images enregistrées sur vidéo, de la profondeur de l'eau sous chaque cage et de l'emplacement de la caméra de chacune des cages. Voir l'exemple de dessins à l'annexe 2.
- Les renseignements supplémentaires à inclure sont les suivants :
- Le numéro d'AQ du MPA
- Le nom du propriétaire du site
- L'emplacement du site
- La première année d'occupation
- Le nombre total d'années de production du site
- Les types, la taille, la profondeur et le nombre de cages utilisées pendant un cycle de production
- Les espèces de poissons élevés
- Le type et la quantité d'aliments utilisés
- Toute évasion ou toute mortalité importante ayant eu lieu sur le site au cours du dernier cycle de production. Dans l'affirmative, indiquez la ou les causes
- La forme d'élimination des poissons morts ou des autres déchets provenant de l'exploitation
- Pour la surveillance permanente de la biomasse, il faut fournir un enregistrement vidéo des conditions au bord des cages (0 mètre), et poursuivre à tous les 20 m, le long des transects, jusqu'à une distance maximale de 100 m.
- Deux transects seront échantillonnés à partir de chaque coin de l'ensemble des cages.
- Des transects supplémentaires seront échantillonnés au centre de l'ensemble des cages, pour les sites comptant plus de 9 cages consécutives. Voir la figure 1 de l'annexe 2.
- Après la présentation du premier rapport de suivi, le propriétaire de l'installation et le MPO ont le droit de modifier les transects de surveillance dans les cycles de surveillance ultérieurs afin de cibler la zone potentielle des répercussions.
Sites d'élevage de truites
Comme à T.-N.-L. l'aquaculture de la truite suit un cycle de production différent de celui de la salmoniculture (la truite est élevée chaque saison dans un site d'hivernage et un site de production ou de grossissement), l'application du présent protocole de surveillance pour les sites d'aquaculture de la truite saisonnière sera modifiée comme suit :
- La surveillance du milieu benthique ne sera nécessaire que sur les sites où l'on élève la truite pour les marchés, sites aussi connus sous le nom de sites de production.
- Il ne sera pas nécessaire que les sites d'hivernage (par exemple, sites de la baie Roti) effectuent une surveillance au moyen du protocole, mais ils seront assujettis à la capacité de charge et aux limites saisonnières figurant dans le plan de gestion de la baie Roti.
Modifications
Toute modification apportée au présent protocole de surveillance devra être effectuée de concert avec le groupe de travail du RAA.
Annexe 1 – Tableaux
Tableau 1 : Modèle de données d'observation vidéo de l'échantillonnage pour les sites à fond dur (type de substrat)
Ce tableau comporte 18 colonnes, sous les rubriques suivantes : Colonne 1 : Station; Colonne 2 : Cage; Colonne 3 : Transect (m); Colonne 4 : Latitude; Colonne 5 : Longitude; Colonne 6 : Profondeur (m); Colonne 7 : Qualité de la vidéo; Colonne 8 : No de figure; Les colonnes 9 à 17 sont regroupées sous la rubrique « Substrat »; Colonne 9 : Primaire/secondaire (<50 % dur/mou); Les colonnes 10 à 17 sont regroupées sous la sous-rubrique « Descriptions »; Colonne 10 : Paroi rocheuse verticale; Colonne 11 : Substrat rocheux continu; Colonne 12 : Blocs rocheux/moellons; Colonne 13 : Galets; Colonne 14 : Gravier/cailloux; Colonne 15 : Sable/boue; Colonne 16 : Matières organiques; Colonne 17 : Floc (pourcentage de couverture); Colonne 18 : Commentaires et observations
Station |
Cage |
Transect |
Latitude |
Longitude |
Profondeur |
Qualité de |
Numéro de la figure |
Substrat |
Commentaires et observations |
||||||||
Primaire/ secondaire (> 50 % dur/meuble) |
Descripteurs |
||||||||||||||||
Paroi rocheuse verticale |
Substrat rocheux continu |
Blocs et moellons |
Galets |
Gravier et cailloux |
Sable ou vase |
Matières organiques |
Floc (% de couverture) |
||||||||||
Tableau 2 : Modèle de données d'observation vidéo de l'échantillon pour les sites à fond dur (descripteurs benthiques)
Ce tableau comporte 20 colonnes, avec les en-têtes suivantes : Colonne 1 : Station; Colonne 2 : Cage; Colonne 3 : Transect (m); Colonne 4 : Latitude; Colonne 5 : Longitude; Colonne 6 : Profondeur (m); Colonne 7 : Qualité de la vidéo; Colonne 8 : No de figure; Les colonnes 9 à 12 sont regroupées sous l'en-tête « Indicateurs benthiques »; Colonne 9 : Beggiatoa (% de couverture); Colonne 10 : CPO; Colonne 11 : Type de CPO; Colonne 12 % de CPO; Les colonnes de 13 à 19 sont réunies sous la rubrique « Autres descriptions benthiques ou observations »; Colonne 13 : Dégagement gazeux; Colonne 14 : Alimentation; Colonne 15 : Débris de coquillages; Colonne 16 : Couleur des sédiments; Les colonnes 17 et 18 sont regroupées sous la sous-rubrique « flore (% de couverture) »; Colonne 17 : Algues cor; Colonne 18 : Autres*; Colonne 19 : Faune (abondance par groupe** [par exemple, anémones (2), étoiles de mer (1), spongiaires (1)]); Colonne 20 : Commentaires et observations
Station |
Cage |
Transect |
Latitude |
Longitude |
Profondeur |
Qualité de |
Numéro de la figure |
Indicateurs benthiques |
Autres descripteurs benthiques ou observations |
Commentaires et observations |
|||||||||
Beggiatoa |
CPO |
Stérile |
Dégagement |
Alimentation |
Débris de coquillages |
Couleur des sédiments |
Flore (% de couverture) |
Faune (abondance par groupe)** |
|||||||||||
Type |
% |
Algues cor. |
Autres* |
par exemple, anémones (2), étoiles de mer (1), spongiaires (1) |
|||||||||||||||
* Rhodophycées (algues rouges), chlorophycées (algues vertes), phéophycées (algues brunes, comme le varech)
** crabes, mains de mer, anémones, éponges, crinoïdes, oursins, étoiles de mer, ophiures, concombres de mer, autres (veuillez préciser)
Commentaires généraux sur le site : ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Rempli par : _______________________________________________
Date à laquelle le formulaire a été rempli : __________________________
Téléphone : __________________________
Annexe 2 – Figures
Tracé du site d'échantillonnage et renseignements connexes.
Ces figures indiquent comment schématiser la structure de confinement, en incluant les coordonnées du système de géolocalisation Global Positioning System (GPS), afin de représenter les endroits où les échantillons de sédiments doivent être prélevés. Le schéma catalogué doit également indiquer l'emplacement des infrastructures situées à proximité, qu'elles soient en mer ou à terre (quais, bouées, cabines, etc.).

Fournir un schéma catalogué et à l'échelle montrant :
– les cages et leur disposition;
– les intervalles de transect;
– le nord géographique;
– toute infrastructure à terre et en mer (quais, bouées, cabines, etc.).
Annexe 10 : Résumé des mesures requises
Le Règlement compte six articles (6, 8, 9, 12, 13 et 16) qui demandent au propriétaire ou à l'exploitant de prendre des mesures particulières. Cette annexe décrit les mesures requises et présente un schéma sommaire des processus subséquents, avec les échéances prévues. Les mesures à prendre en application des articles 6 et 13 sont liées, de sorte que le schéma est combiné. Les mesures à prendre pour les articles 8 et 9 sont les mêmes.
Article 6 : Le propriétaire ou l'exploitant doit aviser le Bureau régional de gestion de l’aquaculture (BRGA) au moins 72 heures avant le rejet ou l'immersion de produits antiparasitaires. L'avis doit comprendre les renseignements suivants :
- le nom du produit;
- la date et l'heure du rejet ou de l'immersion;
- le lieu du rejet ou de l'immersion, selon les coordonnées GPS ou leur équivalent.
L'avis doit se faire par courriel. Le propriétaire ou l'exploitant recevra un accusé de réception de l'avis. Si le propriétaire ou l'exploitant n'avise pas le Ministère, les agents des pêches du MPO informeront l'entreprise qu'elle est en situation d'infraction au Règlement.
Article 13 : Le propriétaire ou l'exploitant doit aviser immédiatement un agent des pêches de la présence inhabituelle de poissons morbides ou morts à l'extérieur de l'installation d'aquaculture (soit par l'entremise d'une inspection visuelle ou au moyen de caméras sous-marines) visibles de toute partie de l'installation dans les 96 heures suivant le rejet ou l'immersion par le propriétaire ou l'exploitant de toute drogue ou tout produit antiparasitaire mentionnés aux paragraphes 2a) ou b). L'avis doit comprendre les renseignements suivants :
- les coordonnées géographiques des poissons observés;
- le nombre estimé et, si on les connaît, les espèces de poisson observées;
- le nom de produit de la drogue ou du produit antiparasitaire immergé ou rejeté;
- la date du rejet ou de l'immersion.
Le signalement doit être fait en composant le numéro sans frais approprié (voir l'annexe 4). Le propriétaire ou l'exploitant recevra un accusé de réception de l'avis.
Dans le contexte d'un parc en filet, « à l'extérieur de l'installation » s'entend de l'extérieur de la zone délimitée par les ancres au fond de l'eau et de la zone correspondante en surface (voir schéma à l'article 13).
A la suite d’un rapport, le MPO procèdera à une opération scientifique de triage afin de déterminer si une directive en vertu de l’alinéa 36(6) de la Loi sur les pêchess’avère nécessaire. Les mesures comprises dans cette directive peuvent porter sur le prélèvement d'échantillons d'eau, de tissus et de sédiments dans la zone affectée, conformément aux lignes directrices sur l'échantillonnage aux fins de drogues et de produits antiparasitaires figurant à l'annexe 6.
La figure 1 (ci-dessous) intitulée « Processus de signalement des pesticides et d'observation subséquente de la morbidité/mortalité » illustre la relation qui existe entre l'avis de rejets de pesticides dans l'article 6(d), le signalement d'une mortalité ou morbidité inhabituelle [paragraphe 13(1)] dans les 96 heures suivant le rejet ou l'immersion d'un médicament ou un produit antiparasitaire, et les étapes qui doivent être entreprises [paragraphe 13(2)] si le processus de triage indique que l'événement a été causé par l’immersion ou le rejet.
La figure 1 est un organigramme illustrant le processus qui commence avec l'avis donné, 72 heures à l'avance, par le propriétaire ou l'exploitant au BRGA de l'intention de procéder à un rejet ou à une immersion. Le BRGA accuse réception de l'avis et informe la Direction de la conservation et de la protection de Pêches et Océans Canada du rejet ou de l'immersion ainsi que des préoccupations, le cas échéant. Conservation et protection ou le BRGA peuvent visiter le site afin de confirmer le rejet ou l'immersion. Si l'avis de 72 heures n'est pas fourni, Conservation et protection informera le propriétaire ou l'exploitant qu'il contrevient au Règlement. Si le propriétaire ou l'exploitant observe de la morbidité ou de la mortalité chez les populations de poissons sauvages à l'extérieur de l'installation, il doit informer un agent des pêches de Pêches et Océans Canada en appelant le numéro gratuit indiqué en annexe 4 et fournir les coordonnées géographiques de l'événement, l'estimation du nombre de poissons et les espèces, la date de l’immersion ou du rejet et le nom du produit immergé ou rejeté . Un accusé de réception sera délivré. Sur la base des renseignements fournis, le MPO effectuera un triage afin d'examiner la cause et d'évaluer la portée de la morbidité ou de la mortalité. À partir des résultats du triage, le BRGA collabore avec l'agent des pêches afin de déterminer si une enquête débordant du cadre du RAA est nécessaire. Si une enquête est justifiée, l'agent communique avec le propriétaire ou l'exploitant et émet une directive d'échantillonnage en vertu du paragraphe 36(6). Le propriétaire ou l'exploitant doit suivre les instructions contenues dans la directive. Le propriétaire ou l'exploitant doit présenter dans le rapport annuel les renseignements concernant tous les rejets ou immersions et tous les événements de morbidité ou de mortalité, le cas échéant.
Figure 1 : Processus de signalement des pesticides et d'observation subséquente de la morbidité ou de la mortalité

Articles 8 et 9 : Le propriétaire ou l'exploitant est tenu de soumettre des données de référence sur les nouveaux sites (article 8) et pour les applications qui entraîneraient une augmentation de la courbe prévue de l'empreinte de la DBO d'un site existant (article 9). L'information peut être transmise par courriel ou par la poste, et un accusé de réception sera envoyé.
- Données de base pour les nouveaux sites : présenter l'information au BRGA au moins 300 jours avant de procéder à un premier rejet de substances nocives (drogues, pesticides ou matières exerçant une DBO).
- Demandes touchant les contours de l'empreinte : envoyer les renseignements au BRGA dans les 30 jours suivant la date à laquelle la demande a été faite.
La figure 2, intitulée « Processus provincial typique d'attribution des sites » est un organigramme illustrant le début du processus par lequel l'industrie demande l'attribution d'un site, la mobilisation du public et la collecte de données sur les options par le demandeur, suivie du dépôt de la version définitive de la demande de permis d'aquaculture. La période de 300 jours débute à la réception de la demande dûment remplie. La période d'examen des sites est de six (6) mois, durant laquelle le MPO dispose de quatre à six mois pour donner son avis à la province. Une fois le bail ou le permis accordé par la province, l'industrie dispose d'une période de quatre à six mois pour installer l'équipement et les stocks de poissons.
Figure 2 : Processus provincial typique d'attribution des sites 
La figure 3, intitulée « Processus d'examen de 300 jours », illustre le processus d'examen des sites, à partir de la collecte d'information par le propriétaire ou l'exploitant et sa transmission au MPO (comme l'exige le Règlement) et à la province, au besoin, de la manière requise par le processus provincial de demande de bail. À ce stade, la demande est examinée en deux volets : par l'intermédiaire du MPO et par l'intermédiaire de la province. Du côté du MPO, le Bureau régional de gestion de l’aquaculture (BRGA) accuse réception de la demande et la fait suivre au Programme de protection des pêches, au Secteur des sciences et à Gestion des pêches. Le DGR transmet l'avis complet du MPO sur le choix des sites à la province, qui l'incorpore dans l'examen provincial de données de référence. À la conclusion de l'examen provincial, le propriétaire ou l'exploitant est informé de la décision de sélection.
Figure 3 : Processus d'examen de 300 jours

Article 12 : Les propriétaires et les exploitants sont tenus de surveiller les concentrations de sulfures dans les sédiments, que ce soit au moyen de l'échantillonnage du substrat (article 10) ou par la surveillance visuelle (article 11), afin d'évaluer les répercussions potentielles des matières organiques sur le milieu benthique. Si les limites de concentration spécifiées sont dépassées, le propriétaire ou l'exploitant doit aviser le Bureau régional de gestion de l’aquaculture dans les 14 jours suivant la date à laquelle les échantillons ont été prélevés ou la surveillance visuelle du substrat effectuée. Les renseignements doivent être transmis par courriel, et accusé de réception sera donné.
Article 16 : Toute personne détenant un permis d'aquaculture fédéral, provincial ou territorial pour une installation susceptible d'immerger ou de rejeter des substances nocives ou de causer des dommages graves aux poissons doit présenter un rapport annuel sur les activités de chaque site au cours de l'année civile. Ce rapport doit être déposé avant le 1er avril, ou trois mois après la fin de l'année faisant l'objet du rapport.
Ce rapport doit contenir tous les renseignements demandés à l'article 16 du Règlement (et énumérés dans le modèle de production de rapports à l'annexe 1). Bien que l'utilisation du Modèle de rapport ne soit pas obligatoire, elle est recommandée, car le modèle fournit une liste de contrôle pour tous les renseignements nécessaires pour le rapport annuel.
Annexe 11: Glossaire
- Activités
- Conduite d'activités d'élevage (c.-à-d., gestion et prise en charge des soins des animaux d'élevage).
- Aquaculture
- Élevage de poissons.
- Atténuation
- Mesures visant à réduire l'échelle spatiale, la durée ou l'intensité des effets nocifs sur les poissons et leur habitat qui ne peuvent être totalement évités.
- Autochtone (dans le cadre de la pêche)
- Pêche pratiquée par une organisation autochtone ou ses membres à des fins alimentaires, sociales ou rituelles, ou à des fins prévues dans un accord sur des revendications territoriales conclu avec l’organisation autochtone.
- Bathymétrie
- Mesure de la profondeur des océans, des mers ou d'autres plans d'eau importants, et données dérivées d'une telle mesure, notamment compilées sur une carte topographique.
- Beggiatoa (Espèces apparentées à)
- Bactéries qui forment des couches ou tapis visibles à la surface des fonds marins dans des zones d’enrichissement organique et qui peuvent appartenir au genre Beggiatoa, mais aussi à d’autres genres.
- Benthique/benthos
- Relatif au fond marin, éléments constitutifs du fond marin.
- Biomasse courante :
- Biomasse totale présente dans une installation d’aquaculture à un moment donné.
- Commerciale (dans le cadre de la pêche)
- Pêche pratiquée sous le régime d’un permis en vue de la vente, de l’échange ou du troc du poisson.
- Désinfectant
- Agent antimicrobien ayant le pouvoir de détruire des microorganismes pathogènes ou potentiellement pathogènes sur des surfaces de l’environnement et des objets inanimés.
- DGPS
- Système de de géolocalisation Global Positioning System représente une amélioration du système de géolocalisation par satellite GPS qui fournit un positionnement affiné, passant d’une précision de l’ordre de 15 m pour le GPS nominal à environ 10 cm dans les meilleurs cas de mise en œuvre.
- Dommages sérieux
- Mort de tout poisson ou modification permanente ou destruction de son habitat. Pour obtenir des renseignements plus détaillés, consultez l’énoncé de politique sur la protection des pêches.
- État oxique
- Se dit de la teneur en oxygène du sédiment. Plus il y a d'oxygène dans le sédiment, plus la biodiversité est grande. L'accumulation de matières organiques sur les sédiments peut réduire la quantité d'oxygène disponible pour la survie de l'espèce de poisson.
- Fond dur
- Substrat consistant en roches-mères, gros blocs/pierres ou d’infrastructures maritimes fixes comme les fondations de quais, pontons et oléoducs.
- Fond meuble
- Relatif à un cours d'eau, fond ou lit de cours d’eau composé de particules non agrégées, comme de l'argile, de la vase, du maërl, du sable, des galets, du gravier, des coquillages ou des pierres de petite taille.
- Habitat du poisson
- Frayères et autres zones, y compris les zones d'alevinage, d'élevage et d'alimentation et les routes migratoires dont dépend, directement ou indirectement, la survie des poissons.
- Installation d’aquaculture
- Emplacement où les activités d'aquaculture sont menées et qui comprend des parcs en filet, des passerelles, des barges, des structures flottantes, des réservoirs, des navires (bateaux viviers) et des logements pour le personnel ainsi que les lignes et les ancres connexes. L'équipement utilisé pour l'élevage, la manipulation ou le transport des poissons, ou le nettoyage (y compris le nettoyage des filets à l'extérieur du site) la désinfection et l'entretien des structures physiques de l'exploitation (sous contrat de location ou non) est considéré comme faisant partie de l'installation.
- Loi
- Loi sur les pêches.
- Matière exerçant une demande biochimique en oxygène (DBO)
- Toute matière organique qui contribue à la consommation d'oxygène dissous dans l'eau ou des sédiments.
- Morbidité
- Fait d'être malade ou en mauvaise santé.
- Norme
- Norme relative à la surveillance de l'aquaculture et ses versions modifiées qui sont produites par le ministre et tenues à jour sur le site Web de Pêches et Océans Canada.
- Parasite
- Tout insecte, champignon, organisme bactérien, virus, mauvaise herbe, rongeur, ou autre plante ou animal nuisibles ou pouvant causer des problèmes.
- Permis d'aquaculture
- L'un ou l'autre des éléments suivants :
- bail ou permis délivré ou accordé par le ministre en vertu de l'article 7 ou 58 de la Loi ou des règlements afférents à des fins d'aquaculture;
- bail pour l'ostréiculture consenti par le gouvernement d'une province en vertu du paragraphe 59(1) de la Loi;
- autorisation ou permis provincial d'exploitation d'une installation d’aquaculture.
- Pesticide ou produit antiparasitaire
- Tout produit, dispositif, organisme, substance, etc., qui est fabriqué, présenté, vendu ou utilisé comme moyen d'élimination directe ou indirecte, de contrôle, de prévention, de destruction, d'atténuation, d'attraction ou de répulsion lorsqu'il y a présence d'un organisme nuisible. Les produits antiparasitaires comprennent les matières actives utilisées pour la fabrication des préparations commerciales ainsi que ces dernières proprement dites. Cela comprend les herbicides, les insecticides, les fongicides, les agents antimicrobiens, les produits chimiques pour piscines, les agents microbiens, les agents de préservation pour le bois et les matériaux, les répulsifs pour animaux et insectes, les dispositifs de dératisation et d'élimination d'insectes.
- Poisson
- Comprend a) les parties du poisson, b) les mollusques, les crustacés, les animaux marins ainsi que leurs parties et c) les œufs, le sperme, la laitance, le frai, les larves, le naissain et les petits des poissons, mollusques, crustacés et animaux marins.
- Poissons dont dépendent les pêches
- Poissons qui contribuent à la productivité d'une pêche.
- Poissons qui font l'objet de pêches
- Poissons qui font l'objet d'une pêche commerciale, récréative ou autochtone (CRA).
- Propriétaire ou exploitant
- Toutes les personnes embauchées par l'installation d'aquaculture, que ce soit à temps plein, à temps partiel ou sous contrat.
- Récréative, dans le cadre de la pêche
- Pêche pratiquée sous le régime d’un permis à des fins personnelles ou sportives.
- Substance nocive
- (a) toute substance qui, si elle était ajoutée à l'eau, altérerait ou contribuerait à altérer la qualité de celle-ci au point de la rendre nocive pour le poisson ou son habitat, ou pour l'homme qui consomme du poisson fréquentant cette eau;
(b) toute eau qui contient une substance en quantité ou concentration telles, ou qui a été traitée, transformée ou modifiée, par la chaleur ou d'autres moyens, à partir d'un état naturel, de façon telle que, si elle était ajoutée à l'eau, elle altérerait ou contribuerait à altérer la qualité de celle-ci au point de la rendre nocive pour le poisson ou son habitat, ou pour l'homme qui consomme du poisson fréquentant cette eau. - Substrat stérile
- Stations d’échantillonnage dépourvues de tout organisme visible en raison d’un enrichissement organique provenant des immersions ou rejets d’activités aquacoles dont l’effet se traduit par des conditions d’hypoxie ou d’anoxie incompatibles avec la présence d’organismes vivants, incluant les organismes indicateurs d’enrichissement organique. Cette définition exclut les stations qui étaient stériles avant que ne se développe une activité aquacole.
- Surveillance de base
- Échantillonnage d’une zone de référence qui n’a pas servi préalablement à la production de poissons à nageoires.
- Date de modification :
