Marteilioides chungmuensis de l'huître
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Marteilioides des ovocytes
Nom scientifique ou classification taxonomique
Le parasite Marteilioides chungmuensis (Comps et al. 1987) initialement associé au phylum Paramyxea, (Desportes et Perkins 1990, Berthe et al. 2000), était transféré au phylum Cercozoa et à l'ordre des Paramyxida (Cavalier-Smith et Chao 2003, Feist et al. 2009). Pendant leur révision de l'ordre des Paramyxida, Feist et al. (2009) ont proposé que le genre Marteilioides Comps, Park et Desportes (1986) soit supprimé et que l'espèce type du genre, M. chungmuensis Comps, Park et Desportes (1986) chez les huîtres de la Corée et du Japon, soit transférée à Marteilia. Cette proposition a été appuyée par Itoh et al. (2014), Carrasco et al. (2015) et Alfjorden et al. (2017). Néanmoins, Ward et al. (2016) ont proposé de conserver ce parasite dans le genre Marteilioides afin d'éviter que le genre Marteilia ne soit dit paraphylétique d'après l'analyse moléculaire de l'ADNr du gène 18S de M. chungmuensis par rapport à d'autres espèces des lignées des Paramyxea. Comme l'ont proposé Ward et al. (2016), le nom du genre Marteilioides sera conservé sur cette page Web. Le genre a été défini par Anderson et Lester (1992), qui ont indiqué que les stades végétatifs montraient une cellule amiboïde primaire ayant subi un clivage interne pour former des cellules secondaires (sporontes), et une sporulation composée des cellules secondaires qui produisent une unique spore pluricellulaire, qui dégénère ensuite de sorte que le résidu cytoplasmique et la plasmalemme du cellule secondaire enveloppent la spore. Certaines infections décrites comme des « Maladies de l'œuf d'huître » peuvent être imputées à M. chungmuensis. Après l'analyse phylogénétique de la séquence d'ADNr 18S du parasite Marteilioides sp. provenant des myes Ruditapes philippinarum prélevées sur la côte sud de la Corée, Yanin et al. (2013) ont suggéré que ce parasite n'était pas la même espèce que M. chungmuensis.
Répartition géographique
Le parasite Marteilioides chungmuensis dans les huîtres a été signalé sur les côtes sud et ouest de la péninsule coréenne, en Corée (Park et Chun 1989, Yanin et al. 2013) et il a été largement détecté dans les eaux japonaises (Comps et al. 1986, Itoh et al. 2002a). Le parasite Marteilioides sp. a été signalé dans les ovocytes de Ruditapes (= Tapes) philippinarum des régions côtières du sud de la Corée (Lee et al. 2001, Yanin et al. 2013) et dans les ovocytes de Ruditapes (= Venerupis) philippinarum d'Iwakuni, dans la préfecture de Yamaguchi, au Japon (Itoh et al. 2005).
Espèces hôtes
Crassostrea gigas. Également chez Crassostrea nippona transplantées sur une zone enzootique du Japon (Itoh et al. 2004a) et chez Crassostrea ariakensis de la côte sud de la Corée (Yanin et al. 2013). Un parasite similaire avait été signalé dans les ovules de Crassostrea echinata, dans les territoires du nord de l'Australie (Wolf 1977) et en Australie-Occidentale (Hine et Thorne 2000). Des parasites s'apparentant au parasite Marteilioides ont également été signalés à une prévalence faible (1,6 %) dans les ovocytes des palourdes japonaises, Ruditapes(= Tapes ) philippinarum, de la côte sud de la Corée (Lee et al. 2001, Yanin et al. 2013) etdans les ovocytes d'un individu sur 40 Ruditapes (= Venerupis) philippinarum provenant d'Iwakuni, dans la préfecture de Yamaguchi, au Japon (Itoh et al. 2005).
Impact sur les hôtes
La présence des masses anormales d'œufs ayant un aspect nodulaire (ressemblant à de multiples tumeurs) a été observée pour la première fois dans les cultures de Crassostrea gigas dans la préfecture de Hiroshima, au Japon, dans les années 1930. Des enquêtes menées dans la baie de Matsushima au Japon, au début des années 1960, ont révélé des prévalences jusqu'à 46,2 %, mais l'intensité de l'infection était généralement faible (Imai et al. 1968). En 1974, Matsuzato et al. (1977) ont détecté un parasite dans les ovules d'huîtres anormales de la préfecture d'Hiroshima, où le pourcentage d'huîtres touchées variait de 0 à 12 %. En Corée, le parasite M. chungmuensis a été signalé pour la première fois en 1970. Chun (1979), qui avait qualifié le parasite d'amibe énigmatique, signala une prévalence d'infection de 13,3 % dans la région coréenne de Hansan en 1978 et 1979. Park et Chun (1986), ayant identifié ce parasite comme étant Marteilia sp., ont détecté une faible prévalence (0,6 %) dans deux fermes ostréicoles; par contre, au cours d'une étude menée sur 30 huîtres provenant de deux fermes distinctes tous les mois pendant 1 an, le parasite n'a été détecté dans aucune des fermes. À la fin des années 1980, Elston (1993) a signalé des prévalences d'infection allant jusqu'à 8,3 %. Apparemment, la prévalence de l'infection en Corée a continué d'augmenter et le parasite M. chungmuensis a été impliqué comme une des raisons de la faible collecte de naissains et de la mortalité massive chez les huîtres d'élevage depuis 1990 (Parc 2005). De plus, le phénomène s'est étendu de la saison de ponte (fin de l'été-début de l'automne) à toute l'année avec la plus forte prévalence pendant le frai (de juin à août) et pendant la période de régénération gonadique (de septembre à octobre) (Parc 2002, 2005, Park et al. 2003). Tun et al. (2007) ont constaté que les huîtres femelles infectées produisaient des ovocytes de façon continue et se reproduisaient à plusieurs reprises d'octobre à mars, période durant laquelle les huîtres saines étaient reproductivement inactives. Ils ont donc conclu que M. chungmuensis allongeait la période de reproduction des huîtres infectées pour son propre avantage reproductif. Cette activité de reproduction prolongée des huîtres infectées a eu pour conséquence un gaspillage alimentaire et des mortalités chez les huîtres infectées, entraînant un déclin de la prévalence de l'infection au sein de la zone d'épizootie en automne. Déclin qui s'est poursuivi en hiver, en raison de la guérison de l'infection (Tun et al. 2008a).
Marteilioides chungmuensis infecte le cytoplasme des ovocytes et peut toucher de grandes zones des follicules de reproduction, entraînant un élargissement irrégulier des tissus gonadaux infectés. Des observations histologiques indiquent que M. chungmuensis envahit des ovules immatures qui se déplacent vers le centre du follicule et que la croissance du parasite est hautement corrélée avec la croissance et la maturation des cellules gonadales hôtes (Itoh et al. 2002a). Les œufs infectés peuvent être expulsés par le canal génital ou retenus dans le follicule ovarien. Ce parasite peut avoir un effet important sur l'efficacité de la reproduction d'une huître femelle infectée. l'infection peut également nuire à la reproduction, en la retardant et en détruisant les ovocytes matures des huîtres (Ngo et al. 2003). Par ailleurs, l'infection a réduit de manière significative les concentrations de glycogène et de protéines sériques, affectant le rétablissement métabolique après la reproduction (Park et al. 2003, Park 2005). Du fait de leur aspect peu esthétique, les C. gigas infectées perdent leur potentiel commercial, entraînant ainsi de sérieuses pertes économiques pour les ostréiculteurs (Meyers 2006). Les espèces Crassostrea nippona et Crassostrea ariakensis infectées par le parasite M. chungmuensis n'ont pas présenté des nodules apparents sur le manteau ou d'autres signes cliniques notables et ce parasite pourrait ne pas avoir un effet négatif sur l'élevage de ces espèces d'huîtres (Itoh et al. 2004a; Yanin et al. 2013).
L'huître Crassostrea gigas placée en août dans une zone enzootique pour M. chungmuensis (préfecture d'Okayama, au Japon) a développé des signes macroscopiques de la maladie en un mois (Itoh et al. 2004b). Dans cette zone, Tun et al. (2008b) ont indiqué que la prévalence de l'infection détectée par la réaction en chaîne de la polymérase (PCR, voir ci-dessous) était de l'ordre de 70 % ou plus d'août à octobre, mais qu'elle avait fortement diminué en novembre pour atteindre 7 % ou moins de février à avril. Néanmoins, le fait de transférer les huîtres dans une eau de mer chaude (de 8 à 10 °C au niveau enzootique à 24 °C dans les réservoirs expérimentaux exempts de M. chungmuensis ) a augmenté la prévalence de l'infection qui est passée de 7 à 87 % environ en trois semaines. De fait, la faible prévalence en hiver était imputable à la réplication insuffisante de M. chungmuensis dans une eau de mer à basses températures, rendant ainsi les niveaux indétectables par PCR par amorces incluses, et non à l'absence d'invasion (Tun et al. 2008b).
On ne dispose pas d'information fondamentale relative au cycle de vie complet de ce parasite, notamment à son mode de transmission (Itoh et al. 2002b). Cependant, Itoh et al. (2004b) ont utilisé des sondes à ADN propres au parasite et la microscopie électronique afin de révéler la voie d'infection et d'identifier les stades infectieux précoces et de multiplication chez l'huître (figure A1). En résumé, le parasite envahit l'huître à travers les tissus épithéliaux des branchies, le manteau et les palpes labiaux. La multiplication extrasporogonique des cellules primaires survient régulièrement en dehors des cellules hôtes par fission binaire dans le tissu conjonctif. De même, le clivage interne au sein de la cellule primaire a entraîné la production de cellules secondaires qui, parfois, contiennent une cellule tertiaire. Apparemment, la cellule secondaire, libérée depuis la cellule primaire, migre à travers l'épithélium de la gonade et envahit un ovocyte immature où elle forme la cellule primaire (cellule souche) du stade sporogonique. Les stades sporogoniques n'ont été observés qu'à l'intérieur des ovocytes de l'hôte (comme présenté ci-après).
Choi et al. (2011) ont comparé les hémocytes des C. gigas infectées par M. chungmuensis avec ceux de C. gigas semblant être en bonne santé, à l'aide d'un cytomètre en flux et ils ont déterminé que le nombre total d'hémocytes, surtout les granulocytes, avait considérablement augmenté et que le nombre d'hyalinocytes avait grandement diminué chez les huîtres infectées. Bien que la viabilité des hémocytes ne diffère pas entre les huîtres infectées et les huîtres d'apparence normale, le taux de phagocytose était beaucoup plus élevé chez les huîtres infectées (Choi et al. 2011).
Des parasites s'apparentant à Marteilioides ont été détectés chez 1,6 % des myes (R. philippinarum) examinées provenant de la Corée de mars 1996 à avril 1997 (Lee et al. 2001) et chez seulement une sur 40 R. philippinarum échantillonnées provenant du Japon en septembre 2003 (Itoh et al. 2005). Bien que divers stades de développement et des spores matures aient été observés dans les ovocytes, les myes infectées ne présentaient aucune apparence anormale et aucune réponse de l'hôte, comme l'infiltration des hémocytes et la phagocytose, était observée (Lee et al. 2001, Itoh et al. 2005, Yanin et al. 2013). Cependant, comme chez les C. gigas infectées par M. chungmuensis, Itoh et al. (2005) ont émis l'hypothèse selon laquelle il est possible que les infections par Marteilioides sp. chez les R. philippinarum fassent diminuer la fécondité de la mye et qu'elles provoquent donc une réduction des ressources.
Itoh et al. (2004b) ont identifié les stades extrasporogoniques chez les C. gigas mâles, mais la sporulation chez les huîtres mâles n'a pas été confirmée. Même si la prévalence de l'infection détectée par PCR après 4 semaines d'exposition dans une zone enzootique s'est avérée identique chez les huîtres femelles et mâles (environ 60 %), la prévalence chez les mâles a décliné dans les trois autres prélèvements hebdomadaires (baisse jusqu'à 24 %), tandis que celle des femelles est restée constamment élevée (plus de 60 %). Itoh et al. (2004b) ont suggéré que M. chungmuensis peut être exclu des huîtres mâles sans commencer de sporulation.
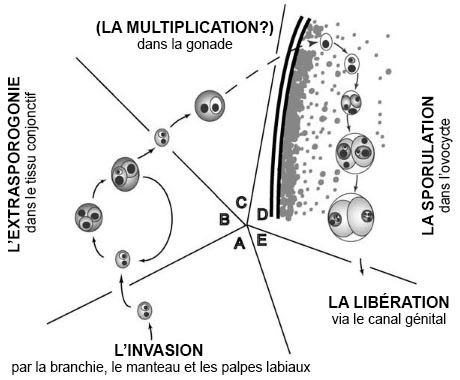
L'image a été modifiée par rapport à l'original pour la traduction française.
Figure A1. Cycle de développement de Marteilioides chungmuensis chez les Crassostrea gigas, proposé par Itoh et al. (2004b) et reproduit de l'International Journal for Parasitology 34:1134. Un stade infectieux non identifié envahit les tissus épithéliaux des branchies, le manteau et les palpes labiaux. Une extrasporogonie intercellulaire survient dans les tissus conjonctifs, entraînant la production de cellules secondaires qui viennent envahir l'épithélium de la gonade (B). Un grossissement et une multiplication des cellules secondaires peuvent également se développer entre les cellules de l'épithélium de la gonade (C). Les cellules secondaires envahissent un ovocyte, se transforment en cellules primaires (cellules souches), et la sporulation commence (D). l'huître relâche les spores matures par le canal génital (E).
Techniques de diagnostic
Observations générales
Distensions semblables à des tumeurs (nodules focaux) des tissus du manteau des C. gigas gravement infectées (Yanin et al. 2013). Cependant, aucun symptôme pathologique remarquable, comme plusieurs grosses masses sur le manteau, n'a été observé chez les espèces C. nippona (Itoh et al. 2004a), C. ariakensis ou R. philippinarum (Itoh et al. 2005, Yanin et al. 2013) infectées.

Figure 1a. Aspect d'une huître du Pacifique, Crassostrea gigas, infectée par Crassostrea gigas. Remarquez les structures semblables à des nodules (indiquées par des pointes de flèche) sur les tissus mous. Image fournie par N. Itoh.

Figure 1b. Larges nodules sur la surface des tissus mous de C. gigas causés par une infection à M. chungmuensis. Image fournie par Mi Seon Park lorsqu'elle était à la division de la pathologie, au National Fisheries Research and Development Institute (NFRDI), 408-1, Silang-ri, Kitang-up, Kitang-gum, Pusan 619-900, République de Corée.
Frottis
Les frottis séchés de nodules (gonades infectées) colorés avec la coloration de Wright, Wright-Giemsa ou une coloration équivalente (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter) permettent de détecter rapidement les stades de développement au sein et hors des ovules. La forme habituelle de M. chungmuensis dans les ovocytes matures des huîtres consiste en deux cellules secondaires (sporontes) contenant chacun une spore en développement, dans laquelle dégénère des cellules primaires (cellules souches). Cependant, des cellules primaires contenant de trois à six cellules secondaires (chacun contenant une spore en développement) ont été observées, mais demeurent rares (Imanaka et al. 2001).

Figure 2. Frottis de tissus gonadaux de Crassostrea gigas infectés par Marteilioides chungmuensis. Quatre M. chungmuensis sont présents dans les ovules intacts de C. gigas(en haut de l'image) tandis que les autres (flèches) sont libérés de leurs ovules hôtes au cours de la préparation des frottis. Coloration Diff QuiK.

Figure 3. Grossissement de deux ovules de la figure 2. Dégénérescence des cellules secondaires (souches) (P) situées à côté des noyaux (HN) des ovules (cellule hôte). Chaque cellule primaires contient deux cellules secondaires (sporontes) avec un noyau (SN) et une spore en développement (SP). Il convient de noter que la coloration des spores en développement est trop forte pour apercevoir la nature tricellulaire de la spore. Coloration Diff-Quik.
Histologie
Dans l'ovaire de l'hôte, cellules primaires (souches) contenant une à trois (habituellement deux) cellules secondaires (sporocystes), résultat d'un bourgeonnement endogène à l'intérieur du cytoplasme des ovules et des ovocytes infectés. Dans chaque cellule secondaire, une cellule tertiaire se forme par bourgeonnement exogène. La cellule tertiaire devient une spore tricellulaire grâce à un clivage interne endogènement (développement caractéristique d'une « cellule dans une cellule »). Itoh et al. (2003b), Tun et al. (2008b), Choi et al. (2012) et Yanin et al. (2013) ont déterminé que les examens histologiques étaient moins sensibles pour détecter des infections par M. chungmuensis que les essais moléculaires (PCR et hybridation in situ). L'histologie semble être une technique moins sensible lorsque les infections par le parasite sont faibles, chez les huîtres mâles ou femelles lorsque les ovocytes sont immatures (Choi et al. 2012). Une espèce apparentée, Marteilioides branchialis, provenant des branchies de Saccostrea glomerata (=commercialis), dispose de deux à six, et quelquefois jusqu'à 12 cellules secondaires dans chacune des cellules primaires. Chaque spore est bicellulaire (deux cellules, l'une dans l'autre, dans chaque spore) (Anderson et Lester 1992).

Figure 4. Restes d'un follicule ovarien de Crassostrea gigas rempli d'ovules déformés contenant Marteilioides chungmuensis. Trois cellules secondaires sont apparus dans le cytoplasme en dégénérescence de la cellule primaire chez certains ovules (3S) et des spores en développement (SP) sont évidentes dans certains cellules secondaires. Dans la plupart des cas, les noyaux des ovules infectés (HN) sont comprimés par le parasite. Coloration à l'hématoxyline et à l'éosine.

Figure 5. Marteilioides chungmuensis compressant le noyau des ovules (HN) de Crassostrea gigas. La cellule primaire du parasite s'est désagrégée et apparaît comme une vacuole autour des deux cellules secondaires, qui contiennent chacun des spores en développement (SP). Une cellule primaire immature (P) est visible dans un ovocyte adjacent. Coloration à l'hématoxyline et à l'éosine.
Microscope électronique
Un examen de l'ultra-structure est nécessaire afin d'identifier la nature tricellulaire de la spore (Comps et al. 1987). A l'intérieur des œufs de C. gigas, la cellule primaire (souche) produit habituellement deux cellules secondaires par bourgeonnement endogène et, à l'intérieur de chaque cellule secondaire, une cellule tertiaire se développe et mûrit en une spore contenant trois cellules produites par clivage interne consécutif (« cellule dans une cellule »). Park et Chun (1989) ont indiqué que la cellule secondaire contient des haplosporosomes, la cellule externe de la spore contient des corps osmophiles liés à la membrane et la cellule intermédiaire et la cellule interne contiennent des ribosomes cytoplasmiques de densité élevée.
Les caractéristiques ultrastructurelles du parasite Marteilioides sp. chez les R. philippinarum étaient identiques à celles du parasite M. chungmuensis chez les C. gigas, comme l'ont signalé Comps et al. (1986) et Itoh et al. (2002a). Ces caractéristiques du parasite mature comprennent deux cellules secondaires dans une cellule primaire, une spore dans chaque cellule secondaire, chaque spore étant constituée d'une cellule externe et de deux cellules internes, et des haplosporosomes opaques aux électrons y sont contenus (Itoh et al. 2005). Ainsi, Itoh et al. (2005) ont suggéré qu'il était fort possible que le parasite Marteilioides sp. chez les R. philippinarum du Japon soit identique à M. chungmuensis.

Figure 6. Stade de développement précoce de Marteilioides chungmuensis (M) adjacent au noyau (N) de la cellule hôte (ovule) dans la gonade de Crassostrea gigas. Image fournie par Mi Seon Park lorsqu'elle était à la division de la pathologie, au National Fisheries Research and Development Institute (NFRDI), 408-1, Silang-ri, Kitang-up, Kitang-gum, Pusan 619-900, République de Corée.

Figure 7. Les ovules de Crassostrea gigas contiennent deux cellules souches de Marteilioides chungmuensis adjacentes à leurs noyaux (N). Le cytoplasme des deux cellules souches se désintègre, mais la cellule souche à droite dispose de deux cellules secondaires (Sp) tandis que celle de gauche en a exceptionnellement cinq cellules secondaires, dont deux produisent des spores (Sp*). Image fournie par Mi Seon Park lorsqu'elle était à la division de la pathologie, au National Fisheries Research and Development Institute (NFRDI), 408-1, Silang-ri, Kitang-up, Kitang-gum, Pusan 619-900, République de Corée.
Sondes à ADN
Une séquence partielle de l'ADN ribosomique (ADNr) de la petite sous-unité 18S (environ 1 200 paires de bases répertoriées par le numéro d'accès GenBank AB089819) a été identifiée à partir des cellules secondaires (sporontes) isolés des huîtres infectées à l'aide d'une procédure de congélation-décongélation et d'une centrifugation différentielle sur gradients discontinus de Percoll–sucrose (Itoh et al. 2003a). La séquence a été utilisée pour concevoir trois sondes propres à M. chungmuensis (Itoh et al. 2002b, 2003a). Les sondes ADN ont détecté les cellules parasites par hybridation in situ et ont servi à définir le cycle de vie de M. chungmuensis (Itoh et al. 2004b). Deux ensembles d'amorces spécifiques ont été développés dans une réaction en chaîne de la polymérase (PCR) par amorces incluses dont la sensibilité à détecter M. chungmuensis s'est révélée nettement supérieure à celles des techniques histologiques et d'observations macroscopiques traditionnelles (Itoh et al. 2003b; Tun et al. 2008b; Yanin et al. 2013). Par la suite, la totalité de la séquence d'ADNr 18S a été déposée dans GenBank (numéro d'accès AB110795) et a été utilisée pour développer des sondes supplémentaires pour la détection moléculaire de M. chungmuensis (Choi et al. 2012) et pour déterminer la position phylogénétique de ce parasite (Itoh et al. 2002b, 2003a; Ward et al. 2016). Les essais de la réaction en chaîne de la polymérase et d'hybridation in situ décrits par Choi et al. (2012) étaient aussi plus sensibles pour détecter M. chungmuensis par rapport aux techniques histologiques traditionnelles).


Figures 8 et 9. Hybridation in situ des stades sporogènes immatures (pointes de flèches) et des spores matures (flèches à la figure 9) de Marteilioides chungmuensis dans l'ovaire des Crassostrea gigas. Les images proviennent du journal Disease of Aquatic Organism sous la publication d'Itoh et al. (2003a).
Yanin et al. (2013) ont identifié la séquence d'ADNr 18S de Marteilioides sp. chez les R. philippinarumen Corée. D'après l'analyse BLAST et un calcul des similarités quant à la distance entre les nucléotides appariés, Yanin et al. (2013) ont indiqué que le parasite Marteilioides infectant les R. philippinarum était génétiquement différent des parasites infectant les C. gigas et ils ont suggéré qu'il s'agissait d'une espèce différente de Marteilioides.
Méthodes de contrôle
On ne connaît pas de méthode de prévention. Les huîtres infectées ne doivent pas être transportées dans des zones exemptes de la maladie. Au Japon, la prévalence de l'infection a augmenté en été, ce qui donne à penser que la multiplication active du parasite survient au cours des mois où l'eau est chaude (Imanaka et al. 2001). Tun et al. (2006) ont indiqué qu'une prévalence moindre de l'infection avait été détectée chez les huîtres de la zone intertidale (avec, en moyenne, une immersion dans l'eau de mer de 6 heures par jour). Néanmoins, ils ont déterminé que la baisse de la prévalence chez les huîtres intertidales n'était pas imputable à une exposition à court terme à l'invasion de parasites, mais bien à des facteurs de diminution de la population féminine. En effet, la formation de spore de M. chungmuensis (et des pathologies associées) survient uniquement chez les huîtres femelles (Tun et al. 2006). Le NFRDI (National Fisheries Research and Development Institute) de Corée recommande que l'industrie de l'ostréiculture des zones infectées élève des huîtres triploïdes, qui ne sont pas sujettes à l'infection par le parasite (Park 2005).
Références
- Alfjorden, A., M. Areskog, D. Bruno, R. Carnegie, D. Cheslett, S. Feist, S. Ford, S. Jones, A. Lillehaug, L. Madsen, T. Renault, N. Ruane et P. Vennerström. 2017. New Trends in Important Diseases Affecting the Culture of Fish and Molluscs in the ICES Area 2002 – 2015. In: Anderson, E.D., N. Ruane, R. Carnegie (eds.) ICES Cooperative Research Report No. 337, International Council for the Exploration of the Sea, Conseil International pour l'Exploration de la Mer, Copenhagen, Denmark. 50 pp.
- Anderson, T.J. et R.J.G. Lester. 1992. Sporulation of Marteilioides branchialis n.sp. (Paramyxea) in the Sydney rock oyster, Saccostrea commercialis: an electron microscope study. Journal of Protozoology 39: 502-508.
- Berthe, F.C.J., F. Le Roux, E. Peyretaillade, P. Peyret, D. Rodriguez, M. Gouy et C.P. Vivares. 2000. Phylogenetic analysis of the small subunit ribosomal RNA of Marteilia refringens validates the existence of Phylum Paramyxea (Desportes and Perkins 1990). The Journal of Eukaryotic Microbiology 47: 288-293.
- Bondad-Reantaso, M.G., S.E. McGladdery, I. East et R.P. Subasinghe (eds). 2001. Asia Diagnostic Guide to Aquatic Animal Diseases. FAO Fisheries Technical Paper 402 Supplement 2. Food and Agriculture Organisation of the United Nations and Network of Aquaculture Centres in Asia-Pacific, Rome. Pg. 144-146.
- Carrasco, N., T.J. Green et N. Itoh. 2015. Marteilia spp. parasites in bivalves: A revision of recent studies. Journal of Invertebrate Pathology 131: 43-57.
- Choi, H.J., J.Y. Hwang, D.L. Choi, M.D. Huh, Y.B. Hur, N.-S. Lee, J.S. Seo, M.G. Kwon, H.-S. Choi et M.A. Park. 2011. Non-specific defensive factors of the Pacific oyster Crassostrea gigas against infection with Marteilioides chungmuensis: a flow-cytometric study. Korean Journal of Parasitology 49: 229-234.
- Choi, H.J., J.Y. Hwang, D.L. Choi, M.D. Huh et M.A. Park. 2012. A study of diagnostic methods for Marteilioides chungmuensis infections in the Pacific oyster Crassostrea gigas. Journal of Invertebrate Pathology 111: 27-32.
- Chun, S.-K. 1979. Amoeba infection in oyster (Crassostrea gigas). Bulletin of the Korean Fisheries Society 12: 281-285.
- Comps, M., M.S. Park et I. Desportes. 1986. Etude ultrastructurale de Marteilioides chungmuensis n.g. n.sp., parasite des ovocytes de l'huître Crassostrea gigas Th. Protistologica 22: 279-285.
- Comps, M., M.S. Park et I. Desportes. 1987. Fine structure of Marteilioides chungmuensis n.g. n.sp., parasite of the oocytes of the oyster Crassostrea gigas. Aquaculture 67: 264-265.
- Desportes, I. et F.O. Perkins. 1990. Phylum Paramyxea. In: Margulis, L., J.O. Corliss, M. Melkonian and D.J. Chapman (eds), Handbook of Protoctista. Jones and Bartlett Publishers, Boston, MA. Pg. 30-35.
- Elston, R.A. 1993. Infectious diseases of the Pacific oyster Crassostrea gigas. Annual Review of Fish Diseases 3: 259-276.
- Hine, P.M. et T. Thorne. 2000. A survey of some parasites and diseases of several species of bivalve mollusc in northern Western Australia. Diseases of Aquatic Organisms 40: 67-78.
- Imai, T., K. Mori, Y. Sugawara, H. Tamate, J. Oizumi et O. Itakawa. 1968. Studies on the mass mortality of oysters in Matsushima Bay VII. Pathogenetic investigation. Tohoku Journal of Agricultural Research 19: 250-265.
- Imanaka, S., N. Itoh, K. Ogawa et H. Wakabayashi. 2001. Seasonal fluctuations in the occurrence of abnormal enlargement of the ovary of Pacific oyster Crassostrea gigas at Gokasho Bay, Mie, Japan. Fish Pathology (Tokyo) 36: 83-91.
- Itoh, N., T. Oda, K. Ogawa et H. Wakabayashi. 2002a. Identification and development of a paramyxean ovarian parasite in the Pacific oyster Crassostrea gigas. Fish Pathology (Tokyo) 37: 23-28.
- Itoh, N., T. Oda et K. Ogawa 2002b. Marteilioides chungmuensis (Paramyxea), an intracellular parasite of the ovocyte of Pacific oyster Crassostrea gigas: isolation and sequencing of small subunit ribosomal DNA. Handbook and Abstracts, Fifth Symposium on Diseases in Asian Aquaculture, Queensland, Australia, 24-28 November 2002. Pg. 97.
- Itoh, N., T. Oda, T. Yoshinaga et K. Ogawa. 2003a. Isolation and 18S ribosomal DNA gene sequence of Marteilioides chungmuensis (Paramyxea), an ovarian parasite of the Pacific oyster Crassostrea gigas. Diseases of Aquatic Organisms 54: 163-169.
- Itoh, N., T. Oda, T. Yoshinaga et K. Ogawa. 2003b. DNA probes for detection of Marteilioides chungmuensis from the ovary of Pacific oyster Crassostrea gigas. Fish Pathology (Tokyo) 38: 163-169.
- Itoh, N., K.L. Tun, H. Komiyama, N. Ueki et K. Ogawa. 2004a. An ovarian infection in the Iwagaki oyster, Crassostrea nippona, with the protozoan parasite Marteilioides chungmuensis. Journal of Fish Diseases 27: 311-314.
- Itoh, N., H. Komiyama, N. Ueki et K. Orawa. 2004b. Early developmental stages of a protozoan parasite, Marteilioides chungmuensis (Paramyxea), the causative agent of the ovary enlargement disease in the Pacific oyster, Crassostrea gigas. International Journal for Parasitology 34: 1129-1135.
- Itoh, N., K. Momoyama et K. Ogawa. 2005. First report of three protozoan parasites (a haplosporidian, Marteilia sp. and Marteilioides sp.) from the Manila clam, Venerupis (=Ruditapes) philippinarum in Japan. Journal of Invertebrate Pathology 88: 201-206.
- Itoh, N., T. Yamamoto, H.-S. Kang, K.-S. Choi, T.J. Green, N. Carrasco, M. Awaji et S. Chow. 2014. A novel paramyxean parasite, Marteilia granula sp. nov. (Cercozoa), from the digestive gland of Manila clam Ruditapes philippinarum in Japan. Fish Pathology 49: 181-193.
- Lee, M.-K., B.-Y. Cho, S.-J. Lee, J.-Y. Kang, H.D. Jeong, S.H. Huh et M.-D. Huh. 2001. Histopathologucal lesions of Manila clam, Tapes philippinarum, from Hadong and Namhae coastal areas of Korea. Aquaculture 201: 199-209.
- Matsusato, T. et K. Masumura. 1981. Abnormal enlargement of the ovary of oyster, Crassostrea gigas (Thunberg) by an unidentified parasite. Fish Pathology (Tokyo) 15: 207-212.
- Matsuzato, T., T. Hoshina, K.Y. Arakawa et K. Masumura. 1977. Studies on the so-called abnormal egg-mass of Japanese oyster, Crassostrea gigas (Thunberg) - I. Distribution of the oyster collected in the coast of Hiroshime Pref., and parasite in the egg-cell. Bulletin of the Hiroshima Fisheries Experimental Station 8: 9-25.
- Meyers, T. 2006. 5.2.9 Marteiliasis and marteilioidiasis of shellfish, In: Fish Health Section Blue Book, 2014 Edition, Suggested Procedures for the Detection and Identification of Certain Finfish and Shellfish Pathogens. American Fisheries Society's Fish Health Section.
- Ngo, T.T.T., F.C.J. Berthe et K.-S. Choi. 2003. Prevalence and infection intensity of the ovarian parasite Marteilioides chungmuensis during an annual reproductive cycle of the oyster Crassostrea gigas. Diseases of Aquatic Organisms 56: 259-267.
- Park, M.S. 2002. Survey on the ovarian parasite, Marteilioides chungmuensis in the cultured Pacific oysters Crassostrea gigas in Korea. Handbook and Abstracts, Fifth Symposium on Diseases in Asian Aquaculture, Queensland, Australia, 24-28 November 2002. Pg. 96.
- Park, M.S. 2005. Survey on the ovarian parasite, Marteilioides chungmuensis in the culture Pacific oyster, Crassostrea gigas in Korea. In: Walker, P.J., R.G. Lester, M.G. Bondad-Reantaso (eds.) Diseases in Asian Aquaculture V. Proceedings of the 5th Symposium on Diseases in Asian Aquaculture. Fish Health Section, Asian Fisheries Society, Manila. pp. 311-320.
- Park, M.S. et S.K. Chun. 1986. On the Marteilia sp. infection in the oyster, Crassostrea gigas (Thunberg). Bulletin of Fisheries Research and Development Agency 39: 105-109.
- Park, M.-S. et S.-K. Chun. 1989. Study on Marteilioides chungmuensis Comps et al. 1986, parasite of the Pacific oyster, Crassostrea gigas Thunberg. Journal of Fish Pathology 2: 53-70.
- Park, M.S., C.-K. Kang, D.-L. Choi et B.-Y. Jee. 2003. Appearance and pathogenicity of ovarian parasite Marteilioides chungmuensis in the farmed Pacific oysters, Crassostrea gigas, in Korea. Journal of Shellfish Research 22: 475-479.
- Tun, K.L., N. Itoh, H. Komiyama, N. Ueki, T. Yoshinaga and K. Ogawa. 2006. Comparison of Marteilioides chungmuensis infection in the Pacific oyster Crassostrea gigas cultured in different conditions. Aquaculture 253: 91-97.
- Tun, K.L., N. Itoh, N. Ueki, T. Yoshinaga et K. Ogawa. 2007. Relationship between Marteilioides chungmuensis infection and reproduction in the Pacific oyster, Crassostrea gigas. Journal of Invertebrate Pathology 96: 205-212.
- Tun, K.L., N. Itoh, Y. Shimizu, H. Yamanoi, T. Yoshinaga et K. Ogawa. 2008a. Pathogenicity of the protozoan parasite Marteilioides chungmuensis in the Pacific oyster Crassostrea gigas. International Journal for Parasitology 38: 211-217.
- Tun, K.L., Y. Shimizu, H. Yamanoi, T. Yoshinaga et K. Ogawa. 2008b. Seasonality in the infection and invasion of Marteilioides chungmuensis in the Pacific oyster Crassostrea gigas. Diseases of Aquatic Organisms 80: 157-165.
- Ward, G.M., M. Bennett, K. Bateman, G.D. Stentiford, R. Kerr, S.W. Feist, S.T. Williams, C. Berney et D. Bass. 2016. A new phylogeny and environmental DNA insight into paramyxids: an increasingly important but enigmatic clade of protistan parasites of marine invertebrates. International Journal of Parasitology 46: 605-619.
- Wolf, P.H. 1977. An unidentified protistan parasite in the ova of the blacklipped oyster, Crassostrea echinata, from northern Australia. Journal of Invertebrate Pathology 29: 244-246.
- Yanin, L., H.-S. Kang, H.-K. Hong, H.-D. Jeung, B.-K. Kim, T.C. Le, Y.-O. Kim et K.-S. Choi. 2013. Molecular and histological identification of Marteilioides infection in Suminoe Oyster Crassostrea ariakensis, Manila Clam Ruditapes philippinarum and Pacific Oyster Crassostrea gigas on the south coast of Korea. Journal of Invertebrate Pathology 114: 277-284.
Information de citation
Bower, S.M., Itoh, N. (2019): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Marteilioides chungmuensis of Oysters
Coordonnées des coauteurs
Naoki Itoh, Graduate School of Agricultural and Life Science, The University of Tokyo, 1-1-1 Yayoi, Bunkyo-ku, 113-8657, Tokyo Japan.
Date de la dernière révision : Janvier 2019
Faire parvenir les commentaires à : Susan Bower
- Date de modification :