Perkinsus qugwadi (SPX) des pétoncles
Sur cette page
Catégorie
Catégorie 2 (au Canada et d'intérêt régional)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
SPX, protiste X des pétoncles
Nom scientifique ou classification taxonomique
Perkinsus qugwadi. Étant donné que ce parasite ne grossit pas dans un milieu liquide au thioglycollate et ne devient pas d'une coloration bleu-noir lorsqu'il est exposé à une solution de lugol (voir la section Culture ci-dessous), et parce que la séquence d'ADN de la région de l'espaceur interne transcrit (ITS) du gène de l'ARN ribosomique est considérablement différente de celle d'autres espèces de Perkinsus (voir la section Sondes à ADN ci-dessous), Casas et al. (2002) remettent en question la classification de ce parasite en tant qu'espèce de Perkinsus. d'autres espèces de Perkinsus ont été décrites à partir de divers mollusques, notamment des pétoncles dans le Canada atlantique et sur la côte est du Pacifique Nord, de même que des huîtres, des palourdes et des ormeaux.
Répartition géographique
Ce parasite est réparti de manière éparse en Colombie-Britannique, au Canada. jusqu'à maintenant, il a été détecté à 5 des 14 sites de grossissement, soit à au lagon Booker, à l'île Broughton; dans la baie Kanish, à l'île Quadra; à l'île Read, à l'île Denman; et plus rarement, dans la baie Cypress. Le SPX serait originaire de la Colombie-Britannique. De la semence infectée de pétoncles japonais provenant de la baie Kanish a par erreur été envoyée à plusieurs autres localités en Colombie-Britannique. On ignore si le parasite a réussi à s'établir à ces emplacements.
Espèces hôtes
Patinopecten yessoensis, qui a été introduit en Colombie-Britannique à des fins d'aquaculture en suivant rigoureusement le Code de Conduite du CIEM pour les introductions et les transferts d'organismes marins (Sindermann 1992; CIEM 1995) du Conseil international pour l'exploration de la mer (CIEM) et qui est probablement enzootiques chez d'autres espèces indigènes de la Colombie-Britannique.
Impact sur l'hôte
Prolifération massive de protozoaires dans les tissus conjonctifs de tous les organes, ce qui mène à une abondance importante du parasite et cause la mortalité. De nombreux pétoncles présentent des pustules blanc crème mesurant jusqu'à 5 mm de diamètre sur tous leurs organes, mais surtout sur la gonade, la glande digestive et le manteau. Il est intéressant de noter que la portée de la réaction hémocytaire ne correspond pas nécessairement au niveau d'infection. Cette maladie peut causer un taux élevé de mortalité chez les pétoncles juvéniles (souvent plus de 90 %), mais elle semble légèrement moins infectieuse chez les adultes P. yessoensis, qui affichent habituellement une plus faible prévalence de la mortalité (environ 50 %). Cependant, le SPX ne se transmet pas facilement d'un pétoncle à l'autre, à l'exception d'un faible pourcentage (moins de 15 %) de pétoncles juvéniles gravement infectés (hauteur de coquille de moins de 40 mm), chez qui des zoospores se développent. Les pétoncles indigènes aux zones enzootiques (Chlamys rubida et Chlamys hastata) ont résisté à l'infection et aux effets pathogènes de P. qugwadi (Bower et al. 1999). En outre, l'application d'un dosage moléculaire n'a pas permis de détecter la présence de P. qugwadi chez neuf autres espèces de bivalves dans les zones enzootiques (Itoh et al. 2013).
La prévalence de l'infection a diminué considérablement après 1995, et la maladie a été signalée pour la dernière fois en 1997, ce qui porte à croire que les stocks de P. yessonesis introduits en Colombie-Britannique, au Canada, ont développé une résistance à la maladie, ou encore que P. qugwadi a disparu. Cependant, en octobre 2011, Itoh et al. (2013) ont découvert la présence de P. qugwadi et une mortalité y étant associée à une installation aquacole située à l'un des emplacements connus en Colombie-Britannique où une infection a été détectée chez 44 P. yessonesis juvéniles sur un total de 100 (moyenne ± ET hauteur de la coquille : 29,5 ± 4,6 mm).
Techniques de diagnostic
Observations générales
nbsp;: La présence de pustules blanc crème mesurant jusqu'à 5 mm de diamètre sur divers organes est suspecte; un examen histologique est nécessaire.
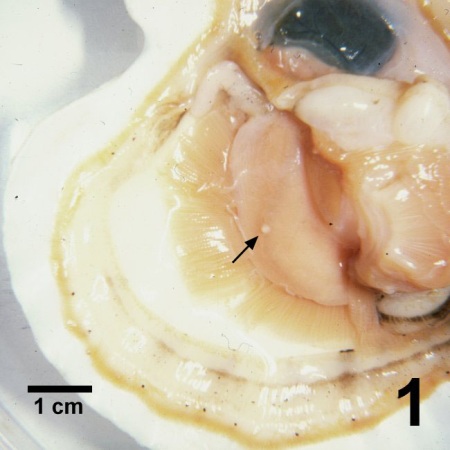
Figure 1. Patinopecten yessoensis avec une valve en moins illustrant une pustule (flèche) sur la gonade causée par Perkinsus qugwadi.
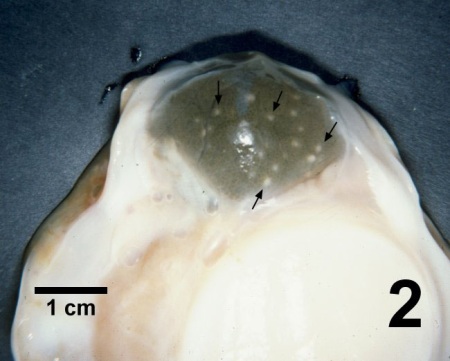
Figure 2. Glande digestive de Patinopecten yessoensis contenant de nombreuses pustules (flèches) causées par Perkinsus qugwadi.
Histologie
nbsp;: Divers organes contiennent des protozoaires ronds (stade de trophozoïte) mesurant jusqu'à 10 µm de diamètre. Une grosse vacuole peut déplacer le noyau situé au centre de quelques trophozoïtes pour former le stade « bague à chaton ». Il peut y avoir des tomonts composés d'amas de 2 à 8 petits (moins de 5 µm de diamètre) trophozoïtes en développement dans une membrane cellulaire. Certains pétoncles affichent une infiltration d'hémocytes. Des zoosporanges et des zoospores (stade de petites cellules flagellées mesurant de 2 à 3 µm de longueur) ont été observés dans les tissus d'environ 10 % des petits pétoncles infectés (dont la coquille mesurait moins de 4 cm de hauteur). Les flagelles des zoospores sont souvent difficiles à observer dans les sections histologiques, mais elles sont évidentes dans les préparations d'empreinte de tissus qui ont été séchées à l'air, puis colorées avec des formules commerciales de colorants Wright-Giemsa.
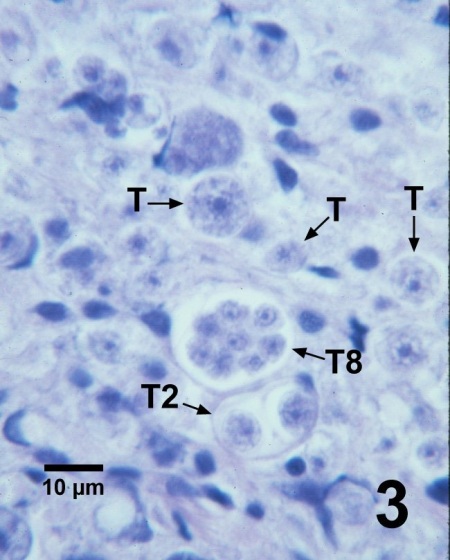
Figure 3. Section histologique de la gonade d'un Patinopecten yessoensis présentant plusieurs trophozoïtes (T), un tomont contenant deux trophozoïtes en développement (T2) et un tomont contenant huit trophozoïtes en développement (T8) de Perkinsus qugwadi dans les tissus conjonctifs. Colorant de campêche et d'éosine.
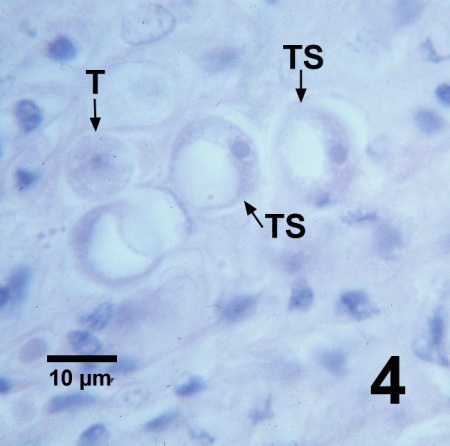
Figure 4. Section histologique de la gonade d'un Patinopecten yessoensis contenant un trophozoïte ordinaire (T) et quelques trophozoïtes affichant de grosses vacuoles (TS) qui ont déplacé le noyau à la périphérie de la cellule pour former un amas de cellules qui consiste en la morphologie « bague à chaton » de Perkinsus qugwadi. Teinture de campêche et d'éosine.
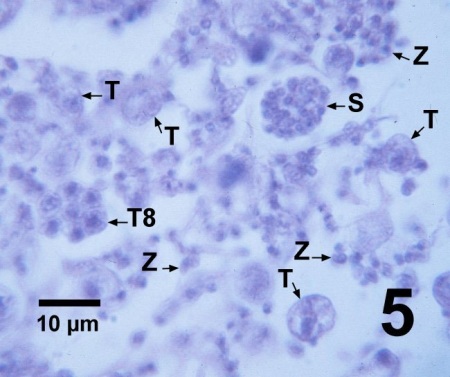
Figure 5. Section histologique d'un Patinopecten yessoensis juvénile gravement infecté par Perkinsus qugwadi illustrant plusieurs petits trophozoïtes (T), un tomont comportant huit trophozoïtes en développement (T8), un zoosporange (S) contenant plusieurs zoospores en développement, et de nombreuses zoospores libres dont les flagelles sont difficiles à voir en histologie. Teinture de campêche et d'éosine.
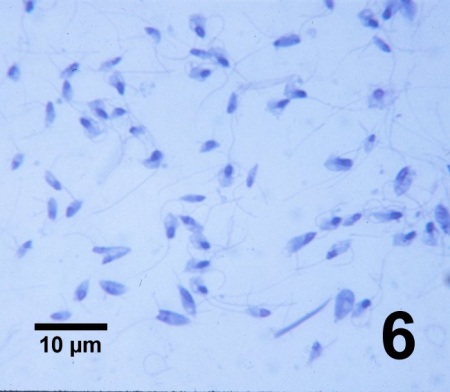
Figure 6. Zoospores biflagellées de Perkinsus qugwadi illustrant la morphologie variable dans une préparation d'empreinte de tissus provenant de la gonade d'un Patinopecten yessoensis juvénile gravement infecté et colorée à l'aide d'une version modifiée du colorant commercial Wright-Giemsa.
Microscopie électronique
nbsp;: l'ultrastructure de la zoospore rappelle celle des zoospores de Perkinsus sp., sauf que la membrane des micronèmes autour du noyau est conoïde, que certaines mitochondries sont lobulaires, qu'il n'y a pas de corps dense aux électrons dans la lumière du corpuscule basal flagellé, et que les expansions corticales semblables à des alvéoles dans la membrane de la cellule couvrent toute la surface de la cellule. Contrairement à toutes les autres Perkinsus sp., les zoospores se développent dans les tissus de l'hôte (pétoncle).
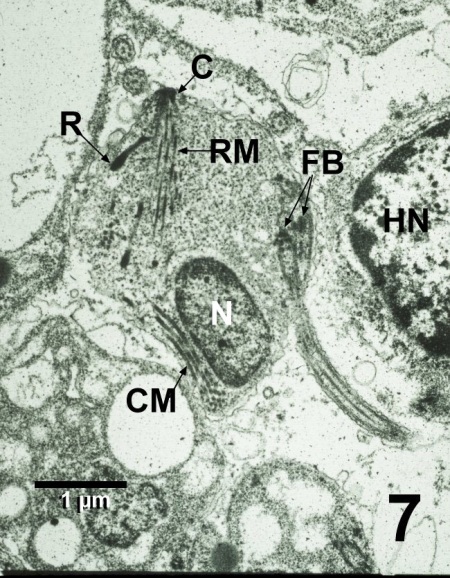
Figure 7. Microscopie de la transmission électronique d'une zoospore de Perkinsus qugwadi adjacente au noyau (HN) d'un hémocyte de Patinopecten yessoensis lysé. La section de cette zoospore illustre les bases de la flagelle (FB), le noyau (N) et le complexe apical constitué du conoïde (C), de la rhoptrie, de micronèmes rectilignes (RM) et de micronèmes conoïdes connexes (CM). Acétate d'uranyle et colorant au citrate de plomb.
Sondes à ADN
nbsp;: Les séquences des segments du gène de l'ARN ribosomique (ADNr) (y compris des parties de la petite sous-unité [SSU ADNr ou ADNr 18S] et des espaceurs internes transcrits [ITS]) ont été ajoutées à la base de données de GenBank du National Center for Biotechnology Information, avec les numéros d'accès AF151528 et AB716689. Itoh et al. (2013) ont conçu deux essais de réaction en chaîne de la polymérase (PCR) basés sur les régions des ITS. l'un des essais a permis de détecter 52 % plus d'infections chez les pétoncles que l'histologie; toutefois, l'essai a aussi obtenu une réaction croisée avec Perkinsus honshuensis et P. olseni. l'autre essai de PCR était moins sensible, mais il a détecté 34 % plus d'infections que l'histologie et il n'a réagi avec aucune autre des espèces de Perkinsus testées. Ces essais de la PCR semblent être des outils précieux pour détecter la présence de P. qugwadi (Itoh et al. 2013).
Les analyses phylogéniques basées sur la région des ITS de P. qugwadi plaçaient invariablement cette espèce à la base d'un clade contenant les autres Perkinsus sp. (Coss et al. 2001; Casas et al. 2002a, b; Dungan et al. 2002). De plus, une analyse phylogénique de 1796 paires de base de la séquence génique de la SSU ADNr indiquait clairement que P. qugwadi se situait à la base par rapport aux autres espèces de Perkinsus (Itoh et al. 2013).
Culture
jusqu'à maintenant, toutes les tentatives d'établissement de P. qugwadi dans les cultures ont échoué. De plus, P. qugwadi n'affichait aucun développement de prézoosporanges dans un milieu liquide au thioglycollate (FTM) et ne devenait pas d'une coloration foncée lorsqu'il était exposé à une solution de lugol, tel que la méthode décrite par Ray (1966), et utilisée pour identifier toutes les autres espèces connues de Perkinsus. De plus, les prézoosporanges et les zoosporanges qui s'étaient développés dans les tissus des petits pétoncles ne sont pas devenus d'une coloration bleu-noir lorsqu'ils ont été exposés à une solution de lugol (Blackbourn et al. 1998).
Méthodes de contrôle
La pathogénicité extrême de ce parasite envers P. yessoensis nécessite que l'on fasse preuve de prudence afin d'éviter la propagation de cette maladie. La descendance de P. yessoensis qui a survécu à une épidémie épizootique de P. qugwadi affichait une résistance beaucoup plus forte à l'infection et à la mortalité connexe. Les pétoncles hybrides découlant d'un croisement entre des femelles P. yessoensis (du même groupe de pétoncles qui a survécu à une épidémie épizootique de P. qugwadi) et des mâles Patinopecten caurinus (indigènes de la Colombie-Britannique) affichaient une résistance similaire à P. qugwadi (Bower et al. 1999). l'identification des stocks de pétoncles qui sont résistants à P. qugwadi a facilité le développement d'une industrie aquacole du pétoncle en Colombie-Britannique.
Références
Blackbourn, J., S.M. Bower et G.R. Meyer. 1998. Perkinsus qugwadi sp.nov. (incertae sedis), a pathogenic protozoan parasite of Japanese scallops, Patinopecten yessoensis, cultured in British Columbia, Canada. Canadian Journal of Zoology 76: 942-953.
Bower, S.M. et G.R. Meyer. 1994. Causes of mortalities among cultured Japanese scallops, Patinopecten yessoensis, in British Columbia, Canada. In: Bourne, N.F., B.L. Bunting and L.D. Townsend (eds.). Proceedings of the 9th International Pectinid Workshop, Nanaimo, B.C., Canada, April 22-27, 1993. Canadian Technical Reports of Fisheries and Aquatic Science 1994: 85-94.
Bower, S.M., J. Blackbourn, D.J.H. Nishimura et G.R. Meyer. 1990. Diseases of cultured Japanese scallops (Patinopecten yessoensis) in British Columbia, Canada. In: A. Figueras (ed.). Abstracts, Fourth International Colloquium on Pathology in Marine Aquaculture. 17-21 September 1990, Vigo (Pontevedra), Spain, Instituto de Investigaciones Marinas-CSIC, Vigo, p. 67-68.
Bower, S.M., J. Blackbourn, G.R. Meyer et D.J.H. Nishimura. 1992. Diseases of cultured Japanese scallops (Patinopecten yessoensis) in British Columbia, Canada. Aquaculture 107: 201-210.
Bower, S.M., J. Blackbourn et G.R. Meyer. 1998. Distribution, prevalence, and pathogenicity of the protozoan Perkinsus qugwadi in Japanese scallops, Patinopecten yessoensis, cultured in British Columbia, Canada. Canadian Journal of Zoology 76: 954-959.
Bower, S.M., J. Blackbourn, G.R. Meyer et D.W. Welch. 1999. Effect of Perkinsus qugwadi on various species and strains of scallops. Diseases of Aquatic Organisms 36: 143-151.
Bower, S., E. Burreson et K. Reece. 2003. Annex 10: Review of molecular techniques used to differentiate the various species/isolates of Perkinsus. Report of the Working Group on Pathology and Diseases of Marine Organisms, Aberdeen, UK, 11-15 March 2003. Mariculture Committee, ICES CM 2003/F:03, Ref. ACME, pg. 54-60.
Casas, S.M., A. Villalba et K.S. Reece. 2002. Study of perkinsosis in the carpet shell clam Tapes decussatus in Galicia (NW Spain). I. Identification of the aetiological agent and in vitro modulation of zoosporulation by temperature and salinity. Diseases of Aquatic Organisms 50: 51-65.
Casas, S.M., J.F. La Peyre, K.S. Reece, C. Azevedo et A. Villalba. 2002b. Continuous in vitro culture of the carpet shell clam Tapes decussatus protozoan parasite Perkinsus atlanticus. Diseases of Aquatic Organisms 52: 217-231.
Coss, C.A., J.A.F. Robledo et G.R. Vasta. 2001. Fine structure of clonally propagated in vitro life stages of a Perkinsus sp. isolated from the baltic clam Macoma balthica. The Journal of Eukaryotic Microbiology 48: 38-51.
Dungan, C.F., R.M. Hamilton, K.L. Hudson, C.B. McCollough et K.S. Reece. 2002. Two epizootic diseases in Chesapeake Bay commercial clams, Mya arenaria and Tagelus pledius. Diseases of Aquatic Organisms 50: 67-78.
ICES (International Council for the Exploration of the Sea). 1995. ICES Code of Practice on the Introductions and Transfers of Marine Organisms 1994. International Council for the Exploration of the Sea, Copenhagen.
Itoh, N., G.R. Meyer, A. Tabata, G. Lowe, C.L. Abbott et S.C. Johnson. 2013. Rediscovery of the Yesso scallop pathogen Perkinsus qugwadi in Canada, and development of PCR tests. Diseases of Aquatic Organisms 104: 83-91.
Sindermann, C.J. 1992. Role of the International Council for the Exploration of the Sea (ICES) concerning introductions of marine organisms, In: Rosenfield, A., R. Mann (eds.) Dispersal of Living Organisms into Aquatic Ecosystems. Maryland Sea Grant College, College Park, pp. 367-376.
Citation
Bower, S.M. (2013) : Sommaire des maladies infectieuses et des parasites des mollusques et crustacés exploités commercialement : Perkinsus qugwadi (SPX) des pétoncles.
Date de la dernière révision : Mai 2013
Faire parvenir les commentaires à Susan Bower
- Date de modification :