Perkinsus marinus (maladie « Dermo ») de l'huître
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Perkinsus marinus, maladie « dermo » ou perkinsose.
Nom scientifique ou classification taxonomique
Perkinsus marinus (=Dermocystidium marinum, = Labyrinthomyxa marina). À l'origine, le genre Perkinsus a été placé dans l'ordre des Perkinsida de la classe des Perkinsea dans le phylum Apicomplexa (Levine 1978). Toutefois, la structure conoïde des zoospores (voir la description ci-dessous) est incomplète, ce qui suggère que l'affinité avec les Apicomplexa est précaire (Villalba et al. 2004). Des analyses taxonomiques fondées sur les séquences nucléotidiques indiquent que Perkinsus pourrait ne pas appartenir au phylum Apicomplexa, mais serait plus proche des Dinoflagellida (Goggin et Barker 1993, Perkins 1996, Siddall et al. 1997, Reece et al. 1997b, Saldarriaga et al. 2003, Villalba et al. 2004). Cette hypothèse a été soutenue par les affinités sérologiques de P. marinus avec certains dinoflagellés, notamment quelques espèces libres et parasitiques de Hematodinium de Nephrops norvegicus, Chionoecetes bairdi, Portunus pelagicus, Callinectes sapidus, Necora puber et un amphipode gammaridé non identifié (Bushek et al. 2002a). Norén et al. (1999) ont proposé que les Perkinsidae, qui ont des caractéristiques communes à la fois avec les dinoflagellés et les apicomplexés, soient décrits en tant que taxon au même niveau que d'autres phylums d'alvéolés et que leur soit donné le nom de Perkinsozoa (Robledo et al. 2011, Mangot et al. 2011). De plus, à partir d'analyses moléculaires supplémentaires, Zhang et al. (2011a) ont soutenu l'affiliation du genre Perkinsus à une lignée indépendante (Perkinsozoa) placée entre le phylum Apicomplexa et le phylum Dinoflagellata.
Répartition géographique
Sur la côte Est des États-Unis d'Amérique (É.-U.) du Maine à la Floride (Andrews 1988, 1996; Burreson et Ragone Calvo 1996; Ford et Tripp 1996), ainsi que le long de la côte du golfe du Mexique jusqu'à la péninsule du Yucutan (Burreson et al. 1994a, Aguirre-Macedo et al. 2007, Gullian-Klanian et al. 2008) et à partir du fleuve Paraíba, au nord-est du Brésil (da Silva et al. 2013). La prévalence et l'intensité de l'infection varient selon le lieu et la saison (Craig et al. 1989, Crosby et Roberts 1990, Oliver et al. 1998b). Des foyers d'infection ont été observés dans l'ensemble de cette aire de répartition (Brousseau et al. 1998) et Perkinsus marinus représente une menace pour l'ostréiculture dans certaines zones (Ulrich et al. 2007). Le service des Pêches du ministère des Ressources naturelles du Maryland (É.-U) surveille la prévalence, l'intensité et l'aire de répartition de P. marinus dans la baie de Chesapeake (Tarnowiski 2003, 2005). l'extension de l'aire de répartition de la maladie aux États-Unis à la baie de la Delaware, au New Jersey et au cap Cod dans le Maine vers 1990, a été attribuée à des introductions répétées par plusieurs vecteurs et pendant de nombreuses années, auxquelles s'est ajoutée l'augmentation de la température de la surface de la mer, particulièrement en hiver (Ford 1996; Cook et al. 1998; Ford et al. 2000a, b; Karolus et al. 2000; Ford et Chintala 2006; Powell et al. 2008; Pecher et al. 2008). Dans les lieux plus au nord, les températures de prolifération parasitaire (supérieures à 20 °C) sont généralement observées seulement de juin à septembre. Les hivers plus froids et les précipitations élevées connus depuis 2002 ont réduit la prévalence de l'infection dans certaines régions, mais comme P. marinus survit à des températures et des salinités basses, des conditions d'épizootie se reproduiront probablement en cas de nouvelle hausse des températures, comme le prévoient les modèles du changement climatique (Ford et Smolowitz 2007). Perkinsus marinus a été introduit involontairement à Pearl Harbor (Hawaii) (Kern et al. 1973). En 2007, P. marinus a été détecté dans des populations d'huîtres endémiques d'élevage (Crassostrea corteziensis) de l'État de Nayarit, sur la côte pacifique du Mexique, et ces infections ont été associées à des introductions non contrôlées de C. virginica dans la région (Cáceres-Martínez et al. 2008, 2010). Par la suite, Cáceres-Martínez et al. (2012) ont observé la présence de P. marinus dans des populations d'élevage ainsi que des populations naturelles de Saccostrea palmula dans quatre lagunes côtières de l'État de Sinaloa, sur la côte pacifique du Mexique. Enríquez-Espinoza et al. (2010) ont attribué les mortalités massives des Crassostrea gigas d'élevage dans le golfe de Californie (nord-ouest du Mexique) en juillet et en août 2006 à P. marinus ainsi qu'à des facteurs écologiques simultanés. Un parasite semblable à Perkinsus a été observé dans des Crassostrea angulata importées du Portugal en Grande-Bretagne au printemps 1969 (Alderman et Gras 1969). Perkinsus marinus ainsi que d'autres espèces de Perkinsus ont été détectés chez Crassostrea rhizophorae et Crassostrea gasar (= brasiliana) au Brésil (Sabry et al. 2009, da Silva et al. 2012, da Silva et al. 2013, Brandão et al. 2013, Queiroga et al. 2013). Par la suite, une autre espèce infectant C. rhizophorae dans l'État de Ceará, au nord-est du Brésil, a été apparentée à la famille de Perkinsus beihaiensis à partir d'analyses phylogénétiques (Sabry et al. 2013).
Espèces hôtes
Crassostrea virginica, Crassostrea corteziensis, Crassostrea rhizophorae, Saccostrea palmula et probablement Crassostrea gasar (= brasiliana). Crassostrea gigas et Crassostrea ariakensis ont également été infectées après une exposition expérimentale et une exposition environnementale, mais ces deux espèces semblent plus résistantes à la maladie (Barber 1996, Chu 1996, Calvo et al. 1999, Calvo et al. 2001, Paynter et al. 2008, Kingsley-Smith et al. 2009, Dungan et al. 2012). Schott et al. (2008) ont rapporté que pendant des essais expérimentaux sur le terrain, la prévalence de P. marinus était équivalente ou supérieure chez C. ariakensis à celle observée chez l'espèce indigène C. virginica. De plus, en laboratoire, C. ariakensis transmettait le parasite à l'huître C. virginica non infectée de façon efficiente. Crassostrea rhizophorae a également été infectée expérimentalement et semblait aussi sensible à l'infection que C. virginica, mais serait légèrement plus tolérante à des infections parasitaires plus importantes (Bushek et al. 2002c). Da Silva et al. (2013) ont détecté des infections naturelles de P. marinus sur plus de 70 % des C. rhizophorae du fleuve Paraíba (nord-est du Brésil). Cáceres-Martínez et al. (2008) ont montré une prévalence relativement faible des infections naturelles (inférieure à 6 %) sans mortalité connexe dans deux populations d'élevage de Crassostrea corteziensis de la côte pacifique mexicaine. Perkinsus marinus a également été observé dans une autre espèce d'huître indigène (Saccostrea palmula) dans un État mexicain situé plus au sud sur la côte pacifique, mais l'intensité légère à modérée de l'infection qui atteint 20 % des huîtres pourrait ne pas indiquer la sensibilité de cette espèce d'huîtres à la perkinsose (Cáceres-Martínez et al. 2012). La vulnérabilité des palourdes Mya arenaria et Macoma balthica à l'infection a été montrée expérimentalement au moyen d'inoculations dans la cavité du manteau (Dungan et al. 2007). Coss et al. (2001) ont observé la présence d'ADN de P. marinus dans la palourde Macoma mitchelli. Cependant, les études réalisées au moyen d'analyses moléculaires sensibles et spécifiques de P. marinus sur les palourdes (n=452 de cinq espèces) sympatriques (cohabitant avec) des populations de C. virginica présentant des prévalences élevées de P. marinus (50 à100 % des individus sont infectés) ont révélé la présence de P. marinus dans une seule palourde (Mya arenaria) (Reece et al. 2008). Par ailleurs, Pecher et al. (2008) ont montré que la prévalence de P. marinus chez Mercenaria mercenaria était significativement inférieure à la prévalence chez C. virginica, ce qui indiquerait que M. mercenaria n'est pas un hôte optimal pour P. marinus. Les M. mercenaria d'élevage de la côte de la Floride dans le golfe du Mexique (É.-U.) se sont révélées négatives à l'infection à P. marinus au moyen de sondes à ADN (réaction en chaîne de la polymérase) spécifiques, mais de faibles taux d'infection ont été détectés par une analyse de Ray en milieu liquide au thioglycollate (RFTM) et par réaction en chaîne de la polymérase spécifique au genre (McCoy et al. 2007). Perkinsus marinus a également été observé chez l'escargot ectoparasite Boonea impressa, et le transfert de P. marinus à C. virginica a été démontré en laboratoire (White et al. 1987). Il faut noter que C. virginica peut aussi être infectée par d'autres espèces de Perkinsus (Coss et al. 2001, Pecher et al. 2008). De plus, deux autres espèces de Perkinsus (P. mediterraneus et P. beihaiensis) ont été observées chez d'autres espèces d'huîtres, dans les eaux européennes et asiatiques respectivement. Par ailleurs, des espèces de Perkinsus semblables ont été observées chez l'huître Saccostrea forskali cultivée en Thaïlande (Taveekijakarn et al. 2005) et chez au moins 34 espèces de mollusques (y compris les palourdes, l'ormeau et les pétoncles) des eaux tempérées chaudes aux eaux tropicales de l'Atlantique et de l'ouest du Pacifique et dans la mer Méditerranée, ainsi que chez 30 espèces de bivalves de la Grande barrière de corail et chez les huîtres perlières Pinctada maxima d'élevage du détroit de Torres, en Australie (Norton et al. 1993, Perkins 1996). Des moules, comme Mytilus edulis et Geukensia demissa, qui ne sont pas connues pour développer la perkinsose, contenaient une activité élevée anti-P. marinus dans leur hémolymphe (Anderson et Beaven 2001).
Impact sur l'hôte
L'endoparasite Perkinsus marinus a causé une mortalité massive de l'huître C. virginica et est l'un des principaux facteurs nuisant à l'abondance et à la productivité de cette espèce à divers endroits de la côte Est et de la côte du golfe du Mexique aux États-Unis (Burreson et Ragone Calvo 1996, Ford 1996, Ray 1996, Powell et al. 2008). Par exemple, la forte diminution de la production d'huîtres dans la partie de la baie de Chesapeake se trouvant au Maryland entre 1981 et 1988, période pendant laquelle les récoltes ont chuté jusqu'à 15 000 tonnes métriques à partir de 1986 (alors qu'elles fluctuaient autour de 80 000 tonnes métriques de 1910 à 1980) a été attribuée aux mortalités massives dues aux infections de P. marinus et Haplosporidium nelsoni, à la prédation et à de mauvaises pratiques de gestion (Héral et al. 1990, Goulletque et al. 1994). En revanche, les déclins importants de la production de C. virginica dans cette région avant 1950 étaient probablement dus à la destruction mécanique de l'habitat et à la surpêche du stock, mais non à des maladies (Rothschild et al. 1994). Carnegie et Burreson (2008) ont constaté que dans la partie de la baie de Chesapeake se trouvant en Virginie, les populations de C. virginica restaient persistantes malgré l'infection par P. marinus et avaient une capacité de croissance en cas de gestion efficace du substrat et d'arrêt de la destruction des récifs. Dans la baie du Delaware, les populations de C. virginica, qui sont très sensibles à P. marinus, survivent dans des refuges du fond de la baie, probablement parce ce que les conditions du milieu inhibent l'infection (Pydeski et Bushek 2008). Gullian-Klanian et al. (2008) indiquent qu'au Mexique, aucune épizootie grave attribuée à P. marinus n'avait été signalée. Malgré des prévalences élevées (70 % en moyenne) dans le Lagon de Términos (dans le golfe du Mexique mexicain) pendant la saison sèche, l'intensité de l'infection y était généralement faible. Klanian et al. (2008) ont suggéré que les apports d'eau douce associés à des concentrations élevées de nutriments pendant la saison des pluies et la saison des vents du nord avaient eu une influence fortement négative sur la prévalence de P. marinus (23 % et 7 %, respectivement) et influent aussi sur la physiologie des huîtres; ce stress saisonnier serait la cause de l'absence d'événement épizootique dans le lagon de Términos.
Le cycle vital de P. marinus comprend un stade de trophozoïtes dans la colonne d'eau qui pénètrent dans la cavité palléale de l'huître lors de l'activité d'alimentation par filtration et qui sont ensuite dirigés par les branchies et les palpes vers la bouche. Les agrégats marins (petits amas de matière suspendus dans la colonne d'eau) contenant P. marinus produisaient des intensités d'infection plus élevées que les P. marinus en suspension libre (Ralph et al. 2008); les organes palléaux (palpes labiaux) et la principale zone de rejet de pseudofèces dans le manteau étaient d'importants foyers infectieux tissulaires (Winnicki et al. 2008). En accord avec ces conclusions, Allam et al. (2013) indiquent que l'infection survient couramment dans la zone de rejet des pseudofèces du manteau pendant le rejet de ces matières et avant qu'elles n'atteignent la bouche, et montrent que les cellules de P. marinus présentes dans les agrégats causent une prévalence de la maladie et des intensités de l'infection significativement plus élevées que celles dues aux cellules parasites en suspension. Espinosa et al. (2013) suggèrent que le mucus du manteau de C. virginica joue un rôle important dans la pathogénie de P. marinus en augmentant la prolifération et l'infectiosité du parasite. Une fois dans la cavité palléale ou le tube digestif, les trophozoïtes présentant des ligands de surface pour la galectine de l'huître Crassostrea virginica (CvGal) (Tasumi et Vasta 2007) sont reconnus et phagocytés par les hémocytes qui ont des capacités de transmigration vers le milieu interne puis le système vasculaire. Les parasites restent dans les vésicules semblables à des vacuoles de phagocytose des hémocytes, où ils sont restent viables et se multiplient (tomonts). Lors de la désintégration des hémocytes infectés, les trophozoïtes libérés sont phagocytés par les hémocytes à proximité ou se multiplient de façon extracellulaire sous forme de tomonts, autant dans le milieu interne que dans la lumière du système vasculaire. Les hémocytes infectés en circulation migrent dans l'ensemble des tissus hôtes, où ils lysent et libèrent des trophozoïtes, ce qui provoque une infection systémique et éventuellement la mort de l'hôte. Les trophozoïtes sont libérés dans l'eau par les fèces et les pseudofèces chez l'huître vivante et, à sa mort, par les tissus infectés en décomposition (Bushek et al. 2002b). Une fois qu'ils sont libérés dans la colonne d'eau, les trophozoïtes peuvent sporuler : la taille des trophozoïtes croît (prézoosporanges), ils développent un tube de relargage et, après plusieurs cycles de division, libèrent des centaines de zoospores dans la colonne d'eau. La question de savoir si les zoospores se développent ou non en trophozoïtes n'est pas résolue (Robledo et al. 2011).
Les effets de l'infection à P. marinus sur C. virginica vont d'une glande digestive à la couleur pâle, de diminutions de l'indice de condition, de perturbations de la gamétogénèse, d'une diminution des concentrations de protéines hémolymphatiques et de l'activité du lysozyme à une émaciation sévère, une tendance à bâiller, un rétrécissement du manteau se retirant du coté externe de la coquille, un retard de croissance et parfois à la présence de pus sous forme de poches (Ford et Tripp 1996). Il est possible d'estimer et d'expliquer l'incidence de P. marinus à différentes intensités d'infection sur le bilan énergétique de l'huître au moyen de l'acquisition d'énergie par la production et la respiration de P. marinus (Choi et al. 1989). Ford et al. (1999) montrent que les répartitions de P. marinus chez les populations hôtes sont agrégées (par exemple une ou deux huîtres peuvent contenir plus de parasites que toutes les autres huîtres de l'échantillon). Remacha-Triviño et al. (2008) ont déterminé que le nombre total moyen de trophozoïtes dans huit huîtres C. virginica infectées naturellement était d'environ 11,5 millions de cellules, dont près de 97 % étaient des trophozoïtes matures (structures en bague à chaton), 2 % des trophozoïtes immatures (mérontes ou schizontes) et 1 % des amas de petits trophozoïtes immatures (tomonts ou mérozoïtes). Le pourcentage de trophozoïtes détectée dans les différents tissus était : intestin (30,1 %), tissu conjonctif vésiculaire (21,3 %), hémocytes (14,9 %), glande digestive (11,4 %), branchies (6,1 %), tissus conjonctifs (5,7 %), gonades (4,1 %), palpes (2,2 %), muscles (1,9 %), tissu conjonctif du manteau (0,8 %), péricarde (0,7 %), épithélium du manteau (0,1 %) et cœur (0,1 %) (Remacha-Triviño et al. 2008).
La prolifération du parasite cause une perturbation systémique du tissu conjonctif et des cellules épithéliales et est corrélée à des températures de l'eau élevées en été (supérieures à 20 °C) quand la pathogénicité et les mortalités connexes culminent. En Caroline du Sud, la prévalence et l'intensité de P. marinus chez C. virginica étaient maximales pendant les périodes de fraie, qui correspondent aussi aux températures les plus élevées (Burrell et al. 1984, Bobo et al. 1989). Toutefois, dans cette région, les relations entre la salinité, la température et le stade de développement gonadique de l'huître et l'infection à P. marinus n'ont pas été clairement établies (Burrell et al. 1984). En revanche, il a été montré que les différences de salinité affectaient la prévalence et l'intensité de P. marinus chez C. virginica dans la baie de Chesapeake (Paynter et al. 1993a). De plus, dans le centre de la région du nord du golfe du Mexique, l'intensité et la prévalence de l'infection étaient corrélées à la salinité (Mackin 1955, Soniat et al. 2012), mais pas à la température de l'eau (Soniat et Gauthier 1989, Gauthier et al. 1990). Les huîtres C. virginica infectées peuvent éliminer les parasites P. marinus viables dans les fèces et les pseudofèces à un taux corrélé à la fois à la charge corporelle de P. marinus et au temps de survie subséquent, ce qui peut être important dans les transmissions qui ont lieu avant que les infections ne soient létales. Cependant, dans une épizootie, l'excrétion de P. marinus par les fèces et les pseudofèces est relativement basse par rapport au nombre potentiellement libéré par les cadavres d'huîtres fortement infectées (Bushek et al. 2002b). Hoese (1964) ont indiqué que les escargots, les crabes et les poissons nécrophages qui se nourrissent des tissus d'huîtres mortes pourraient être des vecteurs de P. marinus après un transfert passif du parasite par le tube digestif de l'animal nécrophage.
Saunders et al. (1993) ont déterminé que le taux de croissance de P. marinus chez C. virginica dépendait de la densité de la population de P. marinus et que le parasite pouvait maîtriser son niveau de population, mais que cet équilibre délicat était susceptible d'être déstabilisé, ce qui provoque des épizooties. Certaines huîtres C. virginica survivent à la prolifération estivale du parasite, mais n'ont pas la capacité de reprendre leur croissance après la période de repos hivernale. Des mortalités atteignant 95 % ont été observées chez C. virginica lors du deuxième été après le transfert dans des zones d'enzootie. Bien que certains chercheurs aient constaté l'inhibition du développement gonadique et le déclin de l'efficacité de la reproduction chez les huîtres infectées, Dittman et al. (2001) ont découvert que dans la baie du Delaware, les effets nocifs drastiques sur la reproduction prévus pendant le stade de gamétogénèse ne se sont pas produits au moment du frai, car la période de diminution des charges parasitaires coïncidait avec la maturation des gamètes. Cette observation a été confirmée chez les populations de C. virginica de la baie de Chesapeake par Carnegie et Burreson (2011a). Toutefois, des expériences réalisées en laboratoire par Chintala et al. (2002) ont montré une augmentation des taux d'infection chez les huîtres en cours de reproduction ou exposées à un stress causé par de faibles teneurs en oxygène. Willson et Burnett (2000) n'ont pas observé de corrélation forte entre la consommation d'oxygène et l'intensité de l'infection à P. marinus à des températures de 25 ou de 35 °C. Cependant, Breitburg et al. (2011) ont constaté que le cycle diurne (24 h) de l'hypoxie d'une part augmentait l'acquisition d'infections à P. marinus, très probablement par une diminution des réponses immunitaires de l'huître, et d'autre part réduisait la libération de parasites aux stades infectieux, peut-être en raison de taux de filtration inférieurs qui entraînent une réduction de la production de fèces.
Perkinsus marinus incorpore et modifie les lipides et synthétise les phospholipides de sources exogènes, et les nœuds métaboliques des trophozoïtes (mérontes) diffèrent de ceux des prézoosporanges (Chu et al. 1998, 1999; Lund et Chu 2002). Contrairement à d'autres parasites protistes, les trophozoïtes de P. marinus ont la capacité de synthétiser les acides gras essentiels à longue chaîne de novo (en particulier un acide gras insaturé, l'acide arachidonique 20:4(n-6) à partir de l'acétate) in vitro par la voie delta-8 (Chu et al. 2002, 2004). Venegas-Calerón et al. (2007) ont examiné la génétique du processus. Perkinsus marinus est un agent de stress pour son hôte, comme l'indique la mesure biochimique du ratio taurine/glycine chez C. virginica (Soniat et Koenig 1982). l'infection fait chuter les taux de taurine et de glycine de 40 % environ et les taux d'acides aminés libres de près de 33 %, ce qui pourrait perturber les mécanismes de tolérance à la salinité de C. virginica (Paynter et al. 1993b, 1995). Bien que les hémocytes des huîtres C. virginica infectées présentent une plus grande chimiluminescence induite par le zymosane (Anderson et al. 1992, 1993, 1995), les trophozoïtes de P. marinus ne stimulent pas de réaction de chimiluminescence dans les hémocytes d'huître (Anderson 1999a). Cela signifierait que P. marinus pourrait supprimer ou piéger la production des dérivés réactifs de l'oxygène des hémocytes et ainsi éviter ce composant de la défense de l'hôte malgré la capacité des hémocytes de l'huître à reconnaître et à phagocyter P. marinus (Volety et Chu 1995, La Peyre et al. 1995b, Anderson 1999b, Schott et al. 2003a). Un des mécanismes pouvant être employés par P. marinus pour annuler la stimulation du métabolisme oxydatif par les hémocytes (réponse immunitaire à la flambée oxydative de l'hôte) après la phagocytose est la dismutation des radicaux superoxydes en oxygène moléculaire et en superoxyde dismutase (SOD) décrite par Asojo et al. (2006) et Fernández-Robledo et al. (2008a) dans P. marinus en tant que cofacteurs au fer PmSOD1 et PmSOD2. Des tests de provocation in vitro montrent que les hémocytes isolés de C. virginica peuvent tuer près de 50 % des P. marinus provenant d'isolats de culture (Volety et Fisher 2000). Cependant, P. marinus produit plusieurs protéines extracellulaires (PEC) in vitro et il a été établi que ces protéines, particulièrement les protéases, ont une fonction importante in vivo pour l'installation de l'infection, les paramètres immunitaires de l'huître et la propagation du parasite (Garreis et al. 1996; La Peyre et Faisal 1997a; Volety et Chu 1997; La Peyre et Cooper 1998; Oliver et al. 1998a, 1999b, b; La Peyre et Volety 1999; Ottinger et al. 2001; Wright et al. 2002; Ahmed et al. 2003; Muñoz et al. 2003; Schott et Vasta 2003; Schott et al. 2003b; Jordan et Deaton 2005). De plus, l'activité des protéines extracellulaires varie selon la température (Chu et al. 2003) et supprime l'activité vibriocide des hémocytes de l'huître qui élimine efficacement la bactérie Vibrio vulnificus, ce qui peut produire des conditions propices à une augmentation du nombre de vibrions dans les tissus de l'huître (Tall et al. 1999). Robledo et al. (2004) ont identifié la séquence d'ADN complémentaire (ADNc) de la protéine homologue du macrophage associé à l'immunité naturelle du transporteur de cations divalents de P. marinus (PmNramp), qui pourrait être liée à la survie du parasite à la destruction intracellulaire par l'hôte.
L'activité antimicrobienne contre P. marinus se produit dans l'hémolymphe (plasma) acellulaire de l'huître (Anderson et Beaven 2000). Bien qu'aucune relation n'ait été établie entre les agglutinines sériques et la résistance à P. marinus (Chintala et al. 1994), les inhibiteurs de protéines à faible poids moléculaire (comme l'inhibiteur de sérine protéase à liaison lente et étroite décrit par Xue et al. 2006) et une forte activité anti-protéolytique dans l'hémolymphe de C. virginica et de C. gigas pourraient jouer un rôle dans les mécanismes de défense de l'huître (Oliver et al. 1999a, 2000; Faisal 1999; Elsayed et Faisal 1999; Xue et al. 2006; La Peyre et al. 2010a). Yu et al. (2011) et He et al. (2012) indiquent que le polymorphisme du gène inhibiteur de la sérine protéase (à cvSI-1) est lié à la résistance à P. marinus chez C. virginica. Par ailleurs, il a été constaté que la production d'oxyde nitrique par les hémocytes d'huîtres contribue à faire diminuer les charges parasitaires rapidement après l'infection (Villamil et al. 2007). Chu et La Peyre (1989) n'ont trouvé aucun lien entre la concentration de protéines et de lysozyme dans l'hémolymphe et l'infection des huîtres par P. marinus. Toutefois, à faible température et à faible salinité, C. virginica présentait des concentrations de lysozyme dans le plasma plus élevées, ce qui peut engendrer un environnement défavorable au développement du parasite ou affaiblir son activité (Chu et Volety 1997a, Chu 1998). La Peyre et al. (2010b) montrent qu'in vitro, les plus grandes diminutions de la viabilité de P. marinus se produisent uniquement en cas de concomitance d'une température basse et d'une faible salinité, ce qui indique un effet synergique clair entre ces paramètres écologiques et le parasite. Il faudrait étudier davantage le rôle (éventuel) des protéines de choc thermique dans la résistance au stress et aux maladies chez l'huître (Brown et al. 1993, Tirard et al. 1995, Encomio et Chu 2005). Cependant, la réponse au choc thermique chez C. virginica n'est pas affectée par l'infection à P. marinus (Encomio et Chu 2007). Wang et al. (2010) ont employé une analyse d'expression des gènes par biopuces chez C. virginica qui a révélé une nouvelle combinaison de réponse antimicrobienne et de réponse au stress oxydatif chez l'hôte 30 jours après un test de provocation visant P. marinus.
Bushek et Allen (1996a) ont constaté que certaines sous-espèces de C. virginica résistaient à P. marinus et que les taux d'immunité naturelle correspondaient plus ou moins à la mesure dans laquelle les populations ancestrales ont été exposées au parasite. De plus, la sélection différentielle par P. marinus peut produire une divergence dans la structure de la population de C. virginica (Green-Beach et al. 2011). Sokolova et al. (2006) ont découvert deux marqueurs de polymorphisme des longueurs de fragments amplifiés chez l'huître C. virginica de Caroline du Nord (États-Unis), qui ont été associés à l'infection, et ont supposé l'existence de gènes ou de groupes de gènes qui déterminent directement ou indirectement les taux d'infection. Par ailleurs, Bushek et Allen (1996b) ont montré que la virulence et la tolérance au milieu variaient selon les sous-espèces de P. marinus. Yee et al. (2005) ont confirmé la présence de différentes souches de P. marinus aux caractères phénotypiques distincts et une analyse des microsatellites des génotypes de P. marinus de Floride et du New Jersey (États-Unis) a indiqué une migration limitée du parasite entre des populations d'huîtres géographiquement proches (Thompson et al. 2008). Reece et al. (2001a, b) ont détecté 12 génotypes composites différents de P. marinus avec plus de 88 % de 76 isolats possédant un des trois génotypes prédominants, mais ils ont constaté qu'une même huître pouvait être infectée par plusieurs souches.
La modélisation des populations de C. virginica infectées qui a été réalisée par Hofmann et al. (1995) et Powell et al. (1996) ont montré que la nourriture à la disposition de l'hôte ainsi que la détermination des taux de croissance et de développement de l'hôte et du parasite par la salinité et la température sont des facteurs écologiques participant à la régulation de P. marinus. La température, la salinité et leurs interactions sont des facteurs écologiques influant considérablement sur la transmission et la pathogénicité de P. marinus chez C. virginica (Crosby et Roberts 1990, Audemard et al. 2006). Toutefois, d'autres facteurs écologiques et biologiques (p. ex. pollution, autres influences anthropiques, nutrition et croissance de l'hôte, frai et reproduction, âge, résistance, densité et répartition de l'huître, vecteurs de maladie) influent sur les taux de parasitisme observés sur le terrain (Craig et al. 1989, Soniat 1996). Ainsi, Ragone Calvo et al. (2003b) ont suggéré que la mortalité atypique de l'huître du début de l'été causée par Haplosporidium nelsoni, à une période où les infections à P. marinus sont légères, peut agir significativement de manière indirecte sur la dynamique de transmission de P. marinus. De plus, une relation avec les changements de salinité causés par les cycles climatiques a été associée aux modifications de la prévalence et de l'intensité de la maladie (Soniat et al. 2006, 2009, 2012). Lenihan et al. (1999) et Volety et al. (2000) ont démontré que la profondeur sous le niveau moyen des basses eaux à laquelle se trouvent les huîtres dans les récifs influe sur la prévalence et l'intensité de l'infection ainsi que sur la mortalité des huîtres, les plus touchées étant celles qui se trouvent à la base du récif. De plus, les modèles d'utilisation des terres (perturbations anthropiques) peuvent avoir une incidence sur la répartition de la maladie et l'exacerbation de la mortalité des huîtres (White et al. 1998, Bushek et al. 2000b, Power et al. 2006). Par exemple, aux États-Unis, dans le golfe du Mexique, Wilson et al. (1990, 1992) ont constaté que la latitude, la teneur totale en hydrocarbures aromatiques pétroliers ainsi que l'utilisation agricole et industrielle des terres agissaient significativement sur la répartition du parasite. Ils en ont conclu que les activités industrielles et agricoles correspondraient à une prévalence et une intensité élevées de la maladie causée par P. marinus.
L'exposition de l'huître à des polluants comme les agents cancérogènes chimiques N-nitrosodiéthylamine (DENA) et le tributylétain (TBT) amplifient la maladie causée par P. marinus (Winstead et Couch 1988 et Anderson et al. 1996, respectivement). De plus, l'exposition de C. virginica à des sédiments contaminés sur le terrain et des fractions hydrosolubles liées pendant un mois environ en laboratoire ont significativement augmenté l'expression et la progression des infections latentes à P. marinus de façon proportionnelle à la dose administrée (Chu et Hale 1994, Chu 1999). Cependant, Burreson et Ragone Calvo (1996) allèguent que peu d'éléments viennent soutenir la perception courante selon laquelle la pollution est responsable de la hausse spectaculaire de l'abondance de P. marinus depuis 1985. l'évaluation de l'impact in vitro de plusieurs contaminants anthropiques courants sur la prolifération de P. marinus a déterminé que seul un herbicide (dont les ingrédients actifs sont 3,1 % d'acide 2,4-dichlorophénoxyacétique, 10,6 % de mécoprop et 1,3 % de dicamba, et imitent les hormones de croissance de plantes latifoliées pour stimuler excessivement la croissance de la plante et provoquer ainsi sa mort) avait des effets préjudiciables importants, mais uniquement s'il était appliqué à un taux supérieur aux recommandations du fabricant (Bushek et al. 2007). Foster et al. (2011) ont observé que le cuivre (CuCl2) réduit la croissance de P. marinus in vitro et diminue fortement les taux d'infection des hémocytes in vivo, probablement par des effets toxiques directs sur le parasite.
Crassostrea gigas et l'huître triploïde C. ariakensis sont moins vulnérables (mais pas totalement résistantes) à l'infection et à la maladie causées par P. marinus (Meyers et al. 1991; Calvo et al. 1999, 2000, 2001). En revanche, il est possible que C. gigas soit moins tolérante aux facteurs écologiques prédominants dans l'habitat habituel de C. virginica (Barber et Mann 1994, Chu 1996). La plus grande résistance de C. gigas à l'infection et à la maladie pourrait être attribuée à une hausse des activités cellulaires et humorales (y compris les inhibiteurs de protéase) qui pourraient dégrader le parasite plus efficacement ou à des concentrations de protéines plus faibles dans le plasma qui limiteraient la croissance du parasite (La Peyre et al. 1995a, Romestand et al. 2002, Goedken et al. 2005). Espinosa et al. (2013) ont montré que la croissance de P. marinus était considérablement inhibée dans des cultures in vitro auxquelles avait été ajouté du mucus de cavité palléale de C. gigas, alors qu'elle était significativement accrue par l'ajout de mucus du manteau de C. virginica par rapport à des cultures enrichies d'autres extraits. De plus, des différences d'expression génique entre les huîtres C. virginica et C. gigas soumises à un test de provocation ont été déterminées par hybridation soustractive sélective (Tanguy et al. 2004). Bien que les huîtres triploïdes stériles C. virginica aient eu une croissance plus rapide et une mortalité cumulée plus faible que les diploïdes, la vulnérabilité des triploïdes et des diploïdes à P. marinus était égale (Barber et Mann 1991, Dégremont et al. 2012). Les infections à un stade avancé observées chez l'huître C. ariakensis exposée à P. marinus en laboratoire suggèrent qu'il existerait un risque de mortalité de C. ariakensis si l'huître est placée dans des conditions stressantes, du moins en écloserie ou en laboratoire (Moss et al. 2006).
Techniques de diagnostic
Observations générales
: les huîtres infectées peuvent présenter une glande digestive de couleur pâle, des diminutions de l'indice de condition, une émaciation sévère, une tendance à bâiller, un rétrécissement du manteau se retirant du coté externe de la coquille, une diminution du développement gonadique ou un retard de croissance. Occasionnellement, des poches de pus se forment dans les tissus mous. Ces signes ne sont toutefois pas pathognomoniques de la perkinsose. Cáceres-Martínez et al. (2008) ont observé que l'infection chez C. corteziensis est associée à des signes généraux de faiblesse, de transparence et de rétraction du manteau.
Préparation humide
corps sphérique contenant une vacuole excentrique (structure en bague à chaton) dans les préparations d'huîtres moribondes. Étant donné que cette caractéristique morphologique est commune à plusieurs espèces de Perkinsus, il faut employer d'autres méthodes pour déterminer l'identité spécifique des organismes. Cheng et Manzi (1996) ont indiqué que P. marinus serait détectable dans l'hémolymphe des huîtres infectées après application de la technique par adhérence sur plastique (plus précisément, environ 1 millilitre d'hémolymphe a été placé au fond d'une boîte de Petri, incubé à 25 °C pendant 30 minutes, puis les cellules n'adhérant pas sont examinées pour y chercher les parasites).
Histologie
nbsp;: étant donné que l'infection est généralement systémique, le tissu conjonctif de tous les organes peut abriter des trophozoïtes immatures (= schizontes, mérozoïtes ou aplanospores, de 2 à 3 µm de diamètre), des trophozoïtes matures (= étapes de la structure en bague à chaton ou schizontes matures, mérozoïtes, trophonts ou aplanospores, de 3 à 10 µm de diamètre, contenant chacun une grande vacuole excentrique [contenant possiblement un vacuoplaste] qui déplace le noyau vers la périphérie de la cellule) et des tomonts (=« rosettes », sporanges ou schizontes, de 4 à 15 µm de diamètre et contenant 2, 4, 8, 16 ou 32 trophozoïtes immatures en cours de développement). Plusieurs des parasites peuvent se trouver dans les hémocytes d'huître. La morphologie des trophozoïtes n'a pas de valeur taxonomique, car elle peut être influencée par l'hôte, le moment de l'année et la disponibilité de nutriments (Villalba et al. 2004). Par exemple, Carnegie et Burreson (2011b) ont montré que depuis 1986, les grands trophozoïtes de P. marinus à des intensités d'infection relativement basses chez l'huître C. virginica dans la baie de Chesapeake ont été remplacés par des cellules parasitaires très petites et abondantes. l'histopathologie des infections sévères chez C. corteziensis, ainsi que chez d'autres huîtres vulnérables, consiste en une infiltration invasive générale des hémocytes, comprenant une phagocytose des stades parasitaires, qui ont été disséminés dans le tissu conjonctif entourant l'épithélium de la glande digestive, la gonade et le manteau avec la présence de quelques cellules brunes (Cáceres-Martínez et al. 2008).
Figures 1 à 3. Perkinsus marinus dans des coupes histologiques du tissu conjonctif de la glande digestive (figures 1 à 3) et de l'épithélium intestinal (figure 4) de Crassostrea virginica du Maryland (États-Unis). Coloration à l'hématoxyline et l'éosine.
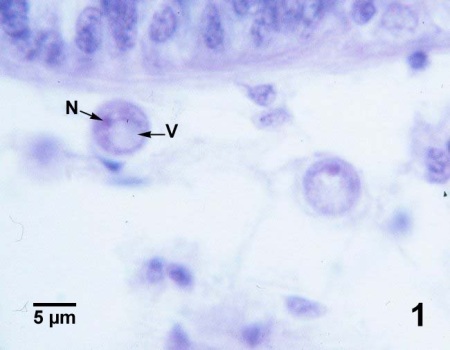
Figure 1. Deux trophozoïtes matures (stade de la structure en bague à chaton). La grande vacuole excentrique (V) et le noyau (N) sont indiqués sur le spécimen le plus proche de la paroi du tubule d'une glande digestive.
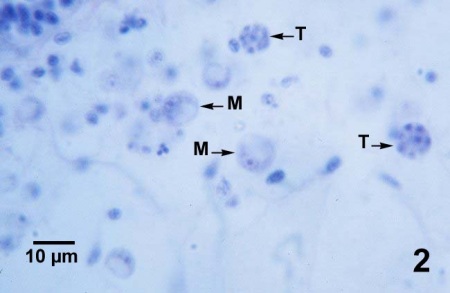
Figure 2. Trophozoïtes matures (M), dans lesquels la chromatine basophile du noyau se présente en forme d'anneau autour du périmètre du noyau, et deux tomonts (T) à huit cellules dans lesquels des trophozoïtes immatures sont en cours de développement.
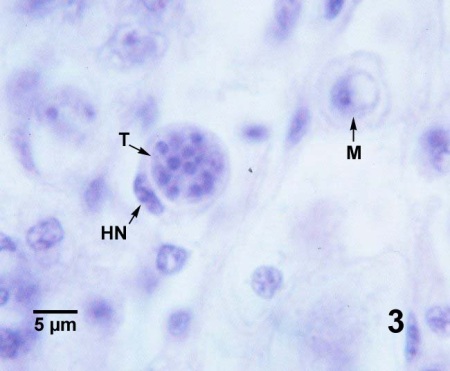
Figure 3. Tomont (T) à seize cellules contenant des trophozoïtes en cours de développement. Ce tomont est contenu dans un hémocyte (HN indique le noyau de la cellule phagocytaire) et un trophozoïte en cours de maturation (M) se trouve à côté.

Figure 4. Infection grave consistant en trophozoïtes (Z), en tomonts (T) et en trophozoïtes matures (M).
Microscope électronique
: l'ultrastructure de la zoospore est une caractéristique marquée de toutes les espèces de Perkinsus. Pour P. marinus, les zoospores ont été produites par le transfert de prézoosporange du milieu liquide au thioglycollate (voir les cultures ci-dessous) dans de l'eau de mer où il se développe en zoosporange qui produit des centaines de zoospores biflagellées motiles. Le flagelle antérieur présente des fibrilles très fines (mastigonèmes) et des structures en forme d'éperon; le flagelle postérieur est glabre. La zoospore contient un complexe apical comprenant un conoïde, des microtubules sous-pelliculaires, des rhoptries, des micronèmes rectilignes et des micronèmes associés au conoïde. l'extrémité antérieure de la zoospore comprend aussi de grandes vacuoles (pour une description détaillée de l'ultrastructure et des illustrations des zoospores veuillez consulter Perkins 1976b et Perkins 1996). Perkins (1969) décrit l'ultrastructure des stades végétatifs observés sur l'hôte C. virginica. Sunila et al. (2001) ont décrit les caractéristiques ultrastructurales des stades végétatifs de P. marinus (trophozoïtes [= trophonts] et tomonts [= schizontes]) à partir de cultures de propagation in vitro et les zoosporanges isolés de l'hémolymphe de C. virginica, agrandis en milieu liquide au thioglycollate (voir la description ci-dessous) et reproduits en zoospores dans un milieu liquide DMEM (milieu minimum essentiel d'Eagle modifié par Dulbecco)-Ham F12 auquel ont été ajoutés 3 % de sérum fœtal de veau et des antibiotiques. Fernández-Robledo et al. (2008a) ont montré que la superoxyde dismutase 2 de P. marinus (PmSOD2) se trouve dans les compartiments sous-cellulaires ressemblant à des vésicules à membrane unique qui fusionnent ou libèrent leur contenu dans un compartiment plus grand à double membrane.
Essai immunologique
: des anticorps polyclonaux reconnaissant seulement les prézoosporanges (= hypnospores) de P. marinus (Choi et al. 1991) et d'autres se liant à la plupart des stades biologiques de nombreuses espèces de Perkinsus, mais pas toutes, ainsi que d'autres dinoflagellés parasites et des anticorps monoclonaux qui reconnaissent les épitopes propres aux prézoosporanges ont été produits (Dungan et Roberson 1993, Bushek et al. 2002a). d'autres anticorps monoclonaux produits par Romestand et al. (2001) ont détecté des trophozoïtes de P. marinus et leurs lysats protéiques ainsi que des trophozoïtes de Perkinsus olseni (= atlanticus) des palourdes européennes (Ruditapes decussatus). Des essais immunologiques ont été appliqués avec succès à différents échantillons du milieu et à des systèmes expérimentaux in vitro (Dungan 1997). Des anticorps polyclonaux produits contre les protéines extracellulaires purifiées de P. marinus prélevées dans un milieu de culture défini ont servi à produire un test immunoenzymatique ELISA qui soit comparable aux essais en milieu liquide au thioglycollate de Ray (RFTM), comme il est décrit ci-dessous (Kaattari et al. 1997, Dungan et Hamilton 1997, Ottinger et al. 2001). Remacha-Triviño et al. (2008) ont employé des méthodes stéréologiques (soit une série de procédures mathématiques solides visant à quantifier les propriétés géométriques des objets cibles sans hypothèses sur les caractéristiques inhérentes de ces objets) et l'immunohistochimie (au moyen d'immunoglobuline G de lapin anti-P. marinus de Dungan et Roberson [1993]) pour quantifier et déterminer la distribution tissulaire de P. marinus chez C. virginica.
Sondes à ADN
: le gène l'ARN de la petite sous-unité ribosomique (« SSU rDNA », comprenant au moins 1 793 nucléotides) a été séquencé par réaction en chaîne de la polymérase (PCR) et clonage moléculaire. Des essais de PCR spécifique et sensible semi-quantitative, quantitative et compétitive, y compris de PCR multiplexe (amplification simultanée de deux ou plusieurs pathogènes dans une même réaction), et des essais de PCR en temps réel ont été conçus pour : 1) évaluer l'intensité (y compris la quantification) de P. marinus chez les huîtres, 2) déterminer la prévalence de l'infection dans les populations d'huître, 3) surveiller les populations d'huître en hibernation, 4) certifier que le naissain d'huître est exempt de maladies, 5) élucider les mécanismes d'infection, 6) évaluer la présence du parasite dans les plans d'eau et les espèces invertébrées et 7) différencier les diverses espèces de Perkinsus (Marsh et al. 1995; Vasta et al. 1997; Penna et al. 1999, 2001; Yarnall et al. 2000; Burreson 2000a; Russell et al. 2000, 2004; Elandalloussi et al. 2004; Abollo et al. 2006; Audemard et al. 2004, 2006; Pecher et al. 2008). Robledo et al. (1998), Yarnall et al. (2000) et Gauthier et al. (2006) ont décrit plusieurs essais de PCR visant à détecter P. marinus, qui se sont révélés plus sensibles que les essais milieu liquide au thioglycollate de Ray (RFTM) (voir la description ci-dessous). La variation génétique entre espèces et au sein d'une même espèce de Perkinsus a permis de concevoir des méthodes de diagnostic moléculaire ciblant le genre ou une espèce (Reece et al. 2001a, b). Toutefois, avant de recommander l'analyse moléculaire (p. ex., la PCR) comme méthode privilégiée de diagnostic de la maladie, il faut approfondir les recherches de façon à valider les différents essais de diagnostic moléculaire et les comparer aux techniques de diagnostic classiques (Burreson 2000a, b; Reece et Burreson 2004; Villalba et al. 2004). Apparemment, l'essai de PCR quantitative en temps réel conçu et validé par De Faveri et al. (2009) était corrélé à la méthode de détection classiques (test en milieu liquide au thioglycollate de Ray RFTM) sans amplification de l'ADN de Perkinsus chesapeaki ou de Perkinsus olseni. La technique LAMP d'amplification isotherme induite par boucle a été utilisée pour cibler la région de l'espaceur transcrit interne 2 (ITS2) conservé du gène de la petite sous-unité de l'ARNr de Perkinsus spp. (Feng et al. 2013). Bien qu'il semble que cet essai LAMP ait été validé au moyen d'échantillons de palourdes prélevés dans les zones côtières de la Chine orientale, connues pour être infectées par Perkinsus olseni, Feng et al. (2013) ont également affirmé avoir détecté P. marinus sur des huîtres importées d'Australie où la présence du parasite n'est pas attestée d'après le Manuel des tests de diagnostic pour les animaux aquatiques de l'Organisation mondiale de la santé animale (OIE) 2013 et la « National List of Reportable Diseases of Aquatic Animals 2011 australienne » (Liste nationale des maladies d'animaux aquatiques à déclaration obligatoire).
Les données de séquence moléculaire jouent un rôle croissant dans l'identification des espèces de Perkinsus, et il faut donc disposer de données de séquence d'ADN adéquates sur les locus ciblés d'une même espèce et des espèces apparentées provenant d'une zone géographique étendue, afin de mettre au point des outils de diagnostic moléculaire fiables, précis et sensibles (Villalba et al. 2004). La différence de 13 % de l'espaceur transcrit interne 1 (ITS1) plus l'espaceur transcrit interne 2 (ITS2) de l'ADNr de la petite sous-unité entre P. marinus et 4 autres isolats de Perkinsus (P. olseni (= atlanticus) provenant de palourdes du Portugal, P. olseni provenant de Anadara trapezia, isolats de Perkinsus sp. provenant de Chamidae et d'arche granuleuse australiennes) constitue une forte indication que le parasite P. marinus de C. virginica est une espèce distincte. Cependant, Brown et al. (2004) ont découvert 14 positions nucléotidiques polymorphiques dans la région de l'espaceur transcrit interne (8 dans ITS1 et 6 dans ITS2) et 12 isolats de P. marinus provenant de la côte atlantique et de la côte américaine du golfe du Mexique et ils ont indiqué l'importance de déterminer la variation génétique de chaque locus avant d'établir un diagnostic moléculaire fondé sur l'analyse de séquences. l'emploi d'une réaction en chaîne de la polymérase pour amplifier jusqu'à six des locus polymorphiques de l'ADN génomique de parasites P. marinus de culture a indiqué que les P. marinus in vitro sont diploïdes et que les huîtres peuvent être infectées par plusieurs souches du parasite (Reece et al. 1997a, c, 1999). Le gène codant pour la protéase à sérine de P. marinus est variable et peut être corrélé à sa virulence ou sa pathogénicité (Brown et Reece 2000, 2001, 2003). Des séquences alléliques ont été identifiées dans des isolats provenant de sites éloignés géographiquement. Toutefois, les fréquences alléliques et génotypiques différaient significativement entre les isolats provenant des régions nord-est et sud-est des côtes américaines de l'Atlantique et du golfe du Mexique (Reece et al. 1999). Les amorces ciblant l'espaceur non-transcrit (NTS), région présentant une variation interspécifique élevée, ont montré une spécificité marquée des espèces (Robledo et al. 1998), bien que des variations intraspécifiques aient été détectées et que la prévalence des deux types décrits variait selon l'origine géographique des échantillons (Robledo et al. 1999). Cependant, comme les variations intraspécifiques dans la région du NTS n'ont pas été évaluées de manière générale, ce qui provoque un risque de faux négatifs résultant du polymorphisme inhérent à une espèce si les amorces de la PCR ne se lient pas à la séquence cible de toutes les souches de l'espèce en question (Villalba et al. 2004). À partir de l'évaluation à haute résolution de marqueurs microsatellites et d'allèles amplifiés directement à partir d'ADN génomique d'huître infectée, Thompson et al. (2011) ont suggéré que P. marinus emploie plusieurs modes de reproduction et qu'à court terme, la sélection agit sur des lignées de parasites indépendantes plutôt que sur des locus spécifiques dans une population cohésive et propice aux croisements. Il reste que la diversité génotypique est l'héritage de l'évolution du sexe chez P. marinus. Les mouvements anthropiques des huîtres infectées pourraient augmenter les occasions de croisement éloigné, ce qui est susceptible d'accélérer l'évolution du parasite (Thompson et al. 2011). d'autres composants du génome de P. marinus ont été décrits, mais à ce jour, aucun n'a été développé en tant que test de diagnostique (Stelter et al. 2007; Fernández-Robledo et al. 2008b; Matsuzaki et al. 2008; Joseph et al. 2010; Zhang et al. 2011 a, b; Hearne et Pitula 2011; Robledo et al. 2011).
Culture
examiner les tissus de prézoosporanges bleu-noir (= hypnospores, généralement de 30-80 µm de diamètre, mais des extrêmes caractérisés par un diamètre de 480 µm ont été observés), après une incubation dans un milieu liquide au thioglycollate (FTM) enrichi selon la méthode de Ray (1966) pendant 7 jours environ, suivie d'une coloration à la solution iodée de Lugol, (consultez Ray 1966, Choi et al. 1989, Fisher et Oliver 1996 et Kim et al. 2006 pour en savoir plus sur cette technique et Nickens et al. 2002 pour une formulation alternative). Cette procédure de diagnostic est souvent désignée par l'expression test (ou technique) en milieu liquide au thioglycollate de Ray (ou encore RFTM de Ray ou RFTM). Bien que ce ne soit pas à proprement parler un bouillon de culture, cette procédure est utilisée dans le diagnostic de nombreuses espèces de Perkinsus, mais elle peut aussi détecter d'autres organismes (Villalba et al. 2004). Les tissus utilisés dans les tests menés dans le cadre des évaluations et de la surveillance du parasite indiquent généralement une tendance saisonnière identique, mais le choix du tissu est important selon l'exactitude requise en cas d'évaluation de la charge corporelle du parasite (Bushek et al. 1994, Oliver et al. 1998b). Des méthodes permettant d'améliorer la détermination de l'intensité de l'infection (charge parasitaire dans toute l'huître) décrite par Fisher et Oliver (1996) ont été proposées par Coates et al. (1999). Le test de Ray en milieu liquide au thioglycollate (RFTM) a servi à quantifier l'intensité de l'infection sans sacrifier l'huître, en déterminant le nombre de parasites dans un échantillon d'hémolymphe (Gauthier et Fisher 1990; Nickens et al. 2000b, 2002). Ellin et Bushek (1999, 2000b, 2006) ont proposé d'employer le test RFTM pour détecter et quantifier le P. marinus planctonique dans des échantillons d'eau prélevés dans le milieu. Cependant, il faudra choisir d'autres méthodes pour déterminer l'identité spécifique des organismes qui se coloreraient par une solution iodée de Lugol suite à une incubation en milieu FTM. Audemard et al. (2008) ont indiqué que l'ADN de P. marinus serait amplifiable à partir d'échantillons traités en milieu liquide au thioglycollate de Ray (RFTM) et colorés par une solution iodée de Lugol. Il est ainsi possible de déterminer l'identité de l'espèce Perkinsus dans un test RFTM tout en ayant l'avantage de conserver les échantillons positifs dans de l'éthanol à 95 % pour les opérations ultérieures d'amplification et de séquençage de l'ADN ou pour les remettre à un laboratoire pouvant appliquer les techniques d'identification moléculaire (Audemard et al. 2008).
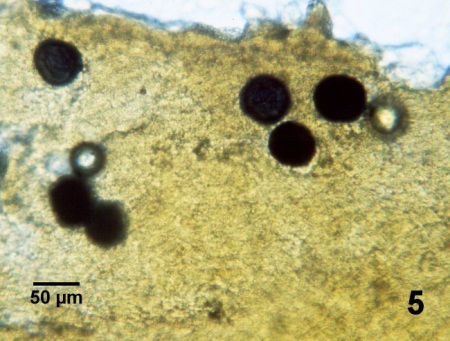
Figure 5. Préparation humide du rectum de Crassostrea virginica traité en milieu RFTM (avec coloration à la solution iodée de Lugol) montrant six prézoosporanges colorés agrandis et foncés (bleu-noir) de Perkinsus marinus.
Les méthodes de propagation in vitro des stades histozoïques de P. marinus ont été décrites par Kleinschuster et Swink (1993), La Peyre et al. (1993), Gauthier et Vasta (1993, 1995), La Peyre et Faisal (1995a, 1995b, 1996), La Peyre (1996) et Soudant et Chu (2001). La Peyre et Chu (1994) ont décrit une procédure simple d'isolation des trophozoïtes de P. marinus (mérozoïtes) d'huîtres C. virginica gravement infectées. La culture in vitro du parasite a permis de mieux connaître sa biologie. Krantz (1994) a utilisé des cultures in vitro pour mettre à l'épreuve l'activité inhibitrice de produits chimiques et pour sélectionner des éventuels agents chimiothérapeutiques. Les parasites Perkinsus marinus cultivés en milieu nutritif étaient sensibles à une faible salinité et le taux de mortalité augmentait quand la salinité chutait sous 12 parties pour mille ou ppm (Burreson et al. 1994b). En cultivant P. marinus dans des milieux à osmolarité différente (de 168 à 737 mOsm, soit de 6,5 de 27,0 ppm), O'Farrell et al. (2000) ont déterminé que la taille des stades végétatifs de P. marinus variait selon l'osmolarité et que les cellules cultivées à une faible osmolarité résistaient au stress hypoosmotique (56 mOsm – 2,5 ppm) et hyperosmotique (672 mOsm – 24,7 ppm) (taux de mortalité de 41 % à 2,5 ppm) alors que dans les cellules cultivées à une osmolarité élevée, une mortalité de 100 % était constatée après leur transfert dans de l'eau de mer artificielle hypoosmotique. La Peyre et al. (2006) ont observé que la viabilité de P. marinus était réduite à 7 ppm, et même après son acclimatation. Lund et al. (2004) ont constaté que dans les milieux de culture, les traitements à différents degrés de salinité (environ 14, 20 et 28 ppm) produisaient peu d'effets, mais que la température avait une incidence significative sur la prolifération cellulaire, la teneur en acides gras et les taux de synthèse des acides gras (c.-à-d., les taux de synthèse des acides gras doublaient approximativement à chaque tranche d'augmentation de 10 °C). Ford et Chintala (2006) ont utilisé des données produites in vitro pour tester l'hypothèse selon laquelle l'expansion de P. marinus vers le Nord était liée à une souche du parasite adaptée aux basses températures. Ils n'ont trouvé aucun élément montrant l'adaptation de P. marinus aux températures basses, car les taux de prolifération nets des isolats étaient semblables à des températures allant de 5 à 20 °C. En revanche, à des températures de 25 à 35 °C, les isolats de la Caroline du Sud présentaient des taux de prolifération plus élevés que les isolats du Nord, ce qui suggère que les souches du parasite fréquemment exposées à des températures élevées s'y adaptent. La Peyre et al. (2008b) ont déterminé que la viabilité de P. marinus était de 49 % après une exposition de 30 jours à une température de 4 °C, mais que son activité métabolique était limitée et sa prolifération nulle, ce qui pourrait expliquer en partie la diminution de l'intensité des infections parasitaires chez C. virginica pendant les mois de l'année les plus froids. À partir d'essais in vitro, Soudant et Chu (2001) ont déterminé que pendant la prolifération de trophozoïtes immatures, P. marinus synthétise certains acides gras et classes lipidiques, mais que pour se développer du stade de trophozoïte immature à celui de prézoosporange, le parasite dépendrait de l'hôte pour se procurer des ressources lipidiques. Par exemple, Lund et al. (2007) ont ainsi suggéré que P. marinus ne pouvait pas synthétiser les stérols et qu'il devait les accaparer de son hôte. De plus, des extraits d'hémolymphe de C. ariakensis, C. gigas et d'espèces de mollusques autres que des huîtres diminuaient significativement la prolifération in vitro par rapport aux extraits de C. virginica (Gauthier et Vasta 2002, Brown et al. 2005). Les extraits de tissu de C. virginica causaient chez P. marinus la sécrétion de quantités élevées d'un ensemble de sérines protéases à faible poids moléculaire (30–45 kDa) qui n'étaient pas régulées positivement par les extraits de C. gigas et de C. ariakensis (MacIntyre et al. 2003).
La formule d'un milieu de culture nécessitait 5 % de sérum fœtal de veau, mais des concentrations plus élevées réduisaient considérablement la prolifération parasitaire de manière proportionnelle à la dose, en raison de la présence de transferrine (agent chélateur naturel du fer) dans le sérum, qui accapare le fer disponible et inhibe ainsi la croissance de P. marinus (Gauthier et Vasta 1994). Dungan et Hamilton (1995) ont décrit un test de prolifération cellulaire in vitro au tétrazolium pour la surveillance des effets des conditions sur la multiplication de P. marinus. Shridhar et al. (2013) ont adapté un test commercialisé fondé sur la concentration en adénosine triphosphate (ATP) pour évaluer la prolifération in vitro de P. marinus dans une plaque de microtitrage à 96 puits et ont validé la méthode en mesurant les effets des composés antiprolifératifs potentiels. La Peyre et Faisal (1997b) ont décrit un milieu de culture défini chimiquement exempt de protéines, qu'ils ont jugé adapté à l'étude des protéines de P. marinus, pour produire des antigènes pour la production d'anticorps et sélectionner les agents chimiothérapeutiques. Bushek et al. (2000a) ont décrit une technique de clonage de P. marinus par micromanipulation et au moyen d'une « couche nourricière ».
Les parasites Perkinsus marinus produits in vitro infectaient les huîtres s'ils leur étaient transmis par injection dans la cavité de la coquille ou le muscle adducteur, mais pas par voie alimentaire. Ford et al. (2002) ont montré que la virulence était immédiatement perdue en milieu de culture et que le fait de faire repasser des parasites P. marinus de culture par des huîtres ne leur redonnait pas leur virulence. De plus, les P. marinus des cultures en phase de croissance logarithmique étaient significativement plus virulents que ceux des cultures en phase décalée ou en phase stationnaire (Ford et al. 2002, Chintala et al. 2002). Bien que la pathogénicité des parasites P. marinus de culture semble faible (Bushek et al. 1997a, 2002b), l'enrichissement des cultures par du plasma d'huître ou des homogénats tissulaires semblait augmenter l'infectiosité (Earnhart et al. 2004) et conduit à des changements marqués de la morphologie cellulaire de P. marinus, comparables à ceux observés chez les huîtres infectées naturellement (MacIntyre et al. 2003). Shaheen (1999) a montré que P. marinus pouvait survivre dans de l'eau de mer artificielle à une salinité de 22 ppm et à 27 °C pendant plus de 6 semaines sans apport exogène de nutriments. Des isolats cryoconservés de P. marinus sont disponibles à l'American Type Culture Collection (ATCC, Rockville, Maryland, États-Unis).
Méthodes de lutte antiparasitaire
Les huîtres provenant de zones où la maladie a été déclarée ne devraient pas être importées au Canada. Perkinsus marinus se transmet facilement entre huîtres, c'est pourquoi il est impératif d'éviter le transfert d'huîtres infectées dans une zone abritant des huîtres non infectées (Ford et Tripp 1996). À ce jour, l'éradication s'est révélée impossible. Les méthodes de gestion visant à réduire les incidences économiques de la maladie des populations infectées consistent à réduire la densité des huîtres et à pêcher les huîtres ou à les déplacer dans des zones à faible salinité (inférieure à 9 ppm [Ragone et Burreson 1993]) avant que la température de l'eau n'atteigne 15 à 20 °C (il se peut toutefois que les infections persistent pendant des années dans des zones à faible salinité [Burreson et Ragone Calvo 1996]). d'après les résultats d'expériences menées in vitro sur des parasites P. marinus mis en culture à différentes salinités, O'Farrell et al. (2000) ont suggéré que le transfert d'huîtres infectées vers des zones à faible salinité causerait l'acclimatation de souches de P. marinus aux salinités faibles et elles seraient capable de résister à des événements périodiques de salinité extrêmement faible. c'est pourquoi la prudence est de rigueur en cas de recours à des zones de faible salinité pour le traitement ou le contrôle de l'infection ou de la maladie (Paynter et Burreson 1991). Toutefois, des événements de salinité faible (courant d'eau douce) répétés et produits en temps opportun peuvent prévenir l'infection ou du moins maintenir P. marinus à des intensités non létales, ce qui fait du contrôle des apports en eau douce une approche possible de gestion adaptative (Mackin 1955, La Peyre et al. 2003, 2009). En effet, il a été constaté que les événements de faible salinité (inférieure à 5 ppm) diminuent l'intensité des infections à P. marinus, même si les températures sont supérieures à 20 °C (La Peyre et al. 2009). Les autorités des zones côtières texanes se sont servies de cette relation entre P. marinus et la salinité comme indicateur biologique pour définir les apports minimaux en eau douce (Culbertson et al. 2011). Cependant, Fisher et al. (1992) et Chu et Volety (1997b) ont constaté que la température (entre 10 °C et 28 °C) était un facteur ayant une plus forte influence que la salinité (3 à 39 ppm) sur la vulnérabilité de l'huître à P. marinus, de l'intensité des infections à P. marinus et de la mortalité des huîtres. l'analyse de la relation entre les changements de la salinité connexes du changement climatique et les changements de la prévalence et l'intensité de la maladie a permis de proposer une méthode de prévision des épizooties de P. marinus à partir des modèles climatiques, qui serait utilisable dans la gestion des populations d'huîtres (Soniat et al. 2006).
Chu et Greene (1989) ont utilisé des prézoosporanges et des zoospores obtenus à partir d'un test en milieu au thyoglycollate de Ray (RFTM) pour déterminer les prézoosporanges qui ne peuvent résister à des températures inférieures ou égales à 4 °C pendant plus de 4 jours; les zoospores mouraient dans un délai d'un jour quand elles étaient transférées de 28 à 4 °C. Les températures hivernales froides pourraient limiter la propagation naturelle de l'agent pathogène vers les zones septentrionales (déclins de l'infection sous 15-20 °C). Toutefois, les huîtres conservées pendant 11 semaines à 15 °C, une température considérée comme plus propice aux hémocytes d'huître qu'à P. marinus, n'ont pu éliminer les infections (Ford et al. 1999). Dans les zones d'enzootie, les stratégies conçues pour augmenter ou compléter le recrutement naturel de l'huître, tout en évitant l'introduction de P. marinus dans les zones de croissance par une limitation de la transplantation d'huîtres, semblent les plus prometteuses à l'heure actuelle pour la préservation des stocks exploitables sur le plan commercial (Krantz et Jordan 1996). Paynter et al. (2010) ont déterminé que les huîtres juvéniles produites en écloserie dans le Maryland entre 1995 et 2009, ont suffisamment cru pour atteindre leur taille marchande en 2 à 3 ans et que les taux d'infection à P. marinus étaient faibles. Ainsi, ils ont suggéré que la mortalité due à la maladie menacerait rarement l'ostréiculture dans la région (Paynter et al. 2010). Les stratégies de gestion des gisements mis en jachère après prélèvement des huîtres infectées ne se sont pas montrées efficaces dans certaines zones, mais il serait plus faisable de recourir à un prélèvement précoce pour éviter les mortalités causées par P. marinus (Butsic et al. 2000). La Peyre et al. (2008a) ont suggéré que les huîtres élevées en suspension sur des filières et exposées quotidiennement à l'air présentaient un taux de survie et des indices de condition plus élevés. Ford et al. (2000c, 2001) ont démontré que les huîtres juvéniles (embryons) des nurseries utilisant de l'eau brute pompée à partir d'une zone d'enzootie sont très susceptibles d'être infectées, mais que la prévalence et l'intensité des infections seraient très faibles. Le traitement de l'eau brute par filtration à 1 µm puis l'exposition à des rayons ultraviolets (exposition à un rayonnement UV de 30 000 µW s-1 cm-2) contribue à protéger de l'infection les embryions produits en écloserie (Ford et al. 2001). Il est possible que l'implantation d'huîtres C. virginica ne portant pas l'agent pathogène visé dans les zones d'enzootie ne réduise ni l'infection ni les mortalités connexes, et que la réussite de la production dépendrait finalement du régime de salinité connu par les huîtres pendant leur grossissement (Albright et al. 2007).
Des études cherchant à identifier des stocks de Crassostrea virginica résistants à Perkinsus marinus sont en cours (Bushek et Allen 1996a, b; Stickler et al. 2001; Encomio et al. 2005, Wang et Guo 2008). Certaines souches de C. virginica résistantes à la maladie présentaient des taux de croissance et de survie supérieurs à ceux des autres souches (Abbe et al. 2010) et les huîtres sauvages provenant de lieux vulnérables à la maladie pourraient contribuer au renforcement de la résistance à la maladie chez les huîtres d'élevage (Roberts et al. 2008). Bien que les stocks sélectionnés pour leur résistance à d'autres agents pathogènes (c.-à-d., Haplosporidian nelsoni) étaient très vulnérables à P. marinus (Burreson 1991). Une double résistance aux deux parasites a été obtenue après quatre générations de sélection artificielle dans une zone où les deux maladies étaient enzootiques (cours inférieur de la York River en Virginie, États-Unis) (Ragone Calvo et al. 2003a). Par ailleurs, les hybrides de stocks de C. virginica développés pour leur résistance à P. marinus, H. nelsoni et Roseovarius sp. semblaient avoir un rendement satisfaisant face à l'exposition à plusieurs maladies (Rawson et al. 2008). Yu et Guo (2006) ont détecté des changements de fréquence génotypique post-mortalité liés aux locus de caractères quantitatifs (QTL) de résistance à la mortalité estivale et à la perkinsose et ont avancé que ces locus de caractères quantitatifs étaient des régions génomiques dont l'analyse doit être approfondie pour comprendre les mécanismes génétiques de la résistance à la maladie et pour développer des stocks d'élevage génétiquement améliorés. Powell et al. (2011) se sont appuyés sur un modèle génétique de dynamique des populations pour évaluer le développement apparemment limité de la résistance à P. marinus chez C. virginica. Ils ont ainsi déterminé que le taux de mortalité qui limitait le développement de cette résistance à la maladie continuait de peser sur la capacité de l'espèce à maintenir la vitalité de ses populations pour sa survie à long terme. Plus précisément, l'introduction réduite de larves vulnérables pourrait suffire à neutraliser tout avantage sélectif acquis par un taux de mortalité épizootique de 20 à 25 %.
À partir des résultats d'études in vitro et in vivo, Faisal et al. (1999) ont supposé que la bacitracine (antibiotique de la famille des polypeptides, cyclopeptide ramifié produit par Bacillus licheniformis et B. subtilis, utilisé dans le traitement de diverses infections bactériennes et protozooses chez les vertébrés) serait prometteuse pour la chimiothérapie de P. marinus. Lund et al. (2005) et Chu et al. (2008) ont suggéré que l'antimicrobien Triclosan (5-chloro-2-(2,4 dichlorophenoxy) phénol, un inhibiteur spécifique de FAB 1 (énoyl-ACP réductase), une enzyme de la classe de Type II des ligases d'acides gras) pourrait traiter efficacement les huîtres infectées par P. marinus. En revanche, la quinine (traitement préventif et curatif classique des parasites porteurs de la malaria Plasmodium spp.) était létale chez les huîtres infectées à des concentrations inférieures aux concentrations effectives de trophozoïtes (mérontes) de P. marinus in vitro ou n'avait aucun effet observable sur les infections par le parasite (Panko et al. 2008). Shridhar et al. (2013) ont adapté un test commercialisé fondé sur un dosage de l'adénosine triphosphate (ATP) par bioluminescence qu'ils ont utilisé pour évaluer les effets in vitro de plusieurs traitements antiprolifératifs possibles contre P. marinus. Foster et al. (2011) ont suggéré que la capacité du cuivre (CuCl2) à nettement réduire les taux d'infection à P. marinus dans les hémocytes in vivo pourrait être utilisée comme agent thérapeutique potentiel contre la perkinsose dans des élevages aquacoles.
Bien que l'eau de mer filtrée enrichie en eau de Javel avec des concentrations de chlore dilué de 300 parties par million ait tué P. marinus en 30 minutes, la tolérance au chlore de P. marinus en milieu de culture était significativement plus élevée. En effet, dans les tissus le parasite survivait à une exposition au chlore à 2 100 parties par million, ce qui faisait perdre toute efficacité au traitement au chlore du matériel contaminé par P. marinus (Bushek et al. 1997b, c). La quarantaine des coquilles d'huîtres hors de l'eau pendant un mois peut considérablement diminuer le risque de propagation de P. marinus si des coquilles d'huîtres provenant des zones contaminées (p. ex., du collecteur de naissain) sont utilisées (Bushek et al. 2004). Il semblerait qu'une heure d'exposition à l'eau douce ou une heure d'incubation de parasites de culture dans de l'eau de mer ou un milieu de culture à 50 °C tue P. marinus, mais qu'une heure à 60 °C serait nécessaire pour tuer les parasites dans les tissus (Bushek et al. 1997b, c). Bushek et Howell (2000) ont indiqué qu'il serait possible d'utiliser des stérilisateurs UV comme moyen pratique et économique pour le traitement des effluents et la prévention, ou de la minimisation, de la transmission de P. marinus aux populations d'huîtres locales par les huîtres infectées se trouvant dans diverses installations, notamment les usines de transformation, les installations de purification, les écloseries, les laboratoires, etc. Des doses faibles à moyennes de rayonnement ultraviolet (4 000 à 14 000 μWs/cm2) inhibaient la prolifération de P. marinus et des doses plus élevées (supérieures à 28 000 μWs/cm2) causaient la mort du parasite. Plus le dosage était élevé, plus la stérilisation était efficace (Bushek et Howell 2000). Des désinfectants organiques à la N-haolamine (jusqu'à 25 mg/L pour une exposition de 12 h maximum, selon la formule chimique utilisée) peuvent également servir à désinfecter l'eau de mer contaminée par P. marinus (Delaney et al. 2003).
La prolifération saisonnière de P. marinus a été modélisée pour estimer la durée nécessaire pour atteindre des taux critiques et la durée de l'infection chez C. virginica (Hofmann et al. 1995, 1999; Soniat et Kortright 1998; Brewster et al. 1999, 2000; Ragone Calvo et Burreson 2000; Brousseau et Baglivo 2000a, b; Ragone Calvo et al. 2001). Un des modèles a été développé en programme internet permettant de calculer la durée nécessaire pour atteindre des niveaux critiques de maladie (Soniat et al. 2000, Ray et al. 2001; voir la publicité dans Scarratt 2000). Les simulations du modèle conçu par Hofmann et al. (1999) pourraient servir à comprendre les causes de la propagation de la maladie vers le nord et à restructurer les pratiques de l'ostréiculture de façon à maximiser la production dans des conditions où la durée de vie des espèces commercialisées est tributaire de la maladie. Le modèle de Ragone Calvo et al. (2001) suggère qu'un seul événement de transmission pourrait suffire à ce que P. marinus soit enzootique chez une classe d'âge précise d'huîtres se trouvant dans des zones à la salinité moyenne à élevée, mais qu'il faudrait plusieurs événements de transmission périodiques pour que le parasite persiste dans les zones à faible salinité. Les études de terrain réalisées par McCollough et al. (2007) ont confirmé le développement d'épizooties dans les huit semaines suivant une exposition à des facteurs locaux d'infection; ils ont détecté les premières infections simultanément chez plus de 62 % des huîtres C. virginica juvéniles exemptes du pathogène, implantées expérimentalement dans une zone mésohaline enzootique. Un modèle de gestion de l'ostréiculture à des périodes où la maladie est un facteur déterminant a été développé et évalué sur des populations d'huîtres affectées par P. marinus (Klink et al. 2001). Jordan (1995) a utilisé une analyse de partitionnement des données (classification multivariée) pour évaluer la structure des populations d'huître et la dynamique de la maladie chez certaines populations de C. virginica du Maryland.
Référence bibliographique
Abbe, G.R., C.B. McCollough, L.S. Barker et C.F. Dungan. 2010. Performance of disease-tolerant strains of eastern oyster (Crassostrea virginica) in the Patuxent River, Maryland, 2003 to 2007. Journal of Shellfish Research 29: 161-175.
Abollo, E., S.M. Casas, G. Ceschia et A. Villalba. 2006. Differential diagnosis of Perkinsus species by polymerase chain reaction-restriction fragment length polymorphism assay. Molecular and Cellular Probes 20: 323-329.
Aguirre-Macedo, M.L., R.A. Simá-Álvarez, M.K. Román-Magaña et J.I. Güemez-Ricalde. 2007. Parasite survey of the Eastern oyster Crassostrea virginica in coastal lagoons of the southern Gulf of Mexico. Journal of Aquatic Animal Health 19: 270–279.
Ahmed, H., E.J. Schott, D.J. Gauthier et G.R. Vasta. 2003. Superoxide dismutases from the oyster parasite Perkinsus marinus: purification, biochemical characterization, and development of a plate microassay for activity. Analytical Biochemistry 318: 132-141.
Albright, B.W. et G.R. Abbe. 1999. Recent trends in infection of the eastern oyster Crassostrea virginica by the parasite Perkinsus marinus in the Patuxent River estuary. Journal of Shellfish Research 18: 317. (Résumé).
Albright, B.W., G.R. Abbe, C.B. McCollough, L.S. Barker et C.F. Dungan. 2007. Growth and mortality of dermo-disease-free juvenile oysters (Crassostrea virginica) at three salinity regimes in an enzootic area of Chesapeake Bay. Journal of Shellfish Research 26: 451-463.
Alderman, D.J. et P. Gras. 1969. "Gill Disease" of Portuguese oysters. Nature 224: 616-617.
Allam, B., W.E. Carden, J.E. Ward, G. Ralph, S. Winnicki et E.P. Espinosa. 2013. Early host-pathogen interactions in marine bivalves: Evidence that the alveolate parasite Perkinsus marinus infects through the oyster mantle during rejection of pseudofeces. Journal of Invertebrate Pathology 113: 26-34.
Anderson, R.S. 1996. Interactions of Perkinsus marinus with humoral factors and hemocytes of Crassostrea virginica. Journal of Shellfish Research 15: 127-134.
Anderson, R.S. 1999a. Lack of hemocyte chemiluminescence stimulation by Perkinsus marinus in eastern oysters Crassostrea virginica with dermo disease. Journal of Aquatic Animal Health 11: 179–182.
Anderson, R.S. 1999b. Perkinsus marinus secretory products modulate superoxide anion production by oyster (Crassostrea virginica) haemocytes. Fish and Shellfish Immunology 9: 51-60.
Anderson, R.S. et A.E. Beaven. 2000. Antimicrobial activity in cell-free hemolymph of oysters and mussels. Journal of Shellfish Research 19: 641. (Résumé).
Anderson, R.S. et A.E. Beaven. 2001. A comparative study of anti-Perkinsus marinus activity in bivalve sera. Journal of Shellfish Research 20: 1011-1017.
Anderson, R.S., K.T. Paynter et E.M. Burreson. 1992. Increased reactive oxygen intermediate production by hemocytes withdrawn from Crassostrea virginica infected with Perkinsus marinus. The Biological Bulletin (Woods Hole, Mass.) 183: 476-481.
Anderson, R.S., L.L. Brubacher, L.M. Mora, K.T. Paynter et E.M. Burreson. 1993. Hemocyte responses in Crassostrea virginica infected with Perkinsus marinus. Journal of Shellfish Research 12: 135. (Résumé).
Anderson, R.S., E.M. Burreson et K.T. Paynter. 1995. Defense responses of hemocytes withdrawn from Crassostrea virginica infected with Perkinsus marinus. Journal of Invertebrate Pathology 66: 82-89.
Anderson, R.S., M.A. Unger et E.M. Burreson. 1996. Enhancement of Perkinsus marinus disease progression in TBT-exposed oysters (Crassostrea virginica). Marine Environmental Research 42: 177-180.
Andrews, J.D. 1988. Epizootiology of the disease caused by the oyster pathogen Perkinsus marinus and its effects on the oyster industry. American Fisheries Society Special Publication 18: 47-63.
Andrews, J.D. 1996. History of Perkinsus marinus, a pathogen of oysters in Chesapeake Bay 1950-1984. Journal of Shellfish Research 15: 13-16.
Andrews, J.D. et S.M. Ray. 1988. Management strategies to control the disease caused by Perkinsus marinus. American Fisheries Society Special Publication 18: 257-264.
Asojo, O.A., E.J. Schott, G.R. Vasta et A.M. Silva. 2006. Structures of PmSOD1 and PmSOD2, two superoxide dismutases from the protozoan parasite Perkinsus marinus. Structural Biology and Crystallization Communications, Section F, Acta Crystallographica 62: 1072-1075.
Audemard, C., K.S. Reece et E.M. Burreson. 2004. Real-time PCR for detection and quantification of the protistan parasite Perkinsus marinus in environmental waters. Applied and Environmental Microbiology 70: 6611-6618.
Audemard, C., L.M. Ragone Calvo, K.T. Paynter, K.S. Reece et E.M. Burreson. 2006. Real-time PCR investigation of parasite ecology: in situ determination of oyster parasite Perkinsus marinus transmission dynamics in lower Chesapeake Bay. Parasitology 132: 827-842.
Audemard, C., R.B. Carnegie et E.M. Burreson. 2008. Shellfish tissue evaluation for Perkinsus spp. using the Ray's fluid thioglycollate medium culture assay can be used for downstream molecular assays. Diseases of Aquatic Organisms 80: 235-239.
Barber, B.J. 1996. Gametogenesis of eastern oysters, Crassostrea virginica (Gmelin, 1791), and Pacific oysters, Crassostrea gigas (Thunberg, 1793) in disease-endemic lower Chesapeake Bay. Journal of Shellfish Research 15: 285-290.
Barber, B.J. et R. Mann. 1991. Sterile triploid Crassostrea virginica (Gmelin, 1791) grow faster than diploids but are equally susceptible to Perkinsus marinus. Journal of Shellfish Research 10: 445-450.
Barber, B.J. et R. Mann. 1994. Growth and mortality of eastern oysters, Crassostrea virginica (Gmelin, 1791), and Pacific oysters, Crassostrea gigas (Thunberg, 1793) under challenge from the parasite, Perkinsus marinus. Journal of Shellfish Research 13: 109-114.
Bobo, M.Y., J.J. Manzi et V.G. Burrell. 1988. Perkinsus marinus: temporal and environmental aspects of infection in South Carolina oyster populations. Journal of Shellfish Research 7: 571. (Résumé).
Bower, S., E. Burreson et K. Reece. 2003. Annex 10: Review of molecular techniques used to differentiate the various species/isolates of Perkinsus. Report of the Working Group on Pathology and Diseases of Marine Organisms, Aberdeen, UK, 11-15 March 2003. Mariculture Committee, ICES CM 2003/F:03, Ref. ACME, pg. 54-60.
Brandão, R.P., G. Boehs, R.C. Sabry, L.O. Ceuta, M.d.S.A. Luz, F.R. Queiroga et P.M. da Silva. 2013. Perkinsus sp. infecting oyster Crassostrea rhizophorae (Guilding, 1828) on the coast of Bahia, Brazil. Journal of Invertebrate Pathology 112: 138-141.
Brewster, J., D. Bushek et R.F. Dame. 1999. An ecosystem model of Perkinsus marinus. Journal of Shellfish Research 18: 326-327. (Résumé).
Brewster, J., D. Bushek et R. Dame. 2000. Perkinsus marinus population dynamics in North Inlet, South Carolina - an ecosystem model. Journal of Shellfish Research 19: 660. (Résumé).
Breitburg, D., D. Hondorp, C. Audemard, R. Carnegie, R. Burrell et V. Clark. 2011. Breathless nights: diel-cycling hypoxia and the prevalence of Perkinsus marinus (Dermo) infections in Chesapeake Bay oysters. Journal of Shellfish Research 30: 488. (Résumé).
Brousseau, D.J. 1996. Epizootiology of the parasite, Perkinsus marinus (Dermo) in interdial oyster populations from Long Island Sound. Journal of Shellfish Research 15: 583-587.
Brousseau, D.J. et J.A. Baglivo. 2000a. Modeling seasonal proliferation of the parasite, Perkinsus marinus (Dermo) in field populations of the oyster, Crassostrea virginica. Journal of Shellfish Research 19: 133-138.
Brousseau, D.J. et J.A. Baglivo. 2000b. Perkinsus disease progression in field oysters: a modeling study. Journal of Shellfish Research 19: 660. (Résumé).
Brousseau, D.J., J.C. Guedes, C.A. Lakatos, G.R. Lecleir et R.L. Pinsonneault. 1998. A comprehensive survey of Long Island Sound oysters for the presence of the parasite, Perkinsus marinus. Journal of Shellfish Research 17: 255-258.
Brown, G.D. et K.S. Reese. 2000. Identification of a serine protease gene in Perkinsus marinus. Journal of Shellfish Research 19: 660. (Résumé).
Brown, G.D. et K.S. Reece. 2001. Variations in serine protease gene(s) among Perkinsus marinus isolates. Journal of Shellfish Research 20: 538. (Résumé).
Brown, G.D. et K.S. Reece. 2003. Isolation and characterization of serine protease gene(s) from Perkinsus marinus. Diseases of Aquatic Organisms 57: 117-126.
Brown, D.C., B.P. Bradley et K.T. Paynter. 1993. The physiological effects of protozoan parasitism on the eastern oyster, Crassostrea virginica: induction of stress proteins. Journal of Shellfish Research 12: 135-136. (Résumé).
Brown, G.D., S. Kotob et M. Faisal. 1999. Diversity among Perkinsus marinus isolates from the Chesapeake Bay. Journal of Shellfish Research 18: 317. (Résumé).
Brown, G.D., K.L. Hudson et K.S. Reece. 2004. Multiple polymorphic sites at the ITS and ATAN loci in cultured isolates of Perkinsus marinus. Journal of Eukaryotic Microbiology 51: 312–320.
Brown, G.D., S.L. Kaattari et K.S. Reece. 2005. Effect of homogenate from different oyster species on Perkinsus marinus proliferation and subtilisin gene transcription. Journal of Shellfish Research 24: 1027-1033.
Burrell, V.G., M.Y. Bobo et J.J. Manzi. 1984. A comparison of seasonal incidence and intensity of Perkinsus marinus between subtidal and intertidal oyster populations in South Carolina. Journal of the World Mariculture Society 15: 301-309.
Burreson, E.M. 1991. Effects of Perkinsus marinus infection in the eastern oyster, Crassostrea virginica: I. Susceptibility of native and MSX-resistant stocks. Journal of Shellfish Research 10: 417-423.
Burreson, E.M. 2000a. Molecular diagnostics for the oyster pathogens Haplosporidium nelsoni (MSX disease) and Perkinsus marinus (Dermo disease) in Chesapeake Bay, Virginia, USA. In: Walker, P. and R. Subasinghe (eds.) DNA-based Molecular Diagnostic Techniques. Research Needs for Standardization and Validation of the Detection of Aquatic Animal Pathogens and Diseases. FAO Fisheries Technical Paper. No. 395: 71-78, (Pour consulter la publication FAO Technical Paper No. 395 pour le document par by Burreson voir http://www.fao.org/docrep/005/X4946E/x4946e0i.htm#bm18). (en anglais seulement)
Burreson, E.M. 2000b. Disease diagnosis by PCR: foolproof or fool hardy? Journal of Shellfish Research 19: 642. (Résumé).
Burreson, E.M. et L.M. Ragone Calvo. 1996. Epizootiology of Perkinsus marinus disease of oysters in Chesapeake Bay, with emphasis on data since 1985. Journal of Shellfish Research 15: 17-34.
Burreson, E.M., R.S. Alvarez, V.V. Martinez et L.A. Macedo. 1994a. Perkinsus marinus (Apicomplexa) as a potential source of oyster Crassostrea virginica mortality in coastal lagoons of Tabasco, Mexico. Diseases of Aquatic Organisms 20: 77-82.
Burreson, E.M., L.M. Ragone Calvo, J.F. La Peyre, F. Counts et K.T. Paynter. 1994b. Acute osmotic tolerance of cultured cells of the oyster pathogen Perkinsus marinus (Apicomplexa: Perkinsida). Comparative Biochemistry and Physiology 109A: 575-582.
Bushek, D. et S.K. Allen. 1996a. Host-parasite interactions among broadly distributed populations of the eastern oyster Crassostrea virginica and the protozoan Perkinsus marinus. Marine Ecology Progress Series 139: 127-141.
Bushek, D. et S.K. Allen. 1996b. Races of Perkinsus marinus. Journal of Shellfish Research 15: 103-107.
Bushek, D. et T.L. Howell. 2000. The effect of UV irradiation on Perkinsus marinus and its potential use to reduce transmission via shellfish effluents. Northeastern Regional Aquaculture Center (NRAC) Publication No. 00-008. North Dartmouth, Massachusetts, USA, 5p.
Bushek, D., S.E. Ford et S.K. Allen. 1994. Evaluation of methods using Ray's fluid thioglycollate medium for diagnosis of Perkinsus marinus infection in the eastern oyster, Crassostrea virginica. Annual Review of Fish Diseases 4: 201-217.
Bushek, D., S.K. Allen, K.A. Alcox, R.G. Gustafson et S.E. Ford. 1997a. Response of Crassostrea virginica to in vitro cultured Perkinsus marinus: preliminary comparisons of three inoculation methods. Journal of Shellfish Research 16: 479-485.
Bushek, D., R. Holley et M. Kelly. 1997b. Chlorine tolerance of Perkinsus marinus. Journal of Shellfish Research 16: 260. (Résumé).
Bushek, D., R. Holley et M. Kelly. 1997c. Treatment of Perkinsus marinus-contaminated materials. Journal of Shellfish Research 16: 330. (Résumé).
Bushek, D., A.J. Erskine, R.F. Dame, L.D. Coen et N. Hadley. 1999. Transmission of Perkinsus marinus to intertidal oysters. Journal of Shellfish Research 18: 317-318. (Résumé).
Bushek, D., R.A. Holley et K.S. Reece. 2000a. Use of micromanipulation and "feeder layers" to clone the oyster parthogen Perkinsus marinus. Journal of Eukaryotic Microbiology 47: 164-166.
Bushek, D., J. Keesee, B. Jones, D. White, J. Neet et D. Porter. 2000b. Shellfish health management: a system level perspective for Perkinsus marinus. Journal of Shellfish Research 19: 642-643. (Résumé).
Bushek, D., C.F. Dungan et A.J. Lewitus. 2002a. Serological affinities of the oyster pathogen Perkinsus marinus (Apicomplexa) with some dinoflagellates (Dinophyceae). The Journal of Eukaryotic Microbiology 49: 11-16.
Bushek, D., S.E. Ford et M.M. Chintala. 2002b. Comparison of in vitro-cultured and wild type Perkinsus marinus. III. Fecal elimination and its role in transmission. Diseases of Aquatic Organisms 51: 217-225.
Bushek, D., J. Scarpa et S.E. Laramore. 2002c. Susceptibility of the Caribbean oyster Crassostrea rhizophorae to Perkinsus marinus. Journal of Shellfish Research 21: 371-372. (Résumé).
Bushek, D., D. Richardson, M.Y. Bobo et L.D. Coan. 2004. Quarantine of oyster shell cultch reduces the abundance of Perkinsus marinus. Journal of Shellfish Research 23: 369-373.
Bushek, D., M. Heidenreich et D. Porter. 2007. The effects of several common anthropogenic contaminants on proliferation of the parasitic oyster pathogen Perkinsus marinus. Marine Environmental Research 64: 535-540.
Butsic, E., R. Dame et D. Bushek. 2000. The effects of oyster removal on intensities of Perkinsus marinus infections in native oyster populations. Journal of Shellfish Research 19: 661. (Résumé).
Cáceres-Martínez, J., R. Vásquez-Yeomans, G. Padilla-Lardizábal et M.A. del Río Portilla. 2008. Perkinsus marinus in pleasure oyster Crassostrea corteziensis from Nayarit, Pacific coast of México. Journal of Invertebrate Pathology 99: 66-73.
Cáceres-Martínez, J., R. Vásquez-Yeomans etd G. Padilla-Lardizábal. 2010. Parasites of the pleasure oyster Crassostrea corteziensis cultured in Nayarit, Mexico. Journal of Aquatic Animal Health 22: 141-151.
Cáceres-Martínez, J., M.G. Ortega, R. Vásquez-Yeomans, T.J.P. García, N.A. Stokes et R.B. Carnegie. 2012. Natural and cultured populations of the mangrove oyster Saccostrea palmula from Sinaloa, Mexico, infected by Perkinsus marinus. Journal of Invertebrate Pathology 110: 321-325.
Calvo, G.W. et E.M. Burreson. 1994. In vitro and in vivo effects of eight chemotherapeutants on the oyster parasite Perkinsus marinus (Mackin, Owen, and Collier). Journal of Shellfish Research 13: 101-107.
Calvo, G.W., M.W. Luckenbach, S.K. Allen Jr et E.M. Burreson. 1999. Comparative field study of Crassostrea gigas (Thunberg, 1793) and Crassostrea virginica (Gmelin 1791) in relation to salinity in Virginia. Journal of Shellfish Research 18: 465-473.
Calvo, G.W., M.W. Luckenbach et E.M. Burreson. 2000. High Performance of Crassostrea ariakensis in Chesapeake Bay. Journal of Shellfish Research 19: 643. (Résumé).
Calvo, G.W., M.W. Luckenbach, S.K. Allen Jr et E.M. Burreson. 2001. A comparative field study of Crassostrea ariakensis (Fujita 1913) and Crassostrea virginica (Gmelin 1791) in relation to salinity in Virginia. Journal of Shellfish Research 20: 221-229.
Carnegie, R. et E.M. Burreson. 2008. Factors contributing to the persistence of Crassostrea virginica populations in disease intense Virginia waters. Journal of Shellfish Research 27: 994. (Résumé).
Carnegie, R. et E.M. Burreson. 2011a. Impacts of Hematodinium nelsoni and Perkinsus marinus on gametogensis and spawning of Crassostrea virginica in Chesapeake Bay. Journal of Shellfish Research 30: 492. (Résumé).
Carnegie, R. et E.M. Burreson. 2011b. Evolutionary ecology of eastern oyster Crassostrea virginica and its parasites. Journal of Shellfish Research 30: 492. (Résumé).
Cheng, T.C. et J.J. Manzi. 1996. Correlation between the presence of lathyrose with the absence of Haplosporidium nelsoni in Crassostrea virginica from two South Carolina tributaries where Perkinsus marinus also inhibits hemocyte agglutination by the Lathyrus odoratus lectin. Journal of Shellfish Research 15: 391-394.
Chintala, M.M., S.E. Ford, W.S. Fisher et K.A. Ashton-Alcox. 1994. Oyster serum agglutinins and resistance to protozoan parasites. Journal of Shellfish Research 13: 115-121.
Chintala, M.M., D. Bushek et S.E. Ford. 2002. Comparison of in vitro-cultured and wild type Perkinsus marinus. II. Dosing methods and host response. Diseases of Aquatic Organisms 51: 203-216.
Choi, K.S., E.A. Wilson, D.H. Lewis, E.N. Powell et S.M. Ray. 1989. The energetic cost of Perkinsus marinus parasitism in oysters: quantification of the thioglycollate method. Journal of Shellfish Research 8: 125-131.
Choi, K., D.H. Lewis, E.N. Powell, P.F. Frelier et S.M. Ray. 1991. A polyclonal antibody developed from Perkinsus marinus hypnospores fails to cross react with other life stages of P. marinus in oyster (Crassostrea virginica) tissues. Journal of Shellfish Research 10: 411-415.
Chu, F.-L.E. 1988. Development and evaluation of techniques to study acquired immunity to Perkinsus marinus in the oyster, Crassostrea virginica (Gmelin). Journal of Shellfish Research 7: 51-55.
Chu, F.-L.E. 1996. Laboratory investigations of susceptibility, infectivity, and transmission of Perkinsus marinus in oysters. Journal of Shellfish Research 15: 57-66.
Chu, F.-L.E., A.K. Volety et G. Constatin. 1996. A comparison of Crassostrea gigas and Crassostrea virginica: effects of temperature and salinity on susceptibility to the protozoan parasite, Perkinsus marinus. Journal of Shellfish Research 15: 375-380.
Chu, F.-L.E. 1998. Host defenses against Perkinsus marinus: a review of recent findings in the eastern oyster, Crassostrea virginica. Journal of Shellfish Research 17: 321-322. (Résumé).
Chu, F.-L.E. 1999. Effects of temperature, salinity, and environmental pollutants on cellular and humoral responses in oysters (Crassostrea virginica). Journal of Shellfish Research 18: 321-322. (Résumé).
Chu, F.E. et K.H. Greene. 1989. Effect of temperature and salinity on in vitro culture of the oyster pathogen, Perkinsus marinus (Apicomplexa: Perkinsea). Journal of Invertebrate Pathology 53: 260-268.
Chu, F.-L.E. et R.C. Hale. 1994. Relationship between pollution and susceptibility to infectious disease in eastern oyster, Crassostrea virginica. Marine Environmental Research 38: 243-256.
Chu, F.-L.E. et J.F. La Peyre. 1989. Effect of environmental factors and parasitism on hemolymph lysozyme and protein of American oysters (Crassostrea virginica). Journal of Invertebrate Pathology 54: 224-232.
Chu, F.-L.E. et F. La Peyre. 1993. Perkinsus marinus susceptibility and defense-related activities in eastern oysters Crassostrea virginica: temperature effects. Diseases of Aquatic Organisms 16: 223-234.
Chu, F.L.E. et A.K. Volety. 1997a. The interaction of the oyster protozoan parasite, Perkinsus marinus and its host, the eastern oyster, Cassostrea virginica: a progress report. Journal of Shellfish Research 16: 261. (Résumé).
Chu, F.-L.E. et A.K. Volety. 1997b. Disease processes of the parasite Perkinsus marinus in eastern oyster Crassostrea virginica: minimum dose for infection initiation, and interaction of temperature, salinity and infective cell dose. Diseases of Aquatic Organisms 28: 61-68.
Chu, F.L.E., J.F. La Peyre et C.S. Burreson. 1993. Perkinsus marinus infection and potential defense-related activities in eastern oysters, Crassostrea virginica: salinity effects. Journal of Invertebrate Pathology 62: 226-232.
Chu, F.-L.E., Y. Huang, A.K. Volety et G. Constantin. 1998. Uptake, distribution and bioconversion of fluorescent lipid analogs in the oyster protozoan parasite, Perkinsus marinus. Journal of Shellfish Research 17: 322. (Résumé).
Chu, F.-L.E., P. Soudant, Y. Huang, A.K. Volety et G. Constantin. 1999. Uptake, distribution, and bioconversion of fluorescent lipid analogs in the oyster protozoan parasite, Perkinsus marinus. Journal of Shellfish Research 18: 318. (Résumé).
Chu, F.-L.E., E. Lund, P. Soudant et E. Harvey. 2002. De novo arachidonic acid synthesis in Perkinsus marinus, a protozoan parasite of the eastern oyster Crassostrea virginica. Molecular and Biochemical Parasitology 119: 179–190.
Chu, F.-L.E., P. Soudant et E.D. Lund. 2003. Perkinsus marinus, a protozoan parasite of the eastern oyster (Crassostrea virginica): effects of temperature on the uptake and metabolism of fluorescent lipid analogs and lipase activities. Experimental Parasitology 105: 121-130.
Chu, F.-L.E., E.D. Lund, E. Harvey et R. Adlof. 2004. Arachidonic acid synthetic pathways of the oyster protozoan parasite, Perkinsus marinus: evidence for usage of a delta-8 pathway. Molecular and Biochemical Parasitology 133: 45–51.
Chu, F.-L.E., E.D. Lund et J.A. Podbesek. 2008. Effects of triclosan on the oyster parasite, Perkinsus marinus and its host, the eastern oyster, Crassostrea virginica Journal of Shellfish Research 27: 769-773.
Coates, G.M., R.K. Cooper et J.F. La Peyre. 1999. Improvement of the whole-oyster procedure for enumerating Perkinsus marinus in oyster tissues. Journal of Shellfish Research 18: 328. (Résumé).
Cook, T., M. Folli, J. Klinck, S. Ford et J. Miller. 1998. The relationship between increasing sea-surface temperature and the northward spread of Perkinsus marinus (Dermo) disease epizootics in oysters. Estuarine, Coastal and Shelf Science 46: 587-597.
Coss, C.A., J.A.F. Robledo, G.M. Ruiz et G.R. Vasta. 2001. Description of Perkinsus andrewsi n.sp. isolated from the baltic clam (Macoma balthica) by characterization of the ribosomal RNA locus and development of a species-specific PCR-based diagnostic assay. The Journal of Eukaryotic Microbiology 48: 52-61.
Craig, A., E.N. Powell, R.R. Fay et J.M. Brooks. 1989. Distribution of Perkinsus marinus in Gulf coast oyster populations. Estuaries 12: 82-91.
Crosby, M.P. et C.F. Roberts. 1990. Seasonal infection intensity cycle of the parasite Perkinsus marinus (and an absence of Haplosporidium spp.) in oysters from a South Carolina salt marsh. Diseases of Aquatic Organisms 9: 149-155.
Culbertson, J., J. Anderson et S. Ray. 2011. Monitoring Dermo infections in Texas oyster populations and their response to changes in freshwater inflows. Journal of Shellfish Research 30: 498. (Résumé).
da Silva, P.M., R.T. Vianna, R.C. Sabry, A.R.M. Magalhães, G. Boehs, M.P. Scardua, C. Guertler, L.P. Ferreira, R.P. Brandâo, L.N. Santana, A. Villalba, S. Fernández, A. Ramilo, A. Cao, K. Reece, C. Dungan et M.A. Barracco. 2012. Status of Perkinsus spp. in oysters Crassostrea rhizophorae and C. brasiliana from Brazil: first report of P. marinus. Journal of Shellfish Research 31: 346. (Résumé).
da Silva, P.M., R.T. Vianna, C. Guertler, L.P. Ferreira, L.N. Santana, S. Fernández-Boo, A. Ramilo, A. Cao et A. Villalba. 2013. First report of the protozoan parasite Perkinsus marinus in South America, infecting mangrove oysters Crassostrea rhizophorae from the Paraíba River (NE, Brazil). Journal of Invertebrate Pathology 113: 96-103.
De Faveri, J., R.M. Smolowitz et S.B. Roberts. 2009. Development and validation of a real-time quantitative PCR assay for the detection and quantification of Perkinsus marinus in the eastern oyster, Crassostrea virginica. Journal of Shellfish Research 28: 459-464.
Dégremont, L., C. Garcia, A. Frank-Lawale et S.K. Allen Jr. 2012. Triploid oysters in the Chesapeake Bay: comparison of diploid and triploid Crassostrea virginica. Journal of Shellfish Research 31: 21-31.
Delaney, M.A., Y.J. Brady, S.D. Worley et K.L. Huels. 2003. The effectiveness of N-halamine disinfectant compounds on Perkinsus marinus, a parasite of the eastern oyster Crassostrea virginica. Journal of Shellfish Research 22: 91-94.
Dittman, D.E., S.E. Ford et D.K. Padilla. 2001. Effects of Perkinsus marinus on reproduction and condition of the eastern oyster, Crassostrea virginica, depending on timing. Journal of Shellfish Research 20: 1025-1034.
Dungan, C.F. 1997. Perkinsus marinus: immunoassay detection in oyster tissues and environmental samples and in vitro experimental systems. Journal of Shellfish Research 16: 263. (Résumé).
Dungan, C.F. et R.M. Hamilton. 1995. Use of a tetrazolium-based cell proliferation assay to measure effects of in vitro conditions on Perkinsus marinus (Apicomplexa) proliferation. The Journal of Eukaryotic Microbiology 42: 379-388.
Dungan, C.F. et R.M. Hamilton. 1997. Microplate ELISA assay for detection of Perkinsus marinus in oyster tissues. Journal of Shellfish Research 16: 330-331. (Résumé).
Dungan, C.F. et B.S. Roberson. 1993. Binding specificities of mono- and polyclonal antibodies to the protozoan oyster pathogen Perkinsus marinus. Diseases of Aquatic Organisms 15: 9-22.
Dungan, C.F., K.S. Reece, R.M. Hamilton, N.A. Stokes et E.M. Burreson. 2007. Experimental cross-infection by Perkinsus marinus and P. chesapeaki in three sympatric species of Chesapeake Bay oysters and clams. Diseases of Aquatic Organisms 76: 67-75.
Dungan, C.F., R.B. Carnegie, K.M. Hill, C.B. McCollough, S.E. Laramore, C.J. Kelly, N.A. Stokes et J. Scarpa. 2012. Diseases of oysters Crassostrea ariakensis and C. virginica reared in ambient waters from the Choptank River, Maryland and the Indian River Lagoon, Florida. Diseases of Aquatic Organisms 101: 173-183.
Earnhart, C.G., M.A. Vogelbein, G.D. Brown, K.S. Reece et S.L. Kaattari. 2004. Supplementation of Perkinsus marinus cultures with host plasma or tissue homogenate enhances their infectivity. Applied and Environmental Microbiology 70: 421-431.
Elandalloussi, L.M., R.M. Leite, R. Afonso, P.A. Nunes, J.A.F. Robledo, G.R. Vasta et M.L. Cancela. 2004. Development of a PCR-ELISA assay for diagnosis of Perkinsus marinus and Perkinsus atlanticus infections in bivalve molluscs. Molecular and Cellular Probes 18: 89-96.
Ellin, R.C. et D. Bushek. 1999. Potential use of Ray's fluid thioglycollate medium to detect and quantify Perkinsus marinus in environmental water samples. Journal of Shellfish Research 18: 328. (Résumé).
Ellin, R. et D. Bushek. 2000. An examination of ecological factors governing planktonic abundance and dispersal of Perkinsus marinus. Journal of Shellfish Research 19: 644. (Résumé).
Ellin, R. et D. Bushek. 2006. Adaptation of Ray's fluid thioglycollate medium assay to detect and quantify planktonic stages of Perkinsus spp. parasites. Journal of Shellfish Research 25: 1037-1042.
Elsayed, E. et M. Faisal. 1999. Correlation between the level of protease inhibitors and intensity of Perkinsus marinus infection in eastern oyster (Crassostrea virginica). Journal of Shellfish Research 18: 328. (Résumé).
Encomio, V.G. et F.-L.E. Chu. 2005. Season variation of heat shock protein 70 in eastern oysters (Crassostrea virginica) infected with Perkinsus marinus (dermo). Journal of Shellfish Research 24: 167-175.
Encomio, V.G. et F.L.E. Chu. 2007. Heat shock protein (hsp70) expression and thermal tolerance in sublethally heat-shocked eastern oysters Crassostrea virginica infected with the parasite Perkinsus marinus. Diseases of Aquatic Organisms 76: 251-260.
Encomio, V.G., S.M. Stickler, S.K. Allen Jr et F.-L. Chu. 2005. Performance of "natural dermo-resistant" oyster stocks - survival, disease, growth, condition and energy reserves. Journal of Shellfish Research 24: 143-155.
Enríquez-Espinoza, T.L., J.M. Grijalva-Chon, R. Castro-Longoria et J. Ramos-Paredes. 2010. Perkinsus marinus in Crassostrea gigas in the Gulf of California. Diseases of Aquatic Organisms 89: 269-273.
Espinosa, E.P., S. Winnicki et B. Allam. 2013. Early host-pathogen interactions in a marine bivalve: Crassostrea virginica pallial mucus modulates Perkinsus marinus growth and virulence. Diseases of Aquatic Organisms 104: 237-247.
Faisal, M. 1999. The role of protease-antiprotease interactions in Perkinsus marinus infection in Crassostrea spp. Journal of Shellfish Research 18: 322. (Résumé).
Faisal, M., J.F. La Peyre et S.L. Kaattari. 1997. A promising chemotherapy for Perkinsus marinus-infected oysters. Journal of Shellfish Research 16: 263-264. (Résumé).
Faisal, M., J.F. La Peyer, E. Elsayed et D.C. Wright. 1999. Bacitracin inhibits the oyster pathogen Perkinsus marinus in vitro and in vivo. Journal of Aquatic Animal Health 11: 130-138.
Feng, C., C. Wang, X. Lin, Y. Zhang, J. Lv, J.-h. Deng, X. Yuan, L. Mei et S.-q. Wu. 2013. Development of a loop-mediated isothermal amplification method for detection of Perkinsus spp. in mollusks. Diseases of Aquatic Organisms 104: 141-148.
Fernández-Robledo, J.A., E.J. Schott et G.R. Vasta. 2008a. Perkinsus marinus superoxide dismutase 2 (PmSOD2) localizes to single-membrane subcellular compartments. Biochemical and Biophysical Research Communications 375: 215-219.
Fernández-Robledo, J.A., Z. Lin et G.R. Vasta. 2008b. Transfection of the protozoan parasite Perkinsus marinus. Molecular and Biochemical Parasitology 157: 44-53.
Fisher, W.S. and L.M. Oliver. 1996. A whole-oyster procedure for diagnosis of Perkinsus marinus disease using Ray's fluid thioglycollate culture medium. Journal of Shellfish Research 15: 109-117.
Fisher, W.S., J.D. Gauthier et J.T. Winstead. 1992. Infection intensity of Perkinsus marinus disease in Crassostrea virginica (Gmelin, 1791) from the Gulf of Mexico maintained under different laboratory conditions. Journal of Shellfish Research 11: 363-369.
Fong, D., R. Rodriguez, K. Koo, J. Sun, M.L. Sogin, D. Bushek, D.T.J. Littlewood et S.E. Ford. 1993. Small subunit ribosomal RNA gene sequence of the oyster parasite Perkinsus marinus. Molecular Marine Biology and Biotechnology 2: 346-350.
Ford, S.E. 1992. Avoiding the transmission of disease in commercial culture of molluscs, with special reference to Perkinsus marinus (Dermo) and Haplosporidium nelsoni (MSX). Journal of Shellfish Research 11: 539-546.
Ford, S.E. 1996. Range extension by the oyster parasite Perkinsus marinus into the northeastern United States: response to climate change? Journal of Shellfish Research 15: 45-56.
Ford, S.E. et M.M. Chintala. 2006. Northward expansion of a marine parasite: Testing the role of temperature adaptation. Journal of Experimental Marine Biology and Ecology 339: 226–235.
Ford, S.E. et R. Smolowitz. 2007. Infection dynamics of an oyster parasite in its newly expanded range. Marine Biology 151: 119–133.
Ford, S.E. et M.R. Tripp. 1996. Diseases and Defense Mechanisms. In: Kennedy, V.S., R.I.E. Newell, A.F. Eble (eds.) The Eastern Oyster Crassostrea virginica. Maryland Sea Grant College, College Park, Maryland. pp. 581-660.
Ford, S.E., A. Schotthoefer et C. Spruck. 1999. In vivo dynamics of the microparasite Perkinsus marinus during progression and regression of infections in eastern oysters. The Journal of Parasitology 85: 273-282.
Ford, S., R. Smolowitz et M. Chintala. 2000a. The question of temperature and Perkinsus marinus (Dermo) activity in the northeastern United States. Journal of Shellfish Research 19: 571. (Résumé).
Ford, S.E., R. Smolowitz et M.M. Chintala. 2000b. Temperature and range extension by Perkinsus marinus. Journal of Shellfish Research 19: 598. (Résumé).
Ford, S., Z. Xu et G. DeBrosse. 2000c. Acquisition and prevention of MSX and Dermo in a hatchery and land-based nursery: a DNA assay investigation. Journal of Shellfish Research 19: 571. (Résumé).
Ford, S.E., Z. Xu et G. Debrosse. 2001. Use of particle filtration and UV irradiation to prevent infection by Haplosporidium nelsoni (MSX) and Perkinsus marinus (Dermo) in hatchery-reared larval and juvenile oysters. Aquaculture 194: 37-49.
Ford, S.E., M.M. Chintala et D. Bushek. 2002. Comparison of in vitro-cultured and wild type Perkinsus marinus. I. Pathogen virulence. Diseases of Aquatic Organisms 51: 187-201.
Foster, B., S. Grewal, O. Graves, F.M. Hughes Jr et I.M. Sokolova. 2011. Copper exposure affects hemocyte apoptosis and Perkinsus marinus infection in eastern oysters Crassostrea virginica (Gmelin). Fish and Shellfish Immunology 31: 341-349.
Gaffney, P.M. et D. Bushek. 1996. Genetic aspects of disease resistance in oysters. Journal of Shellfish Research 15: 135-140.
Garreis, K.A., J.F. La Peyre et M. Faisal. 1996. The effects of Perkinsus marinus extracellular products and purified proteases on oyster defence parameters in vitro. Fish and Shellfish Immunology 6: 581-597.
Gauthier, J.D. et W.S. Fisher. 1990. Hemolymph assay for diagnosis of Perkinsus marinus in oysters Crassostrea virginica (Gmelin, 1791). Journal of Shellfish Research 9: 367-371.
Gauthier, J.D. et G.R. Vasta. 1993. Continuous in vitro culture of the eastern oyster parasite Perkinsus marinus. Journal of Invertebrate Pathology 62: 321-323.
Gauthier, D.J. et G.R. Vasta. 1994. Inhibition of in vitro replication of the oyster parasite Perkinsus marinus by the natural iron chelators transferrin, lactoferrin, and desferrioxamine. Developmental and Comparative Immunology 18: 277-286.
Gauthier, J.D. et G.R. Vasta. 1995. In vitro culture of the eastern oyster parasite Perkinsus marinus: optimization of the methodology. Journal of Invertebrate Pathology 66: 156-168.
Gauthier, J.D. et G.R. Vasta. 2002. Effects of plasma from bivalve mollusk species on the in vitro proliferation of the protistan parasite Perkinsus marinus. Journal of Experimental Zoology 292: 221-230.
Gauthier, J.D., T.M. Soniat et J.S. Rogers. 1990. A parasitological survey of oysters along salinity gradients in coastal Louisiana. Journal of the World Aquaculture Society 21: 105-115.
Gauthier, J.D., B. Feig et G.R. Vasta. 1995. Effect of fetal bovine serum glycoproteins on the in vitro proliferation of the oyster parasite Perkinsus marinus: development of a fully defined medium. The Journal of Eukaryotic Microbiology 42: 307-313.
Gauthier, J.D., C.R. Miller et A.E. Wilbur. 2006. TaqMan® MGB real-time PCR approach to quantification of Perkinsus marinus and Perkinsus spp. in oysters Journal of Shellfish Research 25: 619-624. (for Erratum see J. Shellfish Res. 25(3): 1105).
Goedken, M., B. Morsey, I. Sunila et S. de Guise. 2005. Immunomodulation of Crassostrea gigas and Crassostrea virginica cellular defense mechanisms by Perkinsus marinus. Journal of Shellfish Research 24: 487-496.
Goggin, C.L. 1994. Variation in the two internal transcribed spacers and 5.8S ribosomal RNA from five isolates of the marine parasite Perkinsus (Protista, Apicomplexa). Molecular and Biochemical Parasitology 65: 179-182.
Goggin, C.L. et S.C. Barker. 1993. Phylogenetic position of the genus Perkinsus (Protista, Apicomplexa) based on small subunit ribosomal RNA. Molecular and Biochemical Parasitology 60: 65-70.
Goulletquer, P., M. Héral et B.J. Rothschild. 1994. Causes of decline of oyster production (Crassostrea virginica) in the Maryland portion of the Chesapeake Bay: a literature study. Haliotis 23: 87-112. La version d'accès ouverte : https://archimer.ifremer.fr/doc/00000/3081/.
Green-Beach, E., X. Guo, P. Smouse et D. Bushek. 2011. Population structure of oysters on Martha's Vineyard, MA in response to selection by Perkinsus marinus, using microsatellite markers. Journal of Shellfish Research 30: 512. (Résumé).
Grizel, H. 1987. Les maladies des mollusques: étiologie et progrès récents des recherches. Oceanis 13: 357-370.
Gullian-Klanian, M., J.A. Herrera-Silveira, R. Rodríguez-Canul et L. Aguirre-Macedo. 2008. Factors associated with the prevalence of Perkinsus marinus in Crassostrea virginica from the southern Gulf of Mexico. Diseases of Aquatic Organisms 39: 237–247.
He, Y., H. Yu, Z. Bao, Q. Zhang et X. Guo. 2012. Mutation in promoter region of a serine protease inhibitor confers Perkinsus marinus resistance in the eastern oyster (Crassostrea virginica). Fish and Shellfish Immunology 33: 411-417.
Hearne, J.L. et J.S. Pitula. 2011. Identification of two spliced leader RNA transcripts from Perkinsus marinus. The Journal of Eukaryotic Microbiology 58: 266-268.
Héral, M., B.J. Rothschild et P. Goulletquer. 1990. Decline of oyster production in the Maryland portion of the Chesapeake Bay: causes and perspectives. International Council for Exploration of the Sea C.M.1990/K:20: 38 pp. (La version d'accès ouverte : https://archimer.ifremer.fr/doc/00000/2393/.)
Hoese, H.D. 1964. Studies on oyster scavengers and their relation to the fungus Dermocystidium marinum. Proceedings of the National Shellfisheries Association 53: 161-174.
Hofmann, E.E., E.N. Powell, J.M. Klinck et G. Saunders. 1995. Modelling diseased oyster populations: I. modelling Perkinsus marinus infection in oysters. Journal of Shellfish Research 14: 121-151.
Hofmann, E.E., J.M. Klinck, S.E. Ford et E.N. Powell. 1999. Disease dynamics: modeling the effect of climate change on oyster disease. Journal of Shellfish Research 18: 329. (Résumé).
ICES. 2004. Trends in important diseases affecting fish and molluscs in the ICES area 1998-2002. International Council for the Exploration of the Sea, Copenhagen, Denmark. (Prepared and edited by the Working Group on Pathology and Diseases of Marine Organisms).
Jordan, S.J. 1995. Population and disease dynamics of Maryland oyster bars: a multivariate classification analysis. Journal of Shellfish Research 14: 459-468.
Jordan, P.J. et L.E. Deaton. 2005. Characterization of phenoloxidase from Crassostrea virginica hemocytes and the effect of Perkinsus marinus on phenoloxidase activity in the hemolymph of Crassostrea virginica and Geukensia demissa. Journal of Shellfish Research 24: 477-482.
Joseph, S.J., J.A. Fernández-Robledo, M.J. Gardner, N.M. El-Sayed, C.H. Kuo, E.J. Schott, H. Wang, J.C. Kissinger et G.R. Vasta. 2010. The alveolate Perkinsus marinus: biological insights from EST gene discovery. BMC Genomics 11: 228 (La version d'accès ouverte : https://www.biomedcentral.com/1471-2164/11/228).
Kaattari, S.L., D.A. Shapiro, T.D. Lewis et M. Faisal. 1997. Development of enhanced diagnostics and identification of oyster target molecules for Perkinsus marinus. Journal of Shellfish Research 16: 266. (Résumé).
Karolus, J., I. Sunila, S. Spear, J. DeCrescenzo et J. Volk. 1999. The presence of Haplosporidium nelsoni (MSX) and Perkinsus marinus (Dermo) in Crassostrea virginica along the Connecticut and northern Long Island shoreline in 1998 - an extensive survey. Journal of Shellfish Research 18: 270. (Résumé).
Karolus, J., I. Sunila, S. Spear et J. Volk. 2000. Prevalence of Perkinsus marinus (Dermo) in Crassostrea virginica along the Connecticut shoreline. Aquaculture 183: 215–221.
Kennedy, V.S., R.I.E. Newell, G.E. Krantz et S. Otto. 1995. Reproductive capacity of the eastern oyster Crassostrea virginica infected with the parasite Perkinsus marinus. Diseases of Aquatic Organisms 23: 135-144.
Kern, F.G. 1985. Perkinsus marinus parasitism, a sporozoan disease of oyster. In: Sindermann, C.J. (ed.) Identification Leaflets for Diseases and Parasites of Fish and Shellfish. International Council for the Eploration of the Sea, Copenhagen. pp. 1-4.
Kern, F.G., L.C. Sullivan et M. Takata. 1973. Labyrinthomyxa-like organisms associated with mass mortalities of oysters Crassostrea virginica, from Hawaii. Proceedings of the National Shellfisheries Association 63: 43-46.
Kim, Y. et E.N. Powell. 1998. Influence of climate change on interannual variation in population attributes of Gulf of Mexico oysters. Journal of Shellfish Research 17: 265-274.
Kim, Y., K.A. Ashton-Alcox, et E.N. Powell. 2006. Histological Techniques for Marine Bivalve Molluscs: Update. Silver Spring, MD. NOAA Technical Memorandum NOS NCCOS 27. pp. 53-74.
Kingsley-Smith, P.R., H.D. Harwell, M.L. Kellogg, S.M. Allen, S.K. Allen Jr, D.W. Meritt, K.T. Paynter Jr et M.W. Luckenbach. 2009. Survival and growth of triploid Crassostrea virginica (Gmelin, 1791) and C. ariakensis (Fujita, 1913) in bottom environments of Chesapeake Bay: implications for an introduction. Journal of Shellfish Research 28: 169-184.
Kleinschuster, S.J. et J. Parent. 1995. Sub-clinical infection of oysters (Crassostrea virginica) (Gmelin 1791) from Maine by species of the genus Perkinsus (Apicomplexa). Journal of Shellfish Research 14: 489-491.
Kleinschuster, S.J. et S.L. Swink. 1993. A simple method for the in vitro culture of Perkinsus marinus. The Nautilus 107: 76-78.
Klinck, J.M., E.N. Powell, J.N. Kraeuter, S.E. Ford etd K.A. Ashton-Alcox. 2001. A fisheries model for managing the oyster fishery during times of disease. Journal of Shellfish Research 20: 977-989.
Krantz, G.E. 1994. Chemical inhibition of Perkinsus marinus in two in vitro culture systems. Journal of Shellfish Research 13: 131-136.
Krantz, G.E. et S.J. Jordan. 1996. Management alternatives for protecting Crassostrea virginica fisheries in Perkinsus marinus enzootics and epizootic areas. Journal of Shellfish Research 15: 167-176.
La Peyre, J.F. 1996. Propogation and in vitro studies of Perkinsus marinus. Journal of Shellfish Research 15: 89-101.
La Peyre, J.F. et F.-L.E. Chu. 1994. A simple procedure for the isolation of Perkinsus marinus merozoites, a pathogen of the eastern oyster, Crassostrea virginica. Bulletin of the European Association of Fish Pathologists 14: 101-103.
La Peyre, J.F. et R.K. Cooper. 1998. Virulence factors of Perkinsus marinus: recent findings and questions. Journal of Shellfish Research 17: 330-331. (Résumé).
La Peyre, J.F. et M. Faisal. 1995a. Improved method for the initiation of continuous cultures of the oyster pathogen Perkinsus marinus (Apicomplexa). Transactions of the American Fisheries Society 124: 144-146.
La Peyer, J.F. et M. Faisal. 1995b. Perkinsus marinus produces extracellular proteolytic factor(s) in vitro. Bulletin of the European Association of Fish Pathologists 15: 28-31.
La Peyer, J.F. et M. Faisal. 1996. Optimal culture conditions for the propagation of the oyster pathogen Perkinsus marinus (Apicomplexa) in protein deficient medium. Parasite 3: 147-153.
La Peyre, J.F. et M. Faisal. 1997a. Extracellular proteins of the oyster pathogen Perkinsus marinus as virulence factors and potential targets for chemotherapy. Journal of Shellfish Research 16: 269. (Résumé).
La Peyre, J.F. et M. Faisal. 1997b. Development of a protein-free chemically defined culture medium for the propagation of the oyster pathogen Perkinsus marinus. Parasite 4: 67-73.
La Peyre, J.F. et A.K. Volety. 1999. Modulation of eastern oyster hemocyte activity by Perkinsus marinus extracellular proteins. Journal of Shellfish Research 18: 322. (Résumé).
La Peyre, J.F., M. Faisal et E.M. Burreson. 1993. In vitro propagation of the protozoan Perkinsus marinus, a pathogen of the eastern oyster, Crassostrea virginica. The Journal of Eukaryotic Microbiology 40: 304-310.
La Peyre, J.F., F.L.E. Chu et J.M. Meyers. 1995a. Haemocytic and humoral activities of eastern and Pacific oysters following challenge by the protozoan Perkinsus marinus. Fish and Shellfish Immunology 5: 179-190.
La Peyre, J.F., F.-L.E. Chu et W.K. Vogelbein. 1995b. In vitro interaction of Perkinsus marinus merozoites with Eastern and Pacific oyster hemocytes. Developmental and Comparative Immunology 19: 291-304.
La Peyre, M.K., A.D. Nickens, A.K. Volety, G.S. Tolley et J.F. La Peyer. 2003. Environmental significance of freshets in reducing Perkinsus marinus infection in eastern oysters Crassostrea virginica: potential management applications. Marine Ecology Progress Series 248: 165-176.
La Peyre, M., S. Casas et J. La Peyre. 2006. Salinity effects on viability, metabolic activity and proliferation of three Perkinsus species. Diseases of Aquatic Organisms 71: 59-74.
La Peyre, J., S. Casas, Y. Li et J. Supan. 2008a. Evaluation of an adjustable long line system to increase oyster survival in Dermo endemic areas and refrigerated shelf-life after harvest. Journal of Shellfish Research 27: 1041.
La Peyre, M.K., S.M. Casas, A. Villalba et J.F. La Peyre. 2008b. Determination of the effects of temperature on viability, metabolic activity and proliferation of two Perkinsus species, and its significance to understanding seasonal cycles of perkinsosis. Parasitology 135: 505-519.
La Peyre, M.K., B. Gossman et J.F. La Peyre. 2009. Defining optimal freshwater flow for oyster production: effects of freshet rate and magnitude of change and duration on eastern oysters and Perkinsus marinus infection. Estuaries and Coasts 32: 522-534.
La Peyre, J.F., Q.-G. Xue, N. Itoh, Y. Li et R.K. Cooper. 2010a. Serine protease inhibitor cvSI-1 potential role in the eastern oyster host defense against the protozoan parasite Perkinsus marinus. Developmental and Comparative Immunology 34: 84-92.
La Peyre, M.K., S.M. Casas, W. Gayle et J.F. La Peyre. 2010b. The combined influence of sub-optimal temperature and salinity on the in vitro viability of Perkinsus marinus, a protistan parasite of the eastern oyster Crassostrea virginica. Journal of Invertebrate Pathology 105: 176-181.
Lenihan, H.S., F. Micheli, S.W. Shelton et C.H. Peterson. 1999. The influence of multiple environmental stressors on susceptibility to parasites: an experimental determination with oysters. Limnology and Oceanography 44: 910-924.
Leonard III, K., M. Gomez-Chiarri et A. Ganz. 1999. Detecting the presence of Perkinsus marinus in the eastern oyster, Crassostrea virginica in Rhode Island waters. Journal of Shellfish Research 18: 331. (Résumé).
Leonard III, K., J. Dougal et M. Gomez-Chiarri. 2000. Detecting the presence of Perkinsus marinus and Haplosporidium nelsoni in the oyster, Crassostrea virginica, in Rhode Island waters: a survey update. Journal of Shellfish Research 19: 575. (Résumé).
Levine, N.D. 1978. Perkinsus gen. n. and other new taxa in the protozoan phylum Apicomplexa. The Journal of Parasitology 64: 549.
Lewis, E.J., F.G. Fern, A. Rosenfield, S.A. Stevens, R.L. Walker et P.B. Heffernan. 1992. Lethal parasites in oysters from coastal Georgia with discussion of disease and management implications. Marine Fisheries Review 54: 1-6.
Lund, E.D. et F.-L.E. Chu. 2002. Phospholipid biosynthesis in the oyster protozoan parasite, Perkinsus marinus. Molecular and Biochemical Parasitology 121: 245-253.
Lund, E.D., F.-L.E. Chu et E. Harvey. 2004. In vitro effects of temperature and salinity on fatty acid synthesis in the oyster protozoan parasite Perkinsus marinus. Journal of Experimental Marine Biology and Ecology 307: 111-126.
Lund, E.D., P. Soudant, F.-L.E. Chu, E. Harvey, S. Bolton et A. Flowers. 2005. Effects of triclosan on growth, viability and fatty acid synthesis of the oyster protozoan parasite Perkinsus marinus. Diseases of Aquatic Organisms 67: 217–224.
Lund, E.D., F.-L.E. Chu, P. Soudant et E. Harvey. 2007. Perkinsus marinus, a protozoan parasite of the eastern oyster, has a requirement for dietary sterols. Comparative Biochemistry and Physiology Part A146: 141-147.
MacIntyre, E.A., C.G. Earnhart et S.L. Kaattari. 2003. Host oyster tissue extracts modulate in vitro protease expression and cellular differentiation in the protozoan parasite, Perkinsus marinus. Parasitology 126: 293-302.
Mackin, J.G. 1951. Histopathology of infection of Crassostrea virginica (Gmelin) by Dermocystidium marinum Mackin, Owen, and Collier. Bulletin of Marine Science of the Gulf and Caribbean 1: 72-87.
Mackin, J.G. 1955. Dermocystidium marinum and salinity. Proceedings of the National Shellfisheries Association 46: 116-128.
Mackin, J.G. et S.M. Ray. 1966. The taxonomic relationship of Dermocystidium marinum Mackin, Owen, and Collier. Journal of Invertebrate Pathology 8: 544-545.
Mackin, J.G., H.M. Owen et A. Collier. 1950. Preliminary note on the occurrence of a new protistan parasite, Dermocystidium marinum n.sp. in Crassostrea virginica (Gmelin). Science (Washington D C) 111: 328-329.
Marsh, A.G., J.D. Gauthier et G.R. Vasta. 1995. A semiquantitative PCR assay for assessing Perkinsus marinus infections in the eastern oyster, Crassostrea virginica. The Journal of Parasitology 81: 577-583.
Mangot, J.F., D. Debroas et I. Domaizon. 2011. Perkinsozoa, a well-known marine protozoan flagellate parasite group, newly identified in lacustrine systems: a review. Hydrobiologia 659: 37-48.
Matsuzaki, M., H. Kuroiwa, T. Kuroiwa, K. Kita et H. Nozaki. 2008. A cryptic algal group unveiled: a plastid biosynthesis pathway in the oyster parasite Perkinsus marinus. Molecular Biology and Evolution 25: 1167-1179.
McCollough, C.B., B.W. Albright, G.R. Abbe, L.S. Barker etd C.F. Dungan. 2007. Acquisition and progression of Perkinsus marinus infections by specific-pathogen-free juvenile oysters (Crassostrea virginica Gmelin) in a mesohaline Chesapeake Bay tributary. Journal of Shellfish Research 26: 465-477.
McCoy, A., S.M. Baker et A.C. Wright. 2007. Investigation of Perkinsus spp. in aquacultured hard clams (Mercenaria mercenaria) from the Florida Gulf coast. Journal of Shellfish Research 26: 1029-1033.
Meyers, J.A., E.M. Burreson, B.J. Barber et R. Mann. 1991. Susceptibility of diploid and triploid Pacific oysters, Crassostrea gigas (Thunberg, 1793) and eastern oysters, Crassostrea virginica (Gmelin, 1791), to Perkinsus marinus. Journal of Shellfish Research 10: 433-437.
Mortensen, S., I. Arzul, L. Miossec, C. Paillard, S. Feist, G. Stentiford, T. Renault, D. Saulnier et A. Gregory. 2007. Molluscs and crustaceans, 5.3.19 Perkinsosis due to Perkinsus marinus. In: Raynard, R., T. Wahli, I. Vatsos, S. Mortensen (eds.) Review of disease interactions and pathogen exchange between farmed and wild finfish and shellfish in Europe. VESO on behalf of DIPNET, Oslo. p. 397-407.
Moss, J.A., E.M. Burreson et K.S. Reece. 2006. Advanced Perkinsus marinus infections in Crassostrea ariakensis maintained under laboratory conditions. Journal of Shellfish Research 25: 65-72.
Muñoz, P., K. Vance et M. Gómez-Chiarri. 2003. Protease activity in the plasma of American oysters, Crassostrea virginica, experimentally infected with the protozoan parasite Perkinsus marinus. The Journal of Parasitology 89: 941-951.
Nickens, A.D., T.R. Tiersch et J.F. La Peyre. 2000a. Effect of a lytic peptide and protease inhibitors on Perkinsus marinus in infected hemocytes of eastern oysters. Journal of Shellfish Research 19: 647. (Résumé).
Nickens, A.D., E. Wagner et J.F. La Peyer. 2000b. Improved procedure to count Perkinsus marinus in eastern oyster hemolymph. Journal of Shellfish Research 19: 665. (Résumé).
Nickens, A.D., J.F. La Peyre, E.S. Wagner etd T.R. Tiersch. 2002. An improved procedure to count Perkinsus marinus in eastern oyster hemolymph. Journal of Shellfish Research 21: 725-732.
Norén, F., O. Moestrup et A.-S. Rehnstam-Holm. 1999. Parvilucifera infectans Norén et Moestrup gen. et sp. nov. (Perkinsozoa phylum nov.): a parasitic flagellate capable of killing toxic microalgae. European Journal of Protistology 35: 233-245.
Norton, J.H., M.A. Shepherd, F.O. Perkins et H.C. Prior. 1993. Perkinsus-like infection in farmed golden-lipped pearl oyster Pinctada maxima from the Torres Strait, Australia. Journal of Invertebrate Pathology 62: 105-106.
O'Farrell, C.L., J.F. La Peyre, K.T. Paynter et E.M. Burreson. 2000. Osmotic tolerance and volume regulation in in vitro cultures of the oyster pathogen Perkinsus marinus. Journal of Shellfish Research 19: 139-145.
Oliver, J.L., M. Faisal et S.L. Kaattari. 1998a. The effect of oyster hemolytic factors on Perkinsus marinus. Journal of Shellfish Research 17: 334-335. (Résumé).
Oliver, L.M., W.S. Fisher, S.E. Ford, L.M. Ragone Calvo, E.M. Burreson, E.B. Sutton et J. Gandy. 1998b. Perkinsus marinus tissue distribution and seasonal variation in oysters Crassostrea virginica from Florida, Virginia and New York. Diseases of Aquatic Organisms 34: 51-61.
Oliver, J.L., M. Faisal et S.L. Kaattari. 1999a. Plasma of Crassostrea spp. possess a low molecular weight inhibitor of Perkinsus marinus protease. Journal of Shellfish Research 18: 319. (Résumé).
Oliver, J.L., T.D. Lewis, M. Faisal et S.L. Kaattari. 1999b. Analysis of the effects of Perkinsus marinus proteases on plasma proteins of the eastern oyster (Crassostrea virginica) and the Pacific oyster (Crassostrea gigas). Journal of Invertebrate Pathology 74: 173–183.
Oliver, J.L., P.M. Gaffney, S.K. Allen Jr, M. Faisal et S.L. Kaattari. 2000. Protease inhibitory activity in selectively bred families of eastern oysters. Journal of Aquatic Animal Health 12: 136-145.
Ottinger, C.A., T.D. Lewis, D.A. Shapiro, M. Faisal et S.L. Kaattari. 2001. Detection of Perkinsus marinus extracellular proteins in tissues of the eastern oyster Crassostrea virginica: potential use in diagnostic assays. Journal of Aquatic Animal Health 13: 133-141.
Panko, C., V. Encomio, J. Barreto et A.K. Volety. 2008. In vitro and in vivo evaluation of quinine as a potential anti-protozoal for the eastern oyster parasite Perkinsus marinus. Journal of Shellfish Research 27: 789-793.
Paynter, K.T. 1996. The effects of Perkinsus marinus infection on physiological processes in the eastern oyster, Crassostrea virginica. Journal of Shellfish Research 15: 119-125.
Paynter, K.T. et E.M. Burreson. 1991. Effects of Perkinsus marinus infection in the eastern oyster, Crassostrea virginica: II. Disease development and impact on growth rate at different salinities. Journal of Shellfish Research 10: 425-431.
Paynter, K.T., C. Caudill et E.M. Burreson. 1993a. The physiological effects of protozoan parasitism on the eastern oyster, Crassostrea virginica: introductory overview. Journal of Shellfish Research 12: 137. (Résumé).
Paynter, K.T., S.K. Pierce et E.M. Burreson. 1993b. The physiological effects of protozoan parasitism on the eastern oyster Crassostrea virginica: effects on cellular free amino acid levels. Journal of Shellfish Research 12: 137. (Résumé).
Paynter, K.T., S.K. Pierce et E.M. Burreson. 1995. Level of intracellular free amino acids used for salinity tolerance by oysters (Crassostrea virginica) are altered by protozoan (Perkinsus marinus) parasitism. Marine Biology 122: 67-72.
Paynter, K.T., J.D. Goodwin, M.E. Chen, N.J. Ward, M.W. Sherman, D.W. Meritt et S.K. Allen. 2008. Crassostrea ariakensis in Chesapeake Bay: growth, disease and mortality in shallow subtidal environments. Journal of Shellfish Research 27: 509-515.
Paynter, K.T., V. Politano, H.A. Lane, S.M. Allen et D. Meritt. 2010. Growth rates and prevalence of Perkinsus marinus in restored oyster populations in Maryland. Journal of Shellfish Research 29: 309-317.
Pecher, W.T., M.R. Alavi, E.J. Schott, J.A. Fernandez-Robledo, L. Roth, S.T. Berg et G.R. Vasta. 2008. Assessment of the northern distribution range of selected Perkinsus species in eastern oysters (Crassostrea virginica) and hard clams (Mercenaria mercenaria) with the use of PCR-based detection assays. The Journal of Parasitology 95: 410–422.
Penna, S., R.A. French, J. Volk, J. Karolus, I. Sunila et R. Smolowitz. 1999. Diagnostic screening of oyster pathogens: preliminary field trials of multiplex PCR. Journal of Shellfish Research 18: 319-320. (Résumé).
Penna, M.-S., M. Khan et R.A. French. 2001. Development of a multiplex PCR for the detection of Haplosporidium nelsoni, Haplosporidium costale and Perkinsus marinus in the eastern oyster (Crassostrea virginica, Gmelin, 1971). Molecular and Cellular Probes 15: 385-390.
Perkins, F.O. 1976a. Dermocystidium marinum infection in oysters. Marine Fisheries Review 38(10): 19-21.
Perkins, F.O. 1976b. Zoospores of the oyster pathogen, Dermocystidium marinum. I. Fine structure of the conoid and other sporozoan-like organelles. The Journal of Parasitology 62: 959-974.
Perkins, F.O. 1988. Structure of protistan parasites found in bivalve molluscs. American Fisheries Society Special Publication 18: 93-111.
Perkins, F.O. 1969. Ultrastructure of vegetative stages in Labyrinthomyxa marina (=Dermocystidium marinum), a commercially significant oyster pathogen. Journal of Invertebrate Pathology 13: 199-222.
Perkins, F.O. 1996. The structure of Perkinsus marinus (Mackin, Owen and Collier, 1950) Levine, 1978 with comments on taxonomy and phylogeny of Perkinsus spp. Journal of Shellfish Research 15: 67-87.
Powell, E.N., J.M. Klinck et E.E. Hofmann. 1996. Modeling diseased oyster populations. II Triggering mechanisms for Perkinsus marinus epizootics. Journal of Shellfish Research 15: 141-165.
Power, A., B. McCrickard, M. Mitchell, E. Covington, M. Sweeney-Reeves, K. Payne et R. Walker. 2006. Perkinsus marinus in coastal Georgia, USA, following a prolonged drought. Diseases of Aquatic Organisms 73: 151-158.
Powell, E.N., K.A. Ashton-Alcox, J.N. Kraeuter, S.E. Ford et D. Bushek. 2008. Long-term trends in oyster population dynamics in Delaware Bay: regime shifts and response to disease Journal of Shellfish Research 27: 729-755.
Powell, E.N., J.M. Klinck, X. Guo, S.E. Ford et D. Bushek. 2011. The potential for oysters, Crassostrea virginica, to develop resistance to Dermo disease in the field: evaluation using a gene-based population dynamics model. Journal of Shellfish Research 30: 685-712.
Pydeski, J.R. et D. Bushek. 2008. The role of transmission and infection in establishing refugia from two protozoan oyster diseases in Delaware Bay. Journal of Shellfish Research 27: 1044. (Résumé).
Queiroga, F.R., L.F. Marques-Santos, H. Hégaret, P. Soudant, N.D. Farias, A.D. Schlindwein et P.M. da Silva. 2013. Immunological responses of the mangrove oysters Crassostrea gasar naturally infected by Perkinsus sp. in the Mamanguape Estuary, Paraíba state (Northeastern, Brazil). Fish and Shellfish Immunology 35: 319-327.
Ragone, L.M. et E.M. Burreson. 1993. Effect of salinity on infection progression and pathogenicity of Perkinsus marinus in the eastern oyster, Crassostrea virginica (Gmelin). Journal of Shellfish Research 12: 1-7.
Ragone Calvo, L.M. et E.M. Burreson. 1994. Characterization of overwintering infections of Perkinsus marinus (Apicomplexa) in Chesapeake Bay oysters. Journal of Shellfish Research 13: 123-130.
Ragone Calvo, L.M. et E.M. Burreson. 2000. Development and verification of a simple model for Perkinsus marinus abundance in Chesapeake Bay oysters. Journal of Shellfish Research 19: 661. (Résumé).
Ragone Calvo, L.M., R.L. Wetzel et E.M. Burreson. 2001. Development and verification of a model for the population dynamics of the protistan parasite, Perkinsus marinus, within its host, the eastern oyster, Crassostrea virginica, in Chesapeake Bay. Journal of Shellfish Research 20: 231-241.
Ragone Calvo, L.M., G.W. Calvo et E.M. Burreson. 2003a. Dual disease resistance in a selectively bred eastern oyster, Crassostrea virginica, strain tested in Chesapeake Bay. Aquaculture 220: 69-87.
Ragone Calvo, L.M., C.F. Dungan, B.S. Roberson et E.M. Burreson. 2003b. Systematic evaluation of factors controlling Perkinsus marinus transmission dynamics in lower Chesapeake Bay. Diseases of Aquatic Organisms 56: 75-86.
Ralph, G., J.E. Ward, S.M. Winnicki, W. Carden, B. Allam et B. Holohan. 2008. Development of experimental procedures for determining the role of marine aggregates in the transmission of Perkinsus marinus in the eastern oyster (Crassostrea virginica). Journal of Shellfish Research 27: 1045. (Résumé).
Rawson, P., X. Guo et S. Lindell. 2008. Cross-breeding and field trials of disease resistant eastern oysters. Journal of Shellfish Research 27: 1045-1046. (Résumé).
Ray, S.M. 1966. A review of the culture method for detecting Dermocystidium marinum, with suggested modifications and precautions. Proceedings of the National Shellfisheries Association 54: 55-69.
Ray, S.M. 1996. Historical perspective on Perkinsus marinus disease of oysters in the Gulf of Mexico. Journal of Shellfish Research 15: 9-11.
Ray, S.M., T.M. Soniat et E.V. Kortright. 2001. Dermowatch: a web-based approach for managing Perkinsus marinus disease of oysters. Journal of Shellfish Research 20: 553-554. (Résumé).
Reece, K.S. et E.M. Burreson. 2004. The role of molecular biology in international regulation: shellfish health. Bulletin of the Aquaculture Association of Canada 104-2: 51-56.
Reece, K.S., J.E. Graves, D. Bushek et W. Belle. 1997a. Molecular markers for the oyster pathogen Perkinsus marinus and preliminary population genetic analysis. Journal of Shellfish Research 16: 274. (Résumé).
Reece, K.S., M.E. Siddall, E.M. Burreson et J.E. Graves. 1997b. Phylogenetic analysis of Perkinsus based on actin gene sequences. The Journal of Parasitology 83: 417-423.
Reece, K.S., D. Bushek et J.E. Graves. 1997c. Molecular markers for population genetic analysis of Perkinsus marinus. Molecular Marine Biology and Biotechnology 6: 197-206.
Reece, K.S., D. Bushek et K.L. Hudson. 1999. Analysis of the geographic distribution of Perkinsus marinus strains. Journal of Shellfish Research 18: 320. (Résumé).
Reece, K.S., G.D. Brown, K.L. Hudson et K. Apakupakul. 2001a. Inter- and intra-specific genetic variation among Perkinsus species: implications for species identification and development of molecular diagnostics. Journal of the Shellfish Research 20: 554. (Résumé).
Reece, K.S., D. Bushek, K.L. Hudson etd J.E. Graves. 2001b. Geographic distribution of Perkinsus marinus genetic strains along the Atlantic and Gulf coasts of the USA. Marine Biology 139: 1047-1055.
Reece, K.S., C.F. Dungan et E.M. Burreson. 2008. Molecular epizootiology of Perkinsus marinus and P. chesapeaki infections among wild oysters and clams in Chesapeake Bay, USA. Diseases of Aquatic Organisms 82: 237–248.
Remacha-Triviño, A., D. Borsay-Horowitz, C. Dungan, X. Gual-Arnau, J. Gómez-Leon, L. Villamil et M. Gómez-Chiarri. 2008. Numerical quantification of Perkinsus marinus in the American oyster Crassostrea virginica (Gmelin, 1791) (Mollusca:Bivalvia) by modern stereology. The Journal of Parasitology 94: 125–136.
Roberts, S., R. Smolowitz et R. Karney. 2008. Characterizing disease resistance in native oysters that have experienced disease pressure. Journal of Shellfish Research 27: 1048. (Résumé).
Robledo, J.A.F., D.J. Gauthier, C.A. Coss, A.C. Wright et G.R. Vasta. 1998. Species-specificity and sensitivity of a PCR-based assay for Perkinsus marinus in the eastern oyster, Crassostrea virginica: a comparison with the fluid thioglycollate assay. The Journal of Parasitology 84: 1237-1244.
Robledo, J.A.F., A.C. Wright, A.G. Marsh et G.R. Vasta. 1999. Nucleotide sequence variability in the nontranscribed spacer of the rRNA locus in the oyster parasite Perkinsus marinus. The Journal of Parasitology 85: 650-656.
Robledo, J.A.F., P. Courville, M.F.M. Cellier et G.R. Vasta. 2004. Gene organization and expression of the divalent cation transporter Nramp in the protistan parasite Perkinsus marinus The Journal of Parasitology 90: 1004–1014.
Robledo, J.A.F., E. Caler, M. Matsuzaki, P.J. Keeling, D. Shanmugam, D.S. Roos et G.R. Vasta. 2011. The search for the missing link: a relic plastid in Perkinsus? International Journal for Parasitology 41: 1217-1229.
Romestand, B., J. Torreilles et P. Roch. 2001. Production of monoclonal antibodies against the Protozoa, Perkinsus marinus: estimation of parasite multiplication in vitro. Aquatic Living Resources 14: 351-357.
Romestand, B., F. Corbier et P. Roch. 2002. Protease inhibitors and haemagglutinins associated with resistance to the protozoan parasite, Perkinsus marinus, in the Pacific oyster, Crassostrea gigas. Parasitology 125: 323-329.
Rothschild, B.J., J.S. Ault, P. Goulletquer et M. Héral. 1994. Decline of the Chesapeake Bay oyster population: a century of habitat destruction and overfishing. Marine Ecology Progress Series 111: 29-39.
Russell, S., S. Penna et R. French. 2000. Comparative evaluation of the multiplex PCR with conventional detection methods for Haplosporidium nelsoni (MSX), Haplosporidium costale (SSO), and Perkinsus marinus (Dermo) in the eastern oyster, Crassostrea virginica. Journal of Shellfish Research 19: 580-581. (Abstract). Cet abstrait est reprise dans le Journal of Shellfish Research 19: 648.
Russell, S., S. Frasca Jr, I. Sunila et R.A. French. 2004. Application of a multiplex PCR for the detection of protozoan pathogens of the eastern oyster Crassostrea virginica in field samples. Diseases of Aquatic Organisms 59: 85-91.
Sabry, R.C., R.D. Rosa, A.R.M. Magalhães, M.A. Barracco, T.C.V. Gesteira et P.M. da Silva. 2009. First report of Perkinsus sp. infecting mangrove oysters Crassostrea rhizophorae from the Brazilian coast. Diseases of Aquatic Organisms 88: 13-23.
Sabry, R.C., T.C.V. Gesteira, A.R.M. Magalhães, M.A. Barracco, C. Guertler, L.P. Ferreira, R.T. Vianna et P.M. da Silva. 2013. Parasitological survey of mangrove oyster, Crassostrea rhizophorae, in the Pacoti River Estuary, Ceará State, Brazil. Journal of Invertebrate Pathology 112: 24-32.
Saldarriaga, J.F., M.L. McEwan, N.M. Fast, F.J.R. Taylor et P.J. Keeling 2003. Multiple protein phylogenies show that Oxyrrhis marina and Perkinsus marinus are early branches of the dinoflagellate lineage. International Journal of Systematic and Evolutionary Microbiology 53: 355-365.
Saunders, G.L., E.N. Powell et D.H. Lewis. 1993. A determination of in vivo growth rates for Perkinsus marinus, a parasite of the eastern oyster Crassostrea virginica (Gmelin, 1791). Journal of Shellfish Research 12: 229-240.
Scarratt, D. 2000. Oyster diseases and the internet: multi-agency team developes "Dermowatch". Shellfish World 1(4): 19.
Schott, E.J. et G.R. Vasta. 2003. The PmSOD1 gene of the protistan parasite Perkinsus marinus complements the sod2 Δ mutant of Saccharomyces cerevisiae, and directs an iron superoxide dismutase to mitochondria. Molecular and Biochemical Parasitology 126: 81-92.
Schott, E.J., W.T. Pecher, F. Okafor et G.R. Vasta. 2003a. The protistan parasite Perkinsus marinus is resistant to selected reactive oxygen species. Experimental Parasitology 105: 232-240.
Schott, E.J., J.-A.F. Robledo, A.C. Wright, A.M. Silva etd G.R. Vasta. 2003b. Gene organization and homology modeling of two iron superoxide dismutases of the early branching protist Perkinsus marinus. Gene 309: 1-9.
Schott, E.J., J.A. Fernández-Robledo, M.R. Alavi et G.R. Vasta. 2008. Susceptibility of Crassostrea ariakensis (Fujita 1913) to Bonamia and Perkinsus spp. infections: potential for disease transmission between oyster species. Journal of Shellfish Research 27: 541-549.
Shaheen, A.A. 1999. Long-term survival of Perkinsus marinus cells outside its host. Journal of Shellfish Research 18: 320. (Résumé).
Shridhar, S., K. Hassan, D.J. Sullivan, G.R. Vasta et J.A. Fernández Robledo. 2013. Quantitative assessment of the proliferation of the protozoan parasite Perkinsus marinus using a bioluminescence assay for ATP content. International Journal for Parasitology: Drugs and Drug Resistance 3: 85-92.
Siddall, M.E., K.S. Reece, J.E. Graves et E.M. Burreson. 1997. ‘Total evidence' refutes the inclusion of Perkinsus species in the phylum Apicomplexa. Parasitology 115: 165-176.
Sokolova, I.M., J.D. Oliver etd L.J. Leamy. 2006. An AFLP approach to identify genetic markers associated with resistance to Vibrio vulnificus and Perkinsus marinus in eastern oysters. Journal of Shellfish Research 25: 95-100.
Soniat, T.M. 1996. Epizootiology of Perkinsus marinus disease of eastern oysters in the Gulf of Mexico. Journal of Shellfish Research 15: 35-43.
Soniat, T.M. et J.D. Gauthier. 1989. The prevalence and intensity of Perkinsus marinus from the mid northern Gulf of Mexico, with comments on the relationship of the oyster parasite to temperature and salinity. Tulane Studies in Zoology and Botany 27: 21-27.
Soniat, T.M. et M.L. Koenig. 1982. The effect of parasitism by Perkinsus marinus on the free amino acid composition of Crassostrea virginica mantle tissue. Journal of Shellfish Research 2: 25-28.
Soniat, T.M. et E.V. Kortright. 1998. Estimating time to critical levels of Perkinsus marinus in eastern oysters, Crassostrea virginica. Journal of Shellfish Research 17: 1071-1080.
Soniat, T.M., E.V. Kortweight et S.M. Ray. 2000. Dermowatch: a new tool for managing Perkinsus marinus diseases in eastern oysters, Crassostrea virginica. Journal of Shellfish Research 19: 666. (Abstract). (L'information sur le DermoWatch program est disponible à : https://www.oystersentinel.org/). (en anglais seulement)
Soniat, T.M., J.M. Klinck, E.N. Powell et E.E. Hofmann. 2006. Understanding the success and failure of oyster populations: climatic cycles and Perkinsus marinus. Journal of Shellfish Research 25: 83-93.
Soniat, T.M., E.E. Hofmann, J.M. Klinck et E.N. Powell. 2009. Differential modulation of eastern oyster (Crassostrea virginica) disease parasites by El Niño-Southern Oscillation and the North Atlantic Oscillation. International Journal of Earth Science (Geol Rundsch) 98: 99-114.
Soniat, T.M., J.M. Klinck, E.N. Powell et E.E. Hofmann. 2012. Understanding the success and failure of oyster populations: periodicities of Perkinsus marinus and oyster recruitment, mortality and size. Journal of Shellfish Research 31: 635-646.
Soudant, P. et F.L.E. Chu. 2001. Lipid class and fatty acid composition of the protozoan parasite of oysters, Perkinsus marinus cultivated in two different media. Journal of Eukaryotic Microbiology 48: 309-319.
Stelter, K., N.M. El-Sayed et F. Seeber. 2007. The expression of a plant-type ferredoxin redox system provides molecular evidence for a plastid in the early dinoflagellate Perkinsus marinus. Protist 158: 119-130.
Stickler, S.M., E. Wagner, V.G. Encomio et J.F. LaPeyre. 2001. Natural dermo resistance and its role in the development of hatcheries for the Gulf of Mexico. Journal of Shellfish Research 20: 557. (Résumé).
Sunila, I., R.M. Hamilton et C.F. Dungan. 2001. Ultrastructural characteristics of the in vitro cell cycle of the protozoan pathogen of oysters, Perkinsus marinus. The Journal of Eukaryotic Microbiology 48: 348-361.
Tall, B.D., J.F. La Peyer, J.W. Bier, M.D. Miliotis, D.E. Hanes, M.H. Kothary, D.B. Shah et M. Faisal. 1999. Perkinsus marinus extracellular protease modulates survival of Vibrio vulnificus in eastern oyster (Crassostrea virginica) hemocytes. Applied and Environmental Microbiology 65: 4261-4263.
Tanguy, A., X. Guo et S.E. Ford. 2004. Discovery of genes expressed in response to Perkinsus marinus challenge in eastern (Crassostrea virginica) and Pacific (C. gigas) oysters. Gene 338: 121-131.
Tasumi, S. et G.R. Vasta. 2007. A galectin of unique domain organization from hemocytes of the eastern oyster (Crassostrea virginica) is a receptor for the protistan parasite Perkinsus marinus. Journal of Immunology 179: 3086-3098.
Tarnowski, M. (editor). 2003. Maryland Oyster Population Status Report 2002 Fall Survey. Maryland Department of Natural Resources, Fisheries Service. pp. 32.
Tarnowski, M. (editor). 2005. Maryland Oyster Population Status Report 2003 and 2004 Fall Surveys. Maryland Department of Natural Resources, Fisheries Service. pp. 33.
Taveekijakarn, P., T. Somsiri, S. Puttinaowarat, S. Tundavanitj, S. Chinabut et G. Nash. 2008 (2005). Parasitic fauna of rock oyster (Saccostrea forskali) cultured in Thailand. In: Bondad-Reantaso, M. G., C. V. Mohan, M. Crumlish, R.P. Subasinghe (eds.) Diseases in Asian Aquaculture VI, Colombo, Sri Lanka, 25-28 October 2005, pp. 335-342 (Pour consulter la version électronique voir : http://www.fhs-afs.net/publications.htm). (en anglais seulement)
Thompson, P., B. Rosenthal et M.P. Hare. 2008. Microsatellite analysis of Perkinsus marinus genotypes from Florida and New Jersey indicates limited parasite migration between populations. Journal of Shellfish Research 27: 1057. (Résumé).
Thompson, P.C., B.M. Rosenthal et M.P. Hare. 2011. An evolutionary legacy of sex and clonal reproduction in the protistan oyster parasite Perkinsus marinus. Infection, Genetics and Evolution 11: 598-609.
Tirard, C.T., R.M. Grossfeld, A.K. Volety et F.-L.E. Chu. 1995. Heat shock proteins of the oyster parasite Perkinsus marinus. Diseases of Aquatic Organisms 22: 147-151.
Ulrich, P.N., J.W. Ewart et A.G. Marsh. 2007. Prevalence of Perkinsus marinus (Dermo), Haplosporidium nelsoni (MSX), and QPX in Bivalves of Delaware's Inland Bays and quantitative, high-throughput diagnosis of Dermo by QPCR. Journal of Eukaryotic Microbiology 54: 520-526.
Vasta, G.R., J.D. Gauthier et A.G. Marsh. 1995. Molecular and biochemical adaptations of the protozoan pathogen Perkinsus marinus for its host, Crassostrea virginica: current research and future perspectives (or "the best defence is a good offence"). Journal of the Marine Biotechnology 3: 35-41.
Vasta, G.R., A.G. Marsh, J.D. Gauthier, A.C. Wright, J.A. Robledo, H. Ahmed, T.J. Burkett, G.M. Ruiz et C.A. Coss. 1997. Molecular basis for the etiology of Perkinsus marinus disease and development of PCR-based diagnostic assays. Journal of Shellfish Research 16: 277. (Résumé).
Venegas-Calerón, M., F. Beaudoin, O. Sayanova et J.A. Napier. 2007. Co-transcribed genes for long chain polyunsaturated fatty acid biosynthesis in the protozoon Perkinsus marinus include a plant-like FAE1 3-ketoacyl coenzyme A synthase. Journal of Biological Chemistry 282: 2996-3003.
Villalba, A., K.S. Reece, M.C. Ordás, S.M. Casas et A. Figueras. 2004. Perkinsosis in molluscs: A review. Aquatic Living Resources 17: 411-432.
Villamil, L., J. Gómez-León et M. Gómez-Chiarri. 2007. Role of nitric oxide in the defenses of Crassostrea virginica to experimental infection with the protozoan parasite Perkinsus marinus. Developmental and Comparative Immunology 31: 968-977.
Volety, A.K. et F.-L.E. Chu. 1994. Comparison of infectivity and pathogenicity of meront (trophozoite) and prezoosporangiae stages of the oyster pathogen Perkinsus marinus in eastern oysters, Crassostrea virginica (Gmelin, 1791). Journal of Shellfish Research 13: 521-527.
Volety, A.K. et F.-L.E. Chu. 1995. Suppression of chemiluminescence of eastern oyster (Crassostrea virginica) hemocytes by the protozoan parasite Perkinsus marinus. Developmental and Comparative Immunology 19: 135-142.
Volety, A.K. et F.-L.E. Chu. 1997. Acid phosphatase activity in Perkinsus marinus, the protistan parasite of the American oyster, Crassostrea virginica. The Journal of Parasitology 83: 1093-1098.
Volety, A.K. et W.S. Fisher. 2000. In vitro killing of Perkinsus marinus by hemocytes of oysters Crassostrea virginica. Journal of Shellfish Research 19: 600. (Résumé).
Volety, A., F.O. Perkins, R. Mann et P.R. Hershberg. 2000. Progression of diseases caused by the oyster parasite, Perkinsus marinus and Haplosporidium nelsoni, in Crassostrea virginica on constructed intertidal reefs. Journal of Shellfish Research 19: 341-347.
Wang, Y. et X. Guo. 2008. Mapping disease-resistance genes in the eastern oyster (Crassostrea virginica). Journal of Shellfish Research 27: 1061-1062. (Résumé).
Wang, S., E. Peatman, H. Liu, D. Bushek, S.E. Ford, H. Kucuktas, J. Quilang, P. Li, R. Wallace, Y. Wang, X. Guo et Z. Liu. 2010. Microarray analysis of gene expression in eastern oyster (Crassostrea virginica) reveals a novel combination of antimicrobial and oxidative stress host responses after dermo (Perkinsus marinus) challenge. Fish and Shellfish Immunology 29: 921-929.
White, M.E., E.N. Powell, S.M. Ray et E.A. Wilson. 1987. Host-to-host transmission of Perkinsus marinus in oyster Crassostrea virginica) populations by the ectoparasitic snail Boonea impressa (Pyramidellidae). Journal of Shellfish Research 6: 1-5.
White, D.L., D. Bushek, D.E. Porter et D. Edwards. 1998. Geographic information systems (GIS) and kriging: analysis of the spatial and temporal distribution of the oyster pathogen Perkinsus marinus in a developed and an undeveloped estuary. Journal of Shellfish Research 17: 1473-1476.
Willson, L.L. et L.E. Burnett. 2000. Whole animal and gill tissue oxygen uptake in the eastern oyster, Crassostrea virginica: effects of hypoxia, hypercapnia, air exposure, and infection with the protozoan parasite Perkinsus marinus. Journal of Experimental Marine Biology and Ecology 246: 223-240.
Wilson, E.A., E.N. Powell, M.A. Craig, T.L. Wade et J.M. Brooks. 1990. The distribution of Perkinsus marinus in Gulf Coast oysters: Its relationship with temperature, reproduction, and pollutant body burden. Internationale Revue der Gesamten Hydrobiologie 75: 533-550.
Wilson, E.A., E.N. Powell, T.L. Wade, R.J. Taylor, B.J. Presley et J.M. Brooks. 1992. Spatial and temporal distributions of contaminant body burden and disease in Gulf of Mexico oyster populations: the role of local and large-scale climatic controls. Helgoländer Meeresuntersuchungen 46: 201-235.
Winnicki, S.M., W. Carden, B. Holohan, G. Ralph, E. Ward et B. Allam. 2008. Establishment of Perkinsus marinus infection in Crassostrea virginica: insights into the potrtal of entry and the potential role of marine aggregates. Journal of Shellfish Research 27: 1064. (Résumé).
Winstead, J.T. et J.A. Couch. 1988. Enhancement of protozoan pathogen Perkinsus marinus infections in American oysters Crassostrea virginica exposed to the chemical carcinogen n-nitrosodiethylamine (DENA). Diseases of Aquatic Organisms 5: 205-213.
Wright, A.C., H. Ahmed, D.J. Gauthier, A.M. Silva et G.R. Vasta. 2002. cDNA cloning and characterization of two iron superoxide dismutases from the oyster parasite Perkinsus marinus. Molecular and Biochemical Parasitology 123: 73-77.
Xue, Q.-G., G.L. Waldrop, K.L. Schey, N. Itoh, M. Ogawa, R.K. Cooper, J.N. Losso et J.F. La Peyre. 2006. A novel slow-tight binding serine protease inhibitor from eastern oyster (Crassostrea virginica) plasma inhibits perkinsin, the major extracellular protease of the oyster protozoan parasite Perkinsus marinus. Comparative Biochemistry and Physiology Part B 145: 16-26.
Yarnall, H.A., K.S. Reece, N.A. Stokes et E.M. Burreson. 2000. A quantitative competitive polymerase chain reaction assay for the oyster pathogen Perkinsus marinus. The Journal of Parasitology 86: 827-837.
Yee, A., C. Dungan, R. Hamilton, M. Goedken, S. de Guise et I. Sunila. 2005. Apoptosis of the protozoan oyster pathogen Perkinsus marinus in vivo and in vitro in the Chesapeake Bay and Long Island Sound. Journal of Shellfish Research 24: 1035-1042.
Yu, Z. and X. Guo. 2006. Identification and mapping of disease-resistance QTLs in the eastern oyster, Crassostrea virginica Gmelin. Aquaculture 254: 160-170.
Yu, H., Y. He, X. Wang, Q. Zhang, Z. Bao et X. Guo. 2011. Polymorphism in a serine protease inhibitor gene and its association with disease resistance in the eastern oyster (Crassostrea virginica Gmelin). Fish and Shellfish Immunology 30: 757-762.
Zhang, H., D.A. Campbell, N.R. Sturm, C.F. Dungan et S. Lin. 2011. Spliced leader RNAs, mitochondrial gene frameshifts and multi-protein phylogeny expand support for the genus perkinsus as a unique group of alveolates. PLoS ONE 6(5): e19933. doi:19910.11371/journal.pone.0019933 (Pour consulter la version électronique à voir : http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0019933). (en anglais seulement)
Zhang, H., C.F. Dungan et S. Lin. 2011. Introns, alternative splicing, spliced leader trans-splicing and differential expression of pcna and cyclin in Perkinsus marinus. Protist 162: 154-167.
Citation
Bower, S.M. (2013) : Sommaire des maladies infectieuses et des parasites des mollusques et crustacés exploités commercialement : Perkinsus marinus (maladie « Dermo ») de l'huître.
Date de la dernière révision : Septembre 2013.
Faire parvenir les commentaires à Susan Bower
- Date de modification :