Bonamia exitiosa (bonamiose dediverses huîtres )
Sur cette page
Catégorie
Catégorie 3 (pas d'hôte au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Maladie microcellulaire, bonamiose, maladie hémocytaire de l'huître.
Nom scientifique ou affiliation taxonomique
Bonamia exitiosa (=exitiosus) (Hine et al. 2001, Berthe et Hine 2003), ayant une forte ressemblance avec Bonamia ostreae, un agent pathogène de l'huître plate européenne Ostrea edulis. Depuis la première description de ce parasite, des microcellules de B. exitiosa et du genre B. exitiosa ont été signalées chez diverses huîtres à divers endroits dans le monde d'après des similarités génétiques dans la séquence d'un gène, plus précisément des segments de la petite sous-unité (SSU ou 18S) et des espaceurs transcrits internes (ITS1-5.8S-ITS2 qui composent le locus de l'ADNr de l'ITS) du complexe de gènes de l'ADN ribosomique (Hill et al. 2010b; Hill et al. 2014). Hill et al. (2014) ont recommandé d'utiliser le locus de l'ADNr de l'ITS pour déterminer les limites spécifiques de B. exitiosa ainsi que d'autres espèces de Bonamia. Avant 2010, on ne savait pas si les microcellules du genre Bonamia exitiosa étaient composées de différentes souches d'une espèce ou si le groupe était constitué de plusieurs espèces (Lormann et al. 2009; Hill et al. 2010b). Pour la majorité des microcellules dans ce groupe de type B. exitiosa, on disposait de relativement peu de données sur l'histologie, l'ultrastructure et les séquences moléculaires; ces données n'étaient pas suffisantes pour distinguer les espèces sans équivoque (Hill et al. 2010b). Comme d'autres espèces de Bonamia, B. exitiosa a été relié à l'haplosporidie d'après l'analyse de l'ADN (Hill et al. 2010; Hartikainen et al. 2014). Engelsma et al. (2014) ont indiqué que le genre Bonamia représente un clade dérivé dans le phylum Haplosporidia dont les membres ont généralement adopté (1) des cycles de vie fondés sur une transmission directe entre les huîtres de formations cellulaires amiboïdes unicléées, et (2) l'infection intracellulaire des hémocytes de l'huître par ces formations cellulaires. L'analyse moléculaire a été utilisée pour distinguer deux bouquets du genre Bonamia : un bouquet de microcellules Bonamia perspora et Bonamia ostreae, et un bouquet de microcellules de type Bonamia exitiosa (Hill et al. 2010b). Apparemment, B. exitiosa et Bonamia roughleyi sont très similaires sur le plan génétique (Abollo et al. 2008; Hill et al. 2010). Hill et al. (2010) ont regroupé ces deux espèces nommées dans le clade B. exitiosa/B. roughleyi et ont indiqué que les motifs justifiant d'établir des limites entre les espèces parmi les microcellules principalement australes ayant une affinité pour B. exitiosa et B. roughleyi demeurent vagues.
Répartition géographique
Bonamia exitiosa a été décrit à l'origine chez Ostrea chilensis dans le détroit de Foveaux et à d'autres endroits autour de l'île Sud, en Nouvelle-Zélande, y compris la baie Golden, la baie de Tasman, les détroits de Marlborough et le port de Wellington (Hines 1997, Dinamani et al. 1987, Hine et al. 2001). Plus récemment, des infections par B. exitiosa ont été détectées chez Ostrea stentina (=Ostrea aupouria) de l'île Nord, en Nouvelle-Zélande (Hill et al. 2014). Depuis la fin des années 1980, des Bonamia non identifiés ont été signalés à divers endroits dans le monde. Une récente analyse génétique d'un gène (plus précisément, de segments de la petite sous-unité [SSU ou 18S] et régions des espaceurs transcrits internes [ITS1-5.8S-ITS2] du gène de l'ADN ribosomique) a servi à identifier certains de ces organismes en tant que B. exitiosa (White et al. 2008; Hill et al. 2014; Engelsma et al. 2014). Les emplacements signalés et les hôtes correspondants sont les suivants :
Australie : chez des individus de la Nouvelle-Galles-du-Sud (divers emplacements) chez Ostrea angasi et possiblement Saccostrea glomerata (Corbeil et al. 2006b; Carnegie et al. 2014), et probablement le port de Phillip Bay, Victoria, la baie de Georges, la Tasmanie et Albany, l'Australie-Occidentale chez O. angasi (Hine et Jones 1994; Engelsma et Hine 2009a; Hill et al. 2010b). Bien que B. exitiosa ait été détecté sans ambiguïté à l'aide de méthodes moléculaires chez S. glomerata du sud-est de l'Australie, il demeure difficile de trouver des preuves visuelles de l'infection (Engelsma et al. 2014).
Europe : chez des individus de la côte galicienne (nord-ouest de l'Espagne), du delta de l'Èbre sur la côte méditerranéenne de l'Espagne, du golfe Manfredonia, de l'Italie (mer Adriatique) et de la côte sud-ouest de l'Angleterre chez Ostrea edulis, y compris des infections simultanées par Bonamia ostreae (Abollo et al. 2008; Narcisi et al. 2010, Carrasco et al. 2012, Ramilo et al. 2014b, Longshaw et al. 2013, Laing et al. 2014, Engelsma et al. 2014). En outre, des infections par B. exitiosa ont été détectées par analyse moléculaire dans un échantillon de larves prélevées en 2008 dans la cavité palléale d'O. edulis provenant de la baie de Quiberon, dans le sud de la Bretagne, en France (Arzul et al. 2011). Arzul et al. (2011) et le manuel diagnostique des maladies des animaux aquatiques de l'OIE par Bonamia exitiosa (2012) mentionnent que B. exitiosa aurait été détecté chez O. edulis sur la côte méditerranéenne de la France.
Tunisie : chez des individus de Hammamet chez Ostrea stentina (Hill et al. 2010a, 2014).
États-Unis : chez des individus des eaux de la Caroline du Nord et de l'Atlantique au sud de la Floride (lagon de la rivière Indian) chez des huîtres Crassostrea ariakensis introduites à des fins expérimentales (Carnegie et al. 2005, 2006; Burreson et al. 2004; Bishop et al. 2006; Audemard et al. 2008a, b; Carnegie et al. 2008; Dungan et al. 2012); de la Caroline du Nord et de la Caroline du Sud chez l'huître Ostrea stentina non commerciale qui est également reconnue pour être infectée par Bonamia perspora (Dungan et al. 2012; Audemard et al. 2014; Hill et al. 2014); et de la Californie (faux chenal Elkhorn) chez Ostrea lurida (Hill et al. 2014). Bonamia exitiosa serait aussi peut-être présent chez Crassostrea virginica dans l'est des États-Unis (Engelsma et al. 2014; Hill et al. 2014 et voir les rapports de l'OIE 2012 et 2013 dans les références ci-après). L'hybridation in situ (HIS) a été utilisée pour détecter un parasite étroitement lié à B. exitiosa dans des matériaux histologiques archivés d'O. edulis de la baie de Chincoteague, en Virginie (Hill et al. 2014).
Argentine : de la baie de Sa Antonio, dans le golfe San Matías, en Patagonie, chez Ostrea puelchana et Ostrea stentina (Kroeck et Montes 2005; Oehrens Kissner et al. 2014; Hill et al. 2014).
Des parasites génétiquement similaires, mais ne portant encore aucun nom ont été signalés chez Ostrea chilensis aux Îles Chiloe et Quihua, au Chili (Kern 1993; Campalans et al. 2000; Lohrmann et al. 2009). Une analyse plus approfondie réalisée par Hill et al. (2014) a indiqué que l'espèce Bonamia chez O. chilensis du Chili est apparue dans le clade B. exitiosa dans les analyses phylogénétiques de l'ADNr de la SSU, mais s'est éloignée de ce clade dans les analyses de l'ADNr de l'ITS. Cela s'applique également à une espèce étroitement liée de Bonamia chez Ostrea edulis de la baie de Tomales, en Californie, aux États-Unis (Hill et al. 2014). Hill et al. (2014) et Engelsma et al. (2014) en ont donc conclu que l'inclusion des parasites d' O. chilensis au Chili et d'O. edulis en Californie dans l'espèce B. exitiosa ne serait peut-être pas justifiée, et que ces taxons représenteraient peut-être de nouvelles espèces.
Espèces hôtes
Ostrea chilensis (=Tiostrea chilensis, =Tiostrea lutaria), Ostrea edulis et Ostrea angasi, Ostrea stentina (Ostrea (=Ostreola) equestris, =Ostrea aupouria), Ostrea lurida, Ostrea puelchana and Crassostrea ariakensis are hosts of B. exitiosa selon la visualisation du parasite dans les tissus des huîtres et la similarité de la séquence moléculaire de l'opéron de l'ARNr de la SSU (Corbeil et al. 2006b, Abollo et al. 2008, Narcisi et al. 2010, Carrasco et al. 2012, Dungan et al. 2012, Longshaw et al. 2013, Ramilo et al. 2014b, Carnegie et al. 2014, Audemard et al. 2014, Hill et al. 2014).). Crassostrea virginica peut aussi être un hôte approprié (Engelsma et al., 2014 et voir les rapports 2012 et 2013 de l'OIE dans les références ci-dessous).Toutefois, la pathologie associée à l'infection chez O. chilensis et O. angasi est très différente (Hines 1996b, Engelsma and Hine 2009a). Dans le sud-est de l'Australie, B. exitiosa a été détectée sans ambiguïté à l'aide de méthodes moléculaires dans Saccostrea glomerata, mais les signes visibles d'infection demeurent insaisissables (Engelsma et al., 2014). De plus, en Espagne, l'ADN de B. exitiosa (sans visualiser la microcellule) a été détecté dans les tissus de Crassostrea gigas, ce qui indique la possibilité que ce parasite survienne dans un milieu extracellulaire et dans d'autres hôtes non typiques (Lynch et al., 2010). Selon Hill et al. (2010b), l'examen de O. stentina (=O. aupouria) en Nouvelle-Zélande a produit un produit de PCR ressemblant à B. exitiosa/B. roughleyi. Notez que l'huître O. stentina (=O. aupouria, =O. equestris) est associée à B. exitiosa en Nouvelle-Zélande, en Argentine, dans l'est des États-Unis et en Méditerranée.
Impact sur les hôtes
Comme Bonamia ostreae, B. exitiosa est un protozoaire intrahémocytique se répand rapidement à tout le système, le nombre élevé de parasites coïncidant avec la mort de l'huître. En Nouvelle-Zélande, la mortalité à grande échelle observée chez les huîtres de pêche indigènes (91 % entre 1975 et 1992 dans le détroit de Foveaux [Doonan et al. 1994; Cranfield et al.; 2005]) a été attribuée à ce parasite. La pêche a été fermée en 1993, ce qui a entraîné de graves répercussions économiques sur les collectivités locales. Des enquêtes ont montré que B. exitiosa était présent dans les huîtres du détroit de Foveaux en 1964, et on suggère une association de longue date entre l'hôte et le parasite en raison d'une variation saisonnière de l'infection (Hine 1991a,b). Le schéma annuel d'infection bien défini comprend: des niveaux d'infection très faibles pendant l'hiver austral, de nombreux petits stades uninucléés étant présents du printemps au début de l'été, des stades uni-nucléés amiboïdes de plus grande taille à la fin de l'été et en automne qui correspond avec la prévalence la plus élevée de l'infection et la chute de la population parasitaire au début de l'hiver (Hine 1991a, b)Une analyse de l'événement épizootique de 1986 à 1992 a mené Cranfield et al. (2005) à suggérer que certains facteurs de stress ont rendu l'huître plus vulnérable à un parasite enzootique. De plus, une mortalité épizootique a été observée chez O. angasi en Tasmanie, en Australie et, autant en Nouvelle-Zélande qu'en Australie, des tentatives menées par conchyliculteurs se trouvant dans la zone infectée ont obtenu un taux de mortalité de 100 % (Engelsma et Hine 2009b). Bonamia exitiosa a émergé en tant que maladie la plus grave chez l'espèce introduite C. ariakensis sur la côte Est des États-Unis, notamment dans des conditions d'eau euhaline chaude et chez des huîtres dont la coquille mesure moins de 50 mm de longueur. Cette maladie menaçante peut empêcher la tentative d'utilisation de C. ariakensis dans le cadre des efforts visant à développer une industrie aquacole fondée sur l'huître dans l'est des États-Unis (Audemard et al. 2014). Dans cette zone, le processus de transmission naturelle de B. exitiosa affiche un cycle saisonnier plus fort avec des pics de mortalité pendant les mois d'été (Carnegie et al. 2008), et le parasite est beaucoup moins prévalent en hiver (Engelsma et al. 2014).
À leur entrée dans l'hôte (probablement par l'intestin), les parasites B. exitiosa sont phagocytés par les hémocytes, mais ne sont pas tués par ces cellules. Après la croissance et la division du parasite, la cellule hôte se lyse et libère ainsi moins de 20 B. exitiosa, qui sont à leur tour phagocytés. La production accrue d'hémocytes entraîne une hémocytose, au détriment de la gamétogenèse. Des hémocytes infectés sont tout d'abord observés dans les tissus conjonctifs, mais à mesure que l'infection progresse, on les retrouve dans tous les tissus. Ils sont évacués par l'intermédiaire des gonades, des reins, du tube digestif et des branchies, soit par des fuites tissulaires, par diapédèse ou par décomposition de l'hôte (Hine 1991a). Le décès pourrait être causé par l'épuisement des réserves d'énergie attribuable à l'augmentation de la production d'hémocytes, plutôt que par l'effet toxique du parasite (Hines 1997). Ramilo et al. (2014a) ont utilisé un test d'hybridation in situ pour déterminer que la gonade d'O. edulis était la zone où B. exitiosa était le plus souvent localisée et était l'organe exclusif de l'infection chez certains O. edulis.
D'autres facteurs de stress tels que l'exposition à des températures extrêmes (7 ou 26 °C) et une forte salinité (40 %), l'inanition (conservation prolongée dans l'eau de mer filtrée), la manipulation (brassage vigoureux quatre fois par jour) ou une forte infection par un apicomplexé pourraient avoir une incidence sur la dynamique de B. exitiosa chez l'huître O. Chilensis en Nouvelle-Zélande (Hines et al. 2002; Hine 2002). La cohabitation de l'espèce avec des huîtres infectées dans des réservoirs semble favoriser la propagation de l'infection (Hines et al. 2002).
L'absence de mortalité chez les huîtres infectées à des niveaux très faibles pourrait être attribuable à la cinétique hôte-parasite plutôt qu'à un changement de la pathogénicité des parasites (Hines 1996a). Comme la transmission de Bonamia exitiosa se fait directement et horizontalement, de fortes densités d'huîtres dans des bancs rapprochés et l'absence de résistance à l'infection favorisent le développement d'épizooties. Toutefois, les épizooties diminuent de façon marquée la densité des stocks et sont plus susceptibles de tuer les huîtres vulnérables plutôt que celles présentant une résistance ou une tolérance. Par conséquent, il faut créer des conditions ne favorisant pas la transmission horizontale directe, comme une faible densité et une résistance accrue, puisque les charges parasitaires plus faibles n'entraînent pas de maladie ou de mortalité (Hines 1997).
Aucune mortalité massive associée à la bonamiose n'a été observée en Nouvelle-Zélande depuis 1992, et les stocks d'huîtres sont en train de se rétablir, mais ce parasite est encore répandu à faible intensité, à des niveaux semblables à ceux de 1964 (Hine et Jones 1994). L'absence de mortalité chez les huîtres infectées à des niveaux très faibles pourrait être attribuable à la cinétique hôte-parasite plutôt qu'à un changement de la pathogénicité des parasites (Hines 1996a). En Europe, B. exitiosa a été associé à la mortalité d'O. edulis en Galice, en Espagne (Carrasco et al. 2012). Cependant, une faible prévalence de l'infection et aucune mortalité ont été signalées en lien avec la détection de B. exitiosa chez O. edulis sur la côte Adriatique en Italie (Narcisi et al. 2010) et sur la côte méditerranéenne en Espagne (Carrasco et al. 2012), mais pas chez O. stentina sur la côte de la Tunisie (Hill et al. 2010). Dans le golfe de San Matías, en Argentine, où un taux de mortalité de 95 % a été observé chez l'huître d'élevage Ostrea puelchana en 1995-1996, l'évaluation de l'état de B. exitiosa chez les populations naturelles d'O. puelchana 14 années après l'épizootie révèle que la densité d'huîtres a nettement diminué et que la taille moyenne des huîtres est plus faible, ce qui indique que la bonamiose a contrôlé la structure de la population des huîtres dans les bancs d'huîtres persistants au cours de cette période (Oehrens Kissner et al. 2014).
Dans le but de comprendre la base moléculaire de la réaction immunitaire d'O. edulis à la bonamiose, Martín-Gómez et al. (2012) ont utilisé une combinaison de méthodes d'hybridation soustractive suppressive (HSS) et de réaction en chaîne de la polymérase quantitative (qPCR) pour déterminer les gènes intervenant dans le développement de réponses à l'infection, tant aux premiers stades qu'aux stades avancés de la maladie causée par B. exitiosa ou Bonamia ostreae. Ils ont déterminé que l'expression de certains gènes liés à la transduction des signaux, au stress oxydatif, à la chaperonine et à la synthèse ou l'inflammation du leucotriène dans les hémocytes des O. edulis a changé à la suite de la bonamiose (Martín-Gómez et al. 2012).
Techniques de diagnostic
Engelsma et Hine (2009a) ont indiqué que la PCR, les empreintes de tissus du cœur, et l'histologie peuvent être utilisées dans le cadre d'une surveillance ciblée et de diagnostics de présomption, et que le séquençage de l'ADN est la méthode recommandée pour le diagnostic de confirmation. Engelsma et al. (2014) ont présenté un résumé et une discussion sur les diverses techniques diagnostiques de détection de la présence de Bonamia sp.
Observations générales
Engelsma et Hine (2009a) ont indiqué que B. exitiosa chez O. angasi en Australie provoquait de grandes lésions nécrotiques focales. Cependant, chez les O. chilensis en Nouvelle-Zélande, les infections ont été disséminées dans toute l'huître et il n'y avait pas de lésions des branchies, bien que les branchies congestionnées puissent éclater (Engelsma et Hine, 2009a).
Impression de tissus (« frottis de coeur »)
Préparer des frottis d'empreinte fixés dans de l'acétone (ou du méthanol) à partir de tissu du cœur (de préférence du ventricule, car les oreillettes contiennent beaucoup de cellules séreuses qui rendent la détection du parasite difficile). Appliquer une coloration Wright, Wright-Giemsa ou une coloration équivalente (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter). Rechercher des organismes sphériques ou ovoïdes de 2 à 5 µm ayant un noyau central (apparence d'œuf au plat) à l'intérieur ou à l'extérieur des hémocytes. Remarque : cette méthode grossit les organismes, comparativement aux préparations fraîches ou histologiques. Diggles et al. (2003) ont déterminé que l'examen d'empreintes de tissus du cœur colorées semble être une méthode plus rapide et plus rentable pour le dépistage chez un grand nombre d'huîtres dans les situations où la sensibilité réduite peut être tolérée, mais où une forte spécificité est requise (diminution du nombre de résultats faux positifs).
Histologie
Examiner les coupes transversales de tissus colorés à l'hématoxyline et à l'éosine pour détecter les inclusions hémocytaires d'une taille de 2 à 3 µm (Moore 2006). Dans les infections de stade avancé, Bonamia exitiosa se répand systématiquement. Dans les infections précoces, B. exitiosa est souvent observé dans les hémocytes des infiltrations focales du tissu conjonctif des branchies et du manteau et dans les sinus vasculaires entourant l'estomac et l'intestin. L'histologie semble plus utile dans les études épidémiologiques où la détection de l'état physiologique et d'autres agents pathogènes ou de lésions pathologiques connexes est nécessaire (Diggles et al. 2003). La microscopie photonique (histologie et les impressions de tissus) ne permet pas de faire la distinction entre les espèces de Bonamia (Diggles et al. 2003, Engelsma and Hine 2009a). Toutefois, chez l'huître Ostrea edulis infectée par B. exitiosa et B. ostreae, Abollo et al. ont déterminé que B. exitiosa est de plus grande taille (diamètre moyen = 2,8 µm, erreur type = 0,07 µm, fourchette : 2-5 µm, n = 73) avec un noyau central (parfois sous-central, mais rarement périphérique), comparativement à B. ostreae, qui est de plus petite taille (diamètre moyen = 1,6 µm, erreur type = 0,04 µm, fourchette : 1-2,5 µm, N = 55), avec un noyau périphérique et un faible cytoplasme. Dungan et al. (2012) ont signalé que la plus grande B. exitiosa intrahémocytique chez C. ariakensis de la Floride affichait un diamètre de 3 µm avec un noyau acidiphile central (0,5 µm de diamètre) et des corps plasmodiques contenant de nombreux petits noyaux ou des cellules aussi infectés par des hémocytes en circulation. De même, Longshaw et al. (2013) ont décrit B. exitiosa chez O. edulis de l'Angleterre comme mesurant d'environ 2 à 3 µm de diamètre avec un noyau central ou sous-central affichant des hémocytes infectés contenant jusqu'à cinq microcellules et, rarement, des stades multinucléés de type plasmodie caractérisés par une forme irrégulière et une augmentation du cytoplasme éosinophile ont été observés dans le cytoplasme des hémocytes.
Bonamia exitiosa peut causer une histopathologie très différente chez différents hôtes (Engelsma et Hine 2009a). Par exemple, chez O. angasi en Australie, elle est présente dans des lésions branchiales focales, que l'on croit être le point d'entrée, et un faible nombre de parasites sont observés dans de grandes lésions nécrotiques focales. Le parasite est épithéliotropique. Les infections chez O. chilensis en Nouvelle-Zélande sont disséminées tout au long de l'huître, et il n'y a pas de lésions des lésions branchiales, bien que les branchies congestionnées puissent déchirer. Un grand nombre de parasites peuvent être présents, et le parasite n'est pas épithéliotropique (Engelsma et Hine 2009a). Longshaw et al. (2013) ont indiqué qu'une infiltration d'hémocytes dans les tissus conjonctifs entourant la glande digestive et le manteau, en plus de la présence de nécrose des tissus, était associée à l'infection de B. exitiosa chez O. edulis de l'Angleterre. Cependant, comme l'indiquent Hill et al. (2010b), l'histopathologie ne constitue pas un outil approprié pour l'identification des espèces, car les différences observées pourraient être attribuables aux hôtes.
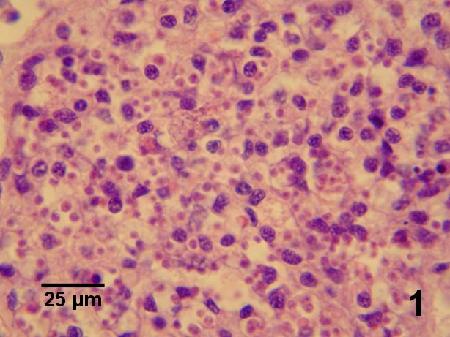
Figure 1. Forte infection par Bonamia exitiosa dans les hémocytes de la gonade d'Ostreachilensis (voir la figure 2 pour un grossissement plus élevé). Image fournie par Ben Diggles, Ph. D., DigsFish Services.
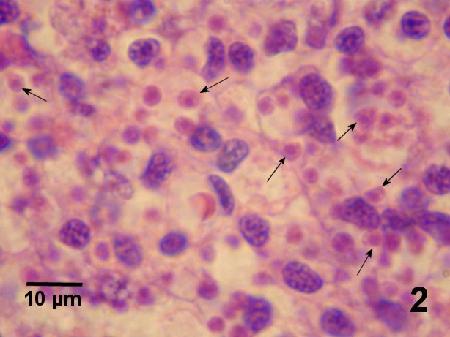
Figure 2. Grossissement de Bonamia exitiosa (flèches) de la figure 1. Image fournie par Ben Diggles, Ph. D., DigsFish Services.
Microscope électronique
Préparer les tissus selon les procédures standard pour la microscopie électronique (par exemple Moore, 2006). L'ultrastructure de B. exitiosa ressemble à celle d'autres haplosporidés en ce sens qu'on observe des haplosporosomes, une haplosporogenèse, une persistance des microtubules mitotiques pendant l'interphase et de l'enveloppe nucléaire pendant la mitose, et qu'elle présente un stade diplocaryotique ou plasmodial multinucléaire. Contrairement aux autres haplosporidés, un stade contenant une grande vacuole découlant de l'agrandissement d'une ou de plusieurs mitochondries a été observé chez B. exitiosa. Les formes plasmodiales de B. exitiosa se distinguent des autres stades de développement de ce parasite par leur taille (entre 4,0 et 4,5 µm), leur structure cellulaire et nucléaire irrégulière, des inclusions cytoplasmiques amorphes (organismes multivésiculaires) et des amas de réticulums endoplasmiques lisses s'apparentant à l'appareil de Golgi. Des formes de densité cytoplasmique intermédiaire étaient plus denses en électrons que les formes plasmodiales et d'un diamètre légèrement inférieur (entre 3,0 et 3,5 µm). Les haplosporosomes se forment à partir de l'appareil de Golgi et de complexes nucléaires et présentent une construction et une structure semblables à celles de certains virus. Hine et Wesney (1992, 1994a) ont émis l'hypothèse que les haplosporosomes pourraient représenter un élément viral préliminaire dans les cellules eucaryotes. Hine et al. (2014) ont considéré les caractéristiques métaboliques (comme les mitochondries, les gouttelettes lipidiques et le réticulum endoplasmique) comme ayant une faible valeur taxonomique. Puisque l'ultrastructure des caractéristiques liées au processus de haplosporogénèse (y compris l'appareil de Golgi, les indentations dans la surface nucléaire, le réseau trans-Golgi putatif, le matériau granulaire périnucléaire et les corps de type haplosporosome) demeure incomprise, seules la forme et la taille des haplosporosomes peuvent revêtir une certaine valeur taxonomique (Hine et al. 2014).
Hill et al. (2010b) ont mentionné que l'ultrastructure peut servir à différencier B. exitiosa et B. ostreae. Toutefois, ils soulignent qu'il faut faire attention lors de la comparaison des stades équivalents, puisque ces deux espèces affichent des stades uninucléés simples et deviennent binucléés, puis se divisent pour revenir à des stades uninucléés, et que certaines différences observées peuvent être liées à l'hôte. Néanmoins, B. exitiosa a un long stade amiboïde trophique qui ne présente apparemment pas de B. ostreae. De plus, le stade uninucléé simple de B. ostreae est plus petit (2,4 ± 0,5 µm) que celui de B. exitiosa (3,0 ± 0,3 µm), B. ostreae affiche des haplosporosomes moins nombreux et plus grands (7 ± 5, 153 ± 18 nm) que B. exitiosa (14 ± 6, 148 ± 11 nm), et B. ostreae comporte moins de sections mitochondriales (2 ± 1) que B. exitiosa (3 ± 1) (Hill et al. 2010b). Les formes denses des stades uninucléés sont également différentes chez les deux espèces. Les formes denses de B. exitiosa sont moins denses et de taille légèrement supérieure (diamètre moyen de 3,0 ± 0,3 µm, N = 61, comparativement à B. ostreae, dont le diamètre moyen est de 2,4 ± 0,5 µm, N = 64), possèdent un plus grand nombre d'haplosporosomes, de mitochondries et d'organismes lipoïdes par section de l'ultrastructure et présentent des mitochondries tubulovésiculaires de plus petite taille que B. ostreae. De plus, les formes denses de B. ostreae ne présentent pas d'appareil de Golgi et de complexes nucléaires liés à la membrane, ni de stade vacuolé (Hines et al. 2001). Bien que Dinamani et al. (1987), Hine et al. (2001) ainsi que Hill et al. (2010a) aient présenté des différences ultrastructurales entre B. ostreae et B. exitiosa, Narcisi et al. (2010) ont constaté que les caractéristiques ultrastructurales de B. exitiosa survenant en Italie variaient tellement qu'elles ne pouvaient pas être utilisées pour identifier de façon définitive une espèce de Bonamia. Néanmoins, Hine et al. (2014) ont indiqué que l'ultrastructure de Bonamia chez O. angasi d'Australie, Crassostrea ariakensis des États-Unis, O. puelchana d'Argentine et O. edulis d'Espagne semblent tous avoir un lien spécifique avec B. exitiosa.
Sondes d'ADN
Les procédures moléculaires pour l'analyse des échantillons à des fins de Bonamia sp. ont été décrites par Moore (2006), et diverses autres sondes utilisées dans des procédures semblables sont décrites par divers auteurs indiquée ci-dessous. La séquence des segments du locus de l'ARN ribosomique, qui comprend des parties de la petite sous-unité du gène de l'ADN ribosomique (SSU de l'ADNr ou ADNr 18S), les régions de l'espaceur transcrit interne (ITS) (composées de la séquence ITS1-5.8S-ITS2) et la grande sous-unité du gène de l'ADN ribosomique (GSU de l'ADNr) de B. exitiosa s'apparente fortement à celle de B. ostreae, mais est suffisamment différente pour montrer le polymorphisme par analyse du polymorphisme de longueur des fragments de restriction (RFLP) (en digérant le produit utilisé pour la réaction en chaîne de la polymérase [PCR], [amplifié par les amorces BO et BOAS, comme l'expliquent Cochennec et al. (2000)], (2000)) with Bgl1 (Promega)). Le profil de B. ostreae est constitué de deux bandes de 120 et 180 paires de bases, tandis que le profil de B. exitiosa est composé d'une bande unique de 304 paires de bases (Hines et al. 2001). Les différences entre B. exitiosa et B. ostreae ont été vérifiées par l'analyse des séquences d'ADN de cette région du génome (Hill et al. 2010b). De plus, une analyse séquentielle de cette région du génome a été réalisée pour confirmer que les isolats de Bonamia provenant d'O. edulis sur la côte galicienne (nord-ouest de l'Espagne), le delta de l'Èbre sur la côte méditerranéenne de l'Espagne, dans le golfe Manfredonia (mer Adriatique) en Italie et sur la côte sud-ouest de l'Angleterre, d'O. chilensis en Nouvelle-Zélande, de C. ariakensis en Floride et en la Caroline du Nord, aux États-Unis, et de Saccostrea glomerata et d'Ostrea angasi en Australie étaient de l'espèce B. exitiosa (Abollo et al. 2008; Narcisi et al. 2010, Hill et al. 2010b, Carrasco et al. 2012, Dungan et al. 2012, Longshaw et al. 2013, Ramilo et al. 2014b, Carnegie et al. 2014).
Bien que l'essai d'hybridation in situ décrit par Cochennec et al. (2000) ait également détecté des haplosporidés d'autres espèces (p. ex., Haplosporidium nelsoni, voir Carnegie et Cochennec-Laureau 2004), cet essai semble être une meilleure technique que la PCR pour le dépistage chez un petit nombre d'huîtres, lorsqu'une sensibilité élevée est nécessaire et que des méthodes de contrôle strict de la fixation et du filtrage sont possibles (Diggles et al. 2003). Pour des résultats d'essais ISH fiables, Diggles et al. (2003) ont recommandé que les échantillons ne soient pas fixés pendant plus de 48 heures dans de la formaline (solution de formaldéhyde à 10 % dans l'eau de mer), ni transférés dans l'éthanol à 70 % pendant de longues périodes après la fixation. L'optimisation de la PCR pour la détection de B. exitiosa fournira une technique de diagnostic sensible, mais d'autres méthodes de confirmation visuelle doivent être employées pour écarter la possibilité de faux positifs (Diggles et al. 2003). Hill et al. (2010a) ont utilisé un cocktail de trois sondes et Ramilo et al. (2014a) ont également conçu des sondes oligonucléotidiques pour la détection particulière de B. exitiosa lors d'essais d'hybridation in situ qui étaient propres à certaines espèces et dont la sensibilité était plus élevée que l'histologie traditionnelle afin de visualiser le parasite dans les tissus de l'hôte.
Récemment, une analyse de la PCR en temps réel TaqMan a été élaborée pour la détection des espèces de Bonamia. Cette analyse s'est avérée plus sensible que l'histologie et offrait une sensibilité comparable à celle des analyses de la PCR conventionnelles, mais a produit des résultats plus rapides avec un faible risque de contamination croisée de l'échantillon. Elle pourrait être optimisée pour déterminer l'intensité de l'infection (Corbeil et al. 2006a). Ramilo et al. (2013) ont décrit des essais de PCR conventionnelle (cPCR) propres à chaque espèce et des essais de diagnostic de PCR en temps réel pour B. exitiosa et B. ostreae chez O. edulis ainsi qu'une méthode de PCR multiplexe visant à détecter ces deux parasites en un seul essai. La sensibilité de ces procédures était plus élevée lorsqu'ils utilisaient des tissus de branchies et de gonades d'huîtres, plutôt que seulement de branchies. Bien que l'application d'outils statistiques (méthode de probabilité maximale) pour la comparaison de ces tests et de l'histologie ait démontré la possibilité de faux résultats positifs, toutes les procédures ont démontré des résultats négatifs lorsqu'utilisées pour l'analyse des huîtres provenant d'une zone exempte de Bonamia (Ramilo et al. 2013).
Méthodes de contrôle
À ce jour, il n'existe pas de procédure d'éradication ou de contrôle connue. Il est difficile d'assurer une gestion efficace de la maladie causée par B. exitiosa en raison de la nature variée des processus de production des huîtres et du peu de possibilités de lutte contre les maladies chez les stocks d'élevage en eau libre entourés de populations d'huîtres sauvages (Engelsma et al. 2014). Hine (1996a) a indiqué que B. exitiosa peut se transmettre directement entre les huîtres et, par conséquent, que la propagation de la maladie est liée à la densité de stockage. Tant que les méthodes de transmission et la spécificité de l'hôte de ce parasite n'auront pas fait l'objet d'une enquête approfondie, il faut éviter le déplacement des huîtres à l'extérieur des zones endémiques. Par exemple, Hill et al. (2010b) ont spéculé que l'organisme semblable à B. exitiosa rapporté par Bishop et al. (2006) de Morehead City Bay, Caroline du Nord, États-Unis était probablement une introduction à la navigation. De plus, les premiers cas de mortalité à San Antonio Este, en Argentine, se sont produits dans un lit à 1 km d'un quai maritime international, ce qui suggère que l'éclosion de B. exitiosa pourrait également provenir d'une introduction maritime (Hill et al. 2010b).
La réduction apparente de la pathogénicité et de la sélection de stocks tolérants à B. exitiosa pourrait expliquer les cycles de forte mortalité de 20 à 30 ans observés pour O. chilensis dans le détroit de Foveaux, en Nouvelle-Zélande. Cranfield et al. (2005) ont proposé que les perturbations mécaniques subies par les huîtres en raison du dragage de plus en plus intense et la modification de l'habitat benthique qui en a découlé ont été une grande source de stress qui coïncide avec l'épizootie. Ils ont indiqué que le rétablissement de la population d'huîtres est étroitement lié à la régénération de l'habitat. Ils ont aussi suggéré que la pêche pourrait être améliorée par l'atténuation des perturbations mécaniques pendant le dragage, en utilisant des dragues plus légères et des stratégies de remorquage moins dommageables, ainsi que par la poursuite de stratégies de pêche par rotation qui favorisent la régénération de l'habitat benthique à partir de zones non perturbées (Cranfield et al. 2005).
Références
Abollo, E., A. Ramilo, S.M. Casas, P. Comesaña, A. Cao, M.J. Carballal et A. Villalba. 2008. First detection of the protozoan parasite Bonamia exitiosa (Haplosporidia) infecting flat oyster Ostrea edulis grown in European waters. Aquaculture 274: 201–207.
Arzul, I., A. Langlade, B. Chollet, M. Robert, S. Ferrand, E. Omner, S. Lerond, Y. Couraleauy, J.P. Joly, C. François et C. Garcia. 2011. Can the protozoan parasite Bonamia ostreae infect larvae of flat oysters Ostrea edulis? Veterinary Parasitology 179: 69-76.
Audemard, C., R.B. Carnegie, N.A. Stokes, M.J. Bishop, C.H. Peterson et E.M. Burreson. 2008a. Effects of salinity on Bonamia sp. survival in the Asian oyster Crassostrea ariakensis. Journal of Shellfish Research 27: 535-540.
Audemard, C., R.B. Carnegie, M.J. Bishop, C.H. Peterson et E.M. Burreson. 2008b. Interacting effects of temperature and salinity on Bonamia sp. parasitism in the Asian oyster Crassostrea ariakensis. Journal of Invertebrate Pathology 98: 344-350.
Audemard, C., R.B. Carnegie, K.M. Hill, C.H. Peterson et E.M. Burreson. 2014. Bonamia exitiosa transmission among, and incidence in, Asian oyster Crassostrea ariakensis under warm euhaline conditions. Diseases of Aquatic Organisms 110: 143-150.
Berthe, F.C.J. et P.M. Hine. 2003. Bonamia exitiosa Hine et al., 2001 is proposed instead of B. exitiosus as the valid name of Bonamia sp. infecting flat oysters Ostrea chilensis in New Zealand. Diseases of Aquatic Organisms 57: 181.
Bishop, M.J., R.B. Carnegie, N.A. Stokes, C.H. Peterson et E.M. Burreson. 2006. Complications of a non-native oyster introduction: Facilitation of a local parasite. Marine Ecology Progress Series 325: 145-152.
Burreson, E.M., N.A. Stokes et R.B. Carnegie. 2004. Bonamia sp. (Haplosporidia) found in nonnative oysters Crassostrea ariakensis in Bogue Sound, North Carolina. Journal of Aquatic Animal Health 16: 1-9.
Campalans, M., P. Rojas et M. Gonzalez. 2000. Haemocytic parasitosis in the farmed oyster Tiostrea chilensis. Bulletin of the European Association of Fish Pathologists 20: 31-33.
Carnegie, R.B. et N. Cochennec-Laureau. 2004. Microcell parasites of oysters: recent insights and future trends. Aquatic Living Resources 17: 519-528.
Carnegie, R.B . et M.Y. Engelsma. 2014. Microcell parasites of molluscs: introduction to DAO Special 7. Diseases of Aquatic Organisms 110: 1-4.
Carnegie, R.B., N.A. Stokes, C. Audemard et E.M. Burreson. 2005. Bonamiasis in the crested oyster Ostrea equestris in North Carolina, USA. Journal of Shellfish Research 24: 644. (Résumé).
Carnegie, R.B., E.M. Burreson, P.M. Hine, N.A. Stokes, C. Audemard, M.J. Bishop et C.H. Peterson. 2006. Bonamia perspora n. sp. (Haplosporidia), a parasite of the oyster Ostreola equestris, is the first Bonamia species known to produce spores. Journal of Eukaryotic Microbiology 53: 232-245.
Carnegie, R.B., N.A. Stokes, C. Audemard, M.J. Bishop, A.E. Wilbur, T.D. Alphin, M.H. Posey, C.H. Peterson et E.M. Burreson. 2008. Strong seasonality of Bonamia sp. infection and induced Crassostrea ariakensis mortality in Bogue and Masonboro Sounds, North Carolina, USA. Journal of Invertebrate Pathology 98: 335-343.
Carnegie, R.B., K.M. Hill, N.A. Stokes et E.M. Burreson. 2014. The haplosporidian Bonamia exitiosa is present in Australia, but the identity of the parasite described as Bonamia (formerly Mikrocytos) roughleyi is uncertain. Journal of Invertebrate Pathology 115: 33-40.
Carrasco, N., A. Villalba, K.B. Andree, M.Y. Engelsma, B. Lacuesta, A. Ramilo, I. Gairín et M.D. Furones. 2012. Bonamia exitiosa (Haplosporidia) observed infecting the European flat oyster Ostrea edulis cultured on the Spanish Mediterranean coast. Journal of Invertebrate Pathology 110: 307-313.
Cochennec, N., F. LeRoux, F. Berthe et A. Gerard. 2000. Detection of Bonamia ostreae based on small subunit ribosomal probe. Journal of Invertebrate Pathology 76: 26-32.
Corbeil, S., I. Arzul, B. Diggles, M. Heasman, B. Chollet, F.C.J. Berthe et M.S.J. Crane. 2006a. Development of a TaqMan PCR assay for the detection of Bonamia species. Diseases of Aquatic Organisms 71: 75-80.
Corbeil, S., I. Arzul, M. Robert, F.C.J. Berthe, N. Besnard-Cochennec et M.S.J. Crane. 2006b. Molecular characterisation of an Australian isolate of Bonamia exitiosa. Diseases of Aquatic Organisms 71: 81-85.
Cranfield, H.J., A. Dunn, I.J. Doonan et K.P. Michael. 2005. Bonamia exitiosa epizootic in Ostrea chilensis from Foveaux Strait, southern New Zealand between 1986 and 1992. ICES Journal of Marine Science 62: 3-13.
Diggles, B.K., N. Cochennec-Laureau et P.M. Hine. 2003. Comparison of diagnostic techniques for Bonamia exitiosus from flat oysters Ostrea chilensis in New Zealand. Aquaculture 220: 145-156.
Dinamani, P., P.M. Hine et J.B. Jones. 1987. Occurrence and characteristics of the haemocyte parasite Bonamia sp. in the New Zealand dredge oyster Tiostrea lutaria. Diseases of Aquatic Organisms 3: 37-44.
Doonan, I.J., H.J. Cranfield et K.P. Michael. 1994. Catastrophic reduction of the oyster, Tiostrea chilensis (Bivalvia: Ostreidae), in Foveaux Strait, New Zealand, due to infestation by the protistan Bonamia sp. New Zealand Journal of Marine and Freshwater Research 28: 335-344.
Dungan, C.F., R.B. Carnegie, K.M. Hill, C.B. McCollough, S.E. Laramore, C.J. Kelly, N.A. Stokes et J. Scarpa. 2012. Diseases of oysters Crassostrea ariakensis and C. virginica reared in ambient waters from the Choptank River, Maryland and the Indian River Lagoon, Florida. Diseases of Aquatic Organisms 101: 173-183.
Engelsma, M. et M. Hine. 2009a. Infection with Bonamia exitiosa: disease detection, pathogen identification and typing. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen, M. Engelsma (eds), Epidemiology of different agents causing disease in aquatic animals: scientific review and database development, (European Food Safety Authority (EFSA), Parma, Italy), Annex B, pp. 40-41.
Engelsma, M. et M. Hine. 2009b. Infection with Bonamia exitiosa: occurrence and distribution. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen, M. Engelsma (eds), Epidemiology of different agents causing disease in aquatic animals: scientific review and database development, (European Food Safety Authority (EFSA), Parma, Italy), Annex B, 42-44.
Engelsma, M.Y., S.C. Culloty, S.A. Lynch, I. Arzul et R.B. Carnegie. 2014. Bonamia parasites: a rapidly changing perspective on a genus of important mollusc pathogens. Diseases of Aquatic Organisms 110: 5-23.
Hartikainen, H., O.S. Ashford, C. Berney, B. Okamura, S.W. Feist, C. Baker-Austin, G.D. Stentiford et D. Bass. 2014. Lineage-specific molecular probing reveals novel diversity and ecological partitioning of haplosporidians. The International Society for Microbial Ecology Journal (ISME J) 8: 177-186.
Hill, K.M., D.M. White, N.A. Stokes, R.B. Carnegie, N. Aloui-bejaoui, S.C. Webb, P.M. Hine, M.A. Kroeck, R. Ghars alli, R.K. Crockett, T.D. Lewis, K.S. Reece et E.M. Burreson. 2008. New perspectives on the dispersal and evolution of Bonamia species, haplosproidian parasites of oysters. Journal of Shellfish Research 27: 1016. (Résumé).
Hill, K.M., R.B. Carnegie, N. Aloui-Bejaoui, R.E. Gharsalli, D.M. White, N.A. Stokes et E.M. Burreson. 2010a. Observation of a Bonamia sp. infecting the oyster Ostrea stentina in Tunisia, and a consideration of its phylogenetic affinities. Journal of Invertebrate Pathology 103: 179–185.
Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen et M. Engelsma. 2010b. Epidemiology of different agents causing disease in aquatic animals: scientific review and database development (Parma, Italy, European Food Safety Authority (EFSA)), 21 p. Annex E, pp. 109-116.
Hill, K.M., N.A. Stokes, S.C. Webb, P.M. Hine, M.A. Kroeck, J.D. Moore, M.S. Morley, K.S. Reece, E.M. Burreson et R.B. Carnegie. 2014. Phylogenetics of Bonamia parasites based on small subunit and internal transcribed spacer region ribosomal DNA sequence data. Diseases of Aquatic Organisms 110: 33-54.
Hine, P.M. 1991a. The annual pattern of infection by Bonamia sp. in New Zealand flat oysters, Tiostrea chilensis. Aquaculture 93: 241-251.
Hine, P.M. 1991b. Ultrastructural observations on the annual infection pattern of Bonamia sp. in flat oysters Tiostrea chilensis. Diseases of Aquatic Organisms 11: 163-171.
Hine, P.M. 1992. Ultrastructural and ultracytochemical observations on Bonamia sp. in oysters (Tiostrea chilensis), with a consideration of organelle function. Aquaculture 107: 175-183.
Hine, P.M. 1996a. The ecology of Bonamia and decline of bivalve molluscs. New Zealand Journal of Ecology 20: 109-116.
Hine, P.M. 1996b. Southern hemisphere mollusc diseases and an overview of associated risk assessment problems. Revue Scientifique et Technique de l'Office International des Epizooties 15: 563-577.
Hine, P.M. 1997. Health status of commercially important molluscs in New Zealand. Surveillance 24: 25-28.
Hine, P.M. 2002. Severe apicomplexan infection in the oyster Ostrea chilensis: a possible predisposing factor in bonamiosis. Diseases of Aquatic Organisms 51: 49-60.
Hine, P.M. et J.B. Jones. 1994. Bonamia and other aquatic parasites of importance to New Zealand. New Zealand Journal of Zoology 21: 49-56.
Hine, P.M. et B. Wesney. 1992. Interrelationships of cytoplasmic structures of Bonamia sp. (Haplosporidia) infecting oysters Tiostrea chilensis: an interpretation. Diseases of Aquatic Organisms 14: 59-68.
Hine, P.M. et B. Wesney. 1994a. The functional cytology of Bonamia sp. (Haplosporidia) infecting oysters Tiostrea chilensis: an ultracytochemical study. Diseases of Aquatic Organisms 20: 207-217.
Hine, P.M. et B. Wesney. 1994b. Interaction of phagocytosed Bonamia sp. (Haplosporidia) with haemocytes of oysters Tiostrea chilensis. Diseases of Aquatic Organisms 20: 219-229.
Hine, P.M., N. Cochennec-Laureau et F.C.J. Berthe. 2001. Bonamia exitiosus n. sp. (Haplosporidia) infecting flat oysters Ostrea chilensis in New Zealand. Diseases of Aquatic Organisms 47: 63-72.
Hine, P.M., B.K. Diggles, M.J.D. Parsons, A. Pringle et B. Bull. 2002. The effects of stressors on the dynamics of Bonamia exitiosus Hine, Cochennec-Laureau & Berthe, infections in flat oysters Ostrea chilensis (Philippi). Journal of Fish Diseases 25: 545-554.
Hine, P.M., R.B. Carnegie, M.A. Kroeck, A. Villalba, M.Y. Engelsma et B. EM. 2014. Ultrastructural comparison of Bonamia spp. (Haplosporidia) infecting ostreid oysters. Diseases of Aquatic Organisms 110: 55-63.
Kern, F.G. 1993. Shellfish health inspections of Chilean and Australian oysters. Journal of Shellfish Research 12: 366. (Résumé).
Kroeck, M.A. et J. Montes. 2005. Occurrence of the haemocyte parasite Bonamia sp. in flat oysters Ostrea puelchana farmed in San Antonio Bay (Argentina). Diseases of Aquatic Organisms 63: 231-235.
Laing, I., P. Dunn, E.J. Peeler, S.W. Feist et M. Longshaw. 2014. Epidemiology of Bonamia in the UK, 1982 to 2012. Diseases of Aquatic Organisms 110: 101-111.
Lohrmann, K.B., P.M. Hine et M. Campalans. 2009. Ultrastructure of Bonamia sp. in Ostrea chilensis in Chile. Diseases of Aquatic Organisms 85: 199-208.
Longshaw, M., D.M. Stone, G. Wood, M.J. Green et P. White. 2013. Detection of Bonamia exitiosa (Haplosporidia) in European flat oysters Ostrea edulis cultivated in mainland Britain. Diseases of Aquatic Organisms 106: 173-179.
Lynch, S.A., E. Abollo, A. Ramilo, A. Cao, S.C. Culloty et A. Villalba. 2010. Observations raise the question if the Pacific oyster, Crassostrea gigas, can act as either a carrier or a reservoir for Bonamia ostreae or Bonamia exitiosa. Parasitology 137: 1515-1526.
Martín-Gómez, L., A. Villalba et E. Abollo. 2012. Identification and expression of immune genes in the flat oyster Ostrea edulis in response to bonamiosis. Gene 492: 81-93.
Mialhe, E., V. Boulo, R. Elston, B. Hill, M. Hine, J. Montes, P. van Banning et H. Grizel. 1988. Serological analysis of Bonamia in Ostrea edulis and Tiostrea lutaria using polyclonal and monoclonal antibodies. Aquatic Living Resources 1: 67-69.
Moore, J.D. 2006. 5.2.7 Bonamiasis of Oysters, In: Executive Committee (eds.) Fish Health Section Blue Book, 2014 Edition, Suggested Procedures for the Detection and Identification of Certain Finfish and Shellfish Pathogens, Section 1 Diagnostic Procedures for Finfish and Shellfish Pathogens, Chapter 5 Diseases of Molluscan Shellfish.
Narcisi, V., I. Arzul, D. Cargini, F. Mosca, A. Calzetta, D. Traversa, M. Robert, J.P. Joly, B. Chollet, T. Renault et P.G. Tiscar. 2010. Detection of Bonamia ostreae and B. exitiosa (Haplosporidia) in Ostrea edulis from the Adriatic Sea (Italy). Diseases of Aquatic Organisms 89: 79–85.
Oehrens Kissner, E.M., M.S. Doldan, P.C. Zaidman, E.M. Morsan et M.A. Kroeck. 2014. Bonamiosis status in natural Ostrea puelchana beds in San Matías Gulf (Patagonia, Argentina), 14 years after an epizootic. Diseases of Aquatic Organisms 110: 135-142.
OIE Reports. 2012 & 2013. Bonamia exitiosa detected in Crassostrea virginica from North Carolina (2012) and Massachusetts (2013) with no associated disease.
Ramilo, A., J.I. Navas, A. Villalba et E. Abollo. 2013. Species-specific diagnostic assays for Bonamia ostreae and B. exitiosa in European flat oyster Ostrea edulis: conventional, real-time and multiplex PCR. Diseases of Aquatic Organisms 104: 149-161.
Ramilo, A., A. Villalba et E. Abollo. 2014a. Species-specific oligonucleotide probe for detection of Bonamia exitiosa (Haplosporidia) using in situ hybridisation assay. Diseases of Aquatic Organisms 110: 81-91.
Ramilo, A., M. González, M.J. Carballal, S. Darriba, E. Abollo et A. Villalba. 2014b. Oyster parasites Bonamia ostreae and B. exitiosa co-occur in Galicia (NW Spain): spatial distribution and infection dynamics. Diseases of Aquatic Organisms 110: 123-133.
Unknown. 1987. Bonamia strikes deeper into Foveaux Strait oysters. Catch April 1987: 3-5. (Summary of: Report on investigations into the disease outbreak in Foveaux Strait oysters, Tiostrea lutaria, 1986-87 by P. Dinamani, R.W. Hickman, P.M. Home, J.B. Jones, and H.J. Cranfield. April 1987, 30 p and 2 plates. Available from the Publications Clerk, Fisheries Research Centre, MAFFish, P.O. Box 297, Wellington, New Zealand).
White, D., N. Stokes, K. Hill, M. Kroeck, P.M. Hine, N. Aloui-bejaoui, R. Carnegie, K. Reece et E. Burreson. 2008. A molecular phylogeny of the genus Bonamia based on internal transcribed spacer region sequences. Journal of Shellfish Research 27: 1063. (Résumé).
Citation
Bower, S.M. (2015) : Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement: Bonamia exitiosa (bonamiosede diverses huîtres)
Date de la dernière révision : Février 2015
Faire parvenir les commentaires à Susan Bower
- Date de modification :