Organisme de genre Hematodinium des crevettes pandalides
Sur cette page
Catégorie
Catégorie 2 (au Canada et d'intérêt régional)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Parasite de la crevette tachetée, considéré initialement comme un organisme semblable à Hematodiniumpour les crevettes. Remarque : Les espèces d'Hematodiniumont été décrites à partir de divers crustacés marins, notamment des crabes de l'océan Atlantique, des Chionecetes spp.des océans Pacifique Nord et Atlantique Nord, des crabes à proximité de l'Australie, et des homards.
Nom scientifique ou affiliation taxonomique
Parasite eucaryote, dont l'affiliation demeure incertaine, présentant des similarités superficielles avec des dinoflagellés parasitaires (d'importants plasmodes et de nombreux trophonts), mais avec un mécanisme de division nucléaire différent et l'absence d'organites caractéristiques des dinoflagellés parasitaires. Par ailleurs, les caractéristiques antigéniques se sont révélées incohérentes avec celles des autres dinoflagellés parasitaires (Dungan et al. 2000; Bushek et al. 2002). 2002). l'analyse moléculaire suggère une association avec les Haplosporidia (Reece et al. 2000, 2004). Cependant, les caractéristiques morphologiques propres aux Haplosporidia n'ont pas été observées chez le parasite de la crevette tachetée.
Répartition géographique
Détroit de Géorgie, à proximité de Powell River en Colombie-Britannique, au Canada (Bower et Meyer 2002), ainsi que Yakutat et le golfe du Prince William en Alaska, aux États-Unis (Meyers et al. 1994).
Espèces hôtes
Pandalus platyceros et Pandalus borealis.
Impact sur les hôtes
Le premier cas de la maladie a été observé en Colombie-Britannique par des pêcheurs commerciaux de crevettes qui ont constaté des taux de prévalence de l'infection clinique jusqu'à 10 % en septembre 1991. Dans une zone où les infections cliniques étaient de l'ordre de 0,6 %, des analyses histologiques réalisées en 1992 ont fait état d'un taux d'infection sous-clinique de 19 % sur 100 crevettes tachetées. Au cours de la même saison et dans la même région en 1993, les infections cliniques se chiffraient à 2,2 %, mais le taux d'infection sous-clinique était de 14,1 % pour une prévalence calculée de 16,3 % (prévalence moindre que celle détectée en 1992). Au cours des années suivantes, la prévalence de l'infection n'a cessé de diminuer jusqu'à atteindre 2,5 % en 1995, et le taux est resté faible jusqu'aux derniers échantillons prélevés en 1998. Chez la plupart des P. platycerosprésentant des infections sous-cliniques, l'infection durait suffisamment longtemps pour nuire au développement des gonades ainsi qu'à la morphologie des caractéristiques sexuelles secondaires (anomalies de l'appendice masculin et de l'appendice interne sur l'endopodite du deuxième pléopode). Les crevettes infectées sur le terrain n'ont pas survécu en captivité. En Alaska, des rapports non confirmés ont fait état d'une prévalence de l'ordre de 50 %. Cependant, les prévalences documentées des infections cliniques étaient généralement inférieures à 1 % (Meyers et al. 1994).
Techniques de diagnostic
Observations générales
Les crevettes présentant une infection clinique sont léthargiques et d'un orange rosé inhabituel lorsqu'elles sont en vie, et un liquide laiteux caractéristique se déverse du céphalothorax lorsque la crevette est décapitée.

Figure 1. Pandalus platyceros ayant une coloration orange inhabituelle et une hémolymphe « laiteuse » évidente au travers de la fine cuticule de la surface ventrale de l'abdomen (voir la crevette tachetée à côté de la barre d'échelle), causées par le parasite de la crevette tachetée, par rapport à une crevette tachetée normale (non infectée, spécimen du bas).
Préparations humides
l'hémolymphe est remplie de protozoaires de forme ronde ou discoïde (rappelant les globules rouges des mammifères mais plus grands) d'environ 7 µm de diamètre chez les crevettes présentant une infection clinique.
Histologie
De nombreux protozoaires remplissant toutes les lacunes sanguines. Chez les crevettes présentant des infections sous-cliniques, d'importants plasmodes multinucléés ont été observés dans les tissus conjonctifs adjacents à la glande digestive.
Les figures 2 à 7 illustrent les stades de développement du parasite de la crevette tachetée dans des coupes histologiques de Pandalus platyceros colorées à l'hématoxyline et à l'éosine.

Figure 2. Plasmodes immatures avec des noyaux basophiles mal définis. Division nucléaire indistincte avec des noyaux allongés pour former des taches basophiles avant la fission (flèche).

Figure 3. Plasmode mature, qui remplit les sinus tissulaires et contient des noyaux abondants; présence d'un anneau de chromatine périphérique, d'un réseau de chromatine interne et jusqu'à trois (deux en règle générale) petits nucléoles (nu). De denses inclusions basophiles (bi), dont l'importance demeure inconnue, ont été observées chez certains spécimens de crevettes tachetées.

Figure 4. Plasmode mature en cours de fragmentation en trophonts de différentes formes.

Figure 5. Trophonts sphériquesavec des noyaux centraux ronds, morphologiquement semblables aux noyaux des plasmodes matures, mais légèrement plus petits en diamètre. On observe un nombre impressionnant de parasites de la crevette tachetée en dehors et au sein du système vasculaire (w indique un noyau de la paroi des vaisseaux sanguins). Des hémocytes (h représente le noyau d'un hémocyte dans les sinus vasculaires) sont rarement observés.

Figure 6. Trophonts en cours de fission binaire présentant une métaphase (m), une télophase tardive (t) et une cellule dans laquelle le noyau s'est récemment divisé (d).

Figure 7. Trophonts discoïdes avec des noyaux centraux ronds semblables à ceux des trophonts sphériques. Des hémocytes (h indique le noyau d'un hémocyte dans les sinus tissulaires) ont rarement été observés, et les parasites de la crevette tachetée sont apparus en dehors et au sein du système vasculaire (w désigne la paroi du vaisseau sanguin).
Le cycle de développement a été proposé à partir de l'examen histologique de 270 crevettes tachetées infectées. Les plasmodes immatures (figure 2) se développent en plasmodes plus grands qui remplissent la plupart des sinus tissulaires, notamment les espaces entre les tubules de la glande digestive. À un stade ultérieur, certains noyaux prennent les caractéristiques des plasmodes matures (figure 3) et ne se divisent plus. Toutefois, selon le stade de développement, les plasmodes (ou les régions d'un plasmode) sur certaines zones de la crevette tachetée (p. ex., au centre de la glande digestive ou à la base des hanches des péréiopodes) restent immatures, avec des noyaux se divisant pendant un certain temps. Sur d'autres zones de la crevette tachetée (p. ex., en périphérie de la glande digestive, du cœur et des branchies), les grands plasmodes peuvent commencer leur segmentation en trophonts (figure 4). Excepté la morphologie anormale de l'endopodite du deuxième pléopode, les crevettes tachetées au stade plasmodial de l'infection ne présentent pas de signes visibles de la maladie, sauf la présence de plasmodes de grande taille et en cours de segmentation en trophonts. Toutes les crevettes tachetées présentant des signes visibles de la maladie (coloration orange inhabituelle et hémolymphe blanche) étaient massivement infectées, avec une multitude de trophonts qui conféraient un aspect laiteux à l'hémolymphe.
Les trophonts produits par la segmentation de grands plasmodes matures sont apparus initialement sous diverses formes (figure 4), mais ultimement sous forme ronde. Chez 10 (4 %) des crevettes tachetées infectées, tous les parasites de la crevette tachetée observés présentaient des trophonts sphériques (figure 5), et les plasmodes n'étaient plus présents. Seize (6 %) des crevettes tachetées infectées présentaient des trophonts sphériques en cours de fission binaire (figure 6), et chez trois de ces crevettes, plus de 30 % des parasites de la crevette tachetée avaient subi une fission binaire. Quarante-deux (16 %) des crevettes tachetées infectées affichaient des pourcentages variés de trophonts discoïdes (figure 7) et sphériques (figure 5). En raison de l'absence de trophonts discoïdes chez les crevettes présentant des plasmodes, ces cellules ont été considérées comme la forme la plus « mature » observée du parasite de la crevette tachetée.
Microscopie électronique
Les caractéristiques ultrastructurelles censées être propres au parasite de la crevette tachetée ou représentatives des espèces apparentées comprennent le processus de fission binaire au stade trophont (figure 6), les organites associés au noyau et les extensions de surface chez certains spécimens, comme l'illustrent les figures ci-dessous.
Figures 8 à 14. Micrographes électroniques du parasite de la crevette tachetée, fixé comme l'indique la légende de chaque figure et coloré à l'acétate d'uranyle et au citrate de plomb.

Figure 8. Trophont sphérique en métaphase tardive ou en anaphase précoce, avec une membrane nucléaire intacte entourant les chromosomes condensés (C) qui sont reliés par des microtubules (T) aux corps polaires du fuseau (S) émergeant à travers l'enveloppe nucléaire. Tissu fixé au tampon phosphate de Millonig à 4 % de glutaraldéhyde.
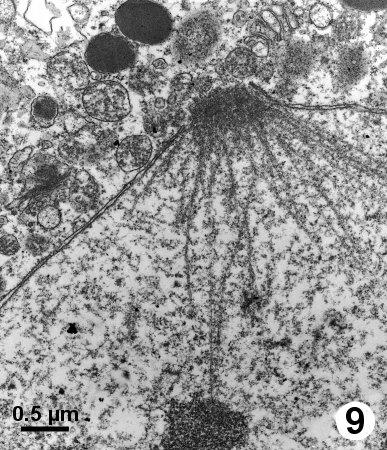
Figure 9. Grossissement de la figure 8 illustrant les microtubules qui se rattachent au corps polaire du fuseau à un trou de la membrane nucléaire.

Figure 10. Groupe d'organites associés au noyau (entre les flèches) à la périphérie externe du noyau. Tissu fixé au tampon phosphate de Millonig à 4 % de glutaraldéhyde.

Figure 11.Organites associés au noyau, regroupés dans une dépression du noyau (N). lorsqu'ils sont préservés dans de l'eau de mer à 2,5 % de glutaraldéhyde, ils semblent contenir quelques tubules dans une fine matrice osmophile.

Figure 12.Un échantillon répété à partir de la même crevette infectée illustrée à la figure 11, préservé dans un tampon cacodylate à 2,5 % de glutaraldéhyde, a révélé une matrice grossière et semble contenir de multiples tubules et membranes. Le noyau (N) de ce parasite présente plusieurs pores de membranes (P) et une extension inhabituelle (E) de la membrane nucléaire. La morphologie des organites associés au noyau est comparable à celle d'une mitochondrie (M) dans le cytoplasme du parasite de la crevette tachetée.

Figure 13. Présence de nombreux tubules de membranes ectoplasmiques entre la membrane externe du parasite (m désigne une mitochondrie du parasite de la crevette tachetée) et le tissu hôte. Tissu fixé au glutaraldéhyde 2,5 % dans de l'eau de mer filtrée.

Figure 14. Tubules compressés en de multiples feuilles de membrane (flèches) qui s'étendent entre les nombreuses mitochondries d'un myocyte lysé dans le cœur d'une crevette tachetée. Tissu fixé au glutaraldéhyde 2,5 % dans de l'eau de mer filtrée.
Méthodes de contrôle
On ne connaît aucune méthode de traitement ou de contrôle. Les tentatives de transmission en laboratoire du parasite entre les crevettes tachetées par inoculation et cohabitation se sont révélées infructueuses, suggérant ainsi que d'autres hôtes pouvaient être concernés ou que d'autres stades de développement survenaient dans le cycle de vie. Autrement, les crevettes tachetées peuvent être considérées comme un hôte anormal dans le cycle de vie de ce parasite. La désintégration visible du noyau en trophonts de parasite chez certaines crevettes tachetées présentant des infections foudroyantes et la perte rapide des parasites chez les crevettes mortes utilisées comme source d'infection lors des expériences de cohabitation peuvent indiquer que le parasite n'est pas bien adapté à la crevette tachetée.
Références
Bower, S.M. et G.R. Meyer. 1996. A Hematodinium-like dinoflagellate parasite of prawns, Pandalus platyceros, in British Columbia. Bulletin of the Canadian Society of Zoologists 27: 43-44.
Bower, S.M. et G.R. Meyer. 2000. Description of an unusual parasite in prawns, Pandalus platyceros, in British Columbia, Canada. Journal of Shellfish Research 19: 642. (Abstract).
Bower, S.M. et G.R. Meyer. 2002. Morphology and ultrastructure of a protistan pathogen in the haemolymph of shrimp (Pandalus spp.) in the northeastern Pacific Ocean. Canadian Journal of Zoology 80: 1055-1068.
Bower, S.M., G.R. Meyer et J.A. Boutillier. 1993. Diseases of spot prawns Pandalus platyceros caused by an intracellular bacterium and a Hematodinium-like protozoa. Journal of Shellfish Research 12: 135.
Bushek, D., C.F. Dungan et A.J. Lewitus. 2002. Serological affinities of the oyster pathogen Perkinsus marinus (Apicomplexa) with some dinoflagellates (Dinophyceae). The Journal of Eukaryotic Microbiology 49: 11-16.
Dungan, C.F., R. Hamilton, D. Bushek, J. Cardinal et A. Lewitus. 2000. Serological affinities between Perkinsus marinus and some parasitic dinoflagellates. Journal of Shellfish Research 19: 643-644. (Abstract).
Meyers, T.R., D.V. Lightner et R.M. Redman. 1994. A dinoflagellate-like parasite in Alaskan spot shrimp Pandalus platyceros and pink shrimp P. borealis. Diseases of Aquatic Organisms 18: 71-76.
Reese, K.S., E.M. Burreson, S.M. Bower et C.F. Dungan. 2000. Molecular analyses of a parasite in prawns (Pandalus platyceros) from British Columbia, Canada. Journal of Shellfish Research 19: 647. (Abstract).
Reece, K.S., M.E. Siddall, N.A. Stokes et E.M. Burreson. 2004. Molecular phylogeny of the haplosporidia based on two independent gene sequences. The Journal of Parasitology 90: 1111-1122.
Citation
Bower, S.M. (2002): Précis des maladies infectieuses et des parasites des mollusques et des crustacés exploités commercialement: Organisme de genre Hematodinium des crevettes pandalides.
Date de la dernière révision : Novembre 2002
Faire parvenir les commentaires à Susan Bower
- Date de modification :