Marteiliose (maladie des Abers) de l'huître
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Maladie des Abers, Maladie des glandes digestives, Marteiliose.
Nom scientifique ou classification taxonomique
Le parasite Marteilia refringens que Grizel et al. (1974a) ont décrit à partir d'Ostrea edulis et de parasites s'apparentant à Marteilia est classé dans le phylum Cercozoa et appartient à l'ordre Paramyxida (Cavalier-Smith et Chao 2003, Feist et al. 2009). Cependant, ces parasites ont été reliés à plusieurs taxons plus importants par le passé (Perkins 1976, Ormières et Grizel 1979, Lauckner 1983, Berthe et al. 2004, Renault 2008). Bien que l'identité taxonomique de M. refringens ait été clairement établie, un parasite morphologiquement similaire chez les moules (Mytilus galloprovincialis) de la côte Adriatique de l'Italie a été nommé Marteilia maurini, (Comps et al. 1981 [1982] 1982). Par la suite, M. maurini a été signalé chez les M. galloprovincialis et les Mytilus edulis ainsi que chez les huîtres (Ostrea edulis) d'autres emplacements du bassin méditerranéens et sur les côtes atlantiques de l'Europe (pour plus de détails, voir la page web concernant Marteilia spp. chez les moules). À la suite de l'utilisation d'outils moléculaires, des différences génétiques ont été signalées entre les isolats de Marteilia provenant d'huîtres et de moules. Cependant, les signatures moléculaires de chacun ont été détectées chez des huîtres et des moules (Le Roux et al. 2001). López-Flores et al. (2004) ont suggéré que la forme la plus souvent observée chez les huîtres et l'autre forme la plus courante chez les moules étaient des souches distinctes d'une espèce, M. refringens. D'autres ont soutenu l'hypothèse selon laquelle les types M et O (pour les huîtres et les moules, respectivement) représentent la même espèce unique, M. refringens (Novoa et al. 2005, Balseiro et al. 2007, Arzul et al. 2014, Carrasco et al. 2015, 2017). Le laboratoire de référence qui étudie les infections par le parasite Marteilia refringens de l'Organisation mondiale de la santé animale (Office international des épizooties, OIE) reconnaît deux types de Marteilia refringens, à savoir les types O et M tels que définis par Le Roux et al. (2001) (OIE 2012, CIEM 2012). Alfjorden et al. (2017) ont fait valoir qu'ils devraient, de manière prudente, être considérés comme une seule espèce, M. refringens, pour une gestion plus efficace de la santé. Cependant, d'après une analyse moléculaire, Kerr et al. (2018) ont fourni une base pour réintégrer deux espèces distinctes et ont nommé l'espèce, qu'ils ont détectée principalement chez M. edulis et chez quelques O. edulis de l'Europe du Nord, Marteilia parafringens. Bien qu'aucune différence morphologique n'ait été pas rapportée entre M. refringens et M. pararefringens, ils ontdécrit un moyen de distinguer ces taxons sur la base d'un essai de diagnostic moléculaire précis (Kerr et al. 2018).
D'autres espèces de Marteilia se trouvent chez diverses espèces d'huîtres. Lors de leur révision de l'ordre des Paramyxida que Feist et al. (2009) ont proposé que le genre Marteilioides (Comps, Park et Desportes 1986) soit supprimé et que l'espèce type du genre, M. chungmuensis, (Comps, Park et Desportes 1986) des huîtres en Corée et au Japon, soit transférée à Marteilia. Cette proposition a été appuyée par Itoh et al. (2014), Carrasco et al. (2015) et Alfjorden et al. (2017), mais elle a été réfutée par Ward et al. (2016). En raison des différences de morphologie et de localisation de l'infection chez les huîtres, le parasite M. chungmuensis continuera à être décrit sur une autre page web et ne sera pas mentionné dans le texte suivant. De même, le parasite Marteilia sydneyi, provenant d'huîtres présentes principalement en Australie, est décrit sur une page Web distincte. Une autre espèce, Marteilia lengehi a été décrite à partir de Saccostrea (= Crassostrea) cucullata du golfe Persique et peut-être de l'Australie (Comps 1976, Hine et Thorne 2000, Carrasco et al. 2015), mais on en sait peu sur ce parasite. Une autre espèce méconnue qui s'apparente à Marteilia a été signalée dans l'épithélium de l'appareil digestif de Saccostrea forskali dans la province de Chonburi, sur la côte est de la Thaïlande avec une prévalence d'infection faible (moins de 7 %) et aucuns liens apparents avec des mortalités (Taveekijakarn et al. 2002). Cependant, une infiltration hémocytaire a été observée autour de la zone infectée et une prolifération extrasporogonique a été constatée dans les branchies de certaines des huîtres infectées. Cette espèce de Marteilia a été caractérisée comme ayant des sporangiosorus contenant chacun habituellement deux à six sporontes, ou peut-être plus, et chaque sporonte comprenait deux spores (Taveekijakarn et al. 2002, 2008).
Répartition géographique
Le parasite Marteilia refringens a été signalé chez des Ostrea edulis provenant de la côte atlantique de l'Europe, du sud du Royaume-Uni à l'Espagne et présentes dans la mer Méditerranée (Alfjorden et al. 2017). Cependant, un programme d'échantillonnage de deux ans au début des années 1990 a révélé que cette maladie ne touchait pas les O. edulis en Grande-Bretagne et bien que M. refringens ait été introduit par inadvertance dans les eaux côtières des Pays-Bas, après l'importation d'huîtres infectées de France en 1974 (van Banning 1979a), elle n'a pas été observée aux Pays-Bas après 1978 (Engelsma et Hine 2009b; Carrasco et al. 2017). De même, Kerr et al. (2018) n'ont pas détecté de M. refringens de type O dans les échantillons d'Europe du Nord, notamment au Royaume-Uni, en Norvège et en Suède, au moyen d'essais moléculaires et histologiques. Seuls des Marteilia de type M ont été détectés chez quelques O. edulis qui cohabitaient avec des moules infectées par le parasite Marteilia de type M qu'ils ont nommé M. pararefringens (Kerr et al. 2018).
Dans la mer Méditerranée, Marteilia refringens a été signalé chez les O. edulis du Maroc par l'OIE en août 2006, chez les O. edulis et les M. galloprovincialis de l'étang de Diane, en Corse (Arzul et al. 2014) et chez les Ostrea stentina de Tunisie (Elgharsalli et al. 2013). Marteilia sp. touchait les O. edulis, M. galloprovincialis et les Modiolus barbatus dans le golfe Thermaïque (Thessalonique), dans le nord de la Grèce (Virvilis et al. 2003, Virvilis et Angelidis 2006).
Marteilia refringens a également été détecté, à l'aide d'essais moléculaires (PCR par amorces incluses) chez les Crassostrea gigas et les Crassostrea corteziensis du golfe de la Californie, au Mexique (Grijalva-Chon et al. 2015). Marteilia pararefringens a été détecté chez une des 150 huîtres O. edulis de l'estuaire de Tamar, au Royaume-Uni et chez 10 des 30 O. edulis de Bemlo, en Norvège où les M. edulis était fortement infectées (Kerr et al. 2018).Le parasite Marteilia lengehi a été décrit à partir de l'espèce Saccostrea (= Crassostrea) cucullata dans le golfe Persique (Comps 1976), et un autre parasite Marteilia sp. similaire a été observé chez la même espèce d'huître dans la partie nord-ouest de l'Australie (Hine et Thorne 2000, Meyers 2006).
Espèces hôtes
Décrits initialement à partir d'huîtres Ostrea edulis (Grizel et al. 1974a), Marteilia refringens et des parasites apparentés ont été observés chez d'autres espèces d'huîtres, de moules, de myes, de coques, de pétoncles (voir le tableau 1 dans Carrasco et al. 2015) et chez d'autres invertébrés n'appartenant pas au groupe des bivalves (comme décrit ci-dessous). Chez les huîtres, le parasite M. refringens a été trouvé chez des Ostrea chilensis (= Tiostrea chilensis = Ostrea lutaria), chez des Ostrea angasi et chez des Ostrea puelchana lors d'essais expérimentaux sur le terrain menés en France (Grizel et al. 1982, Bougrier et al. 1986, et Pascual et al., 1991, respectivement), chez des Ostrea denselamellosa (OIE 2012) et chez des Ostrea stentina (Elgharsalli et al. 2013). De plus, M. refringens a été détecté chez une seule huître Crassostrea virginica juvénile d'un (1) an introduite et élevée en France (Renault et al. 1995) et chez des Crassostrea gigas adultes (Cahour 1979, Montes et al. 1998). Il y a la spéculation que l'infection chez des C. gigas pourrait être un autre parasite de type Marteilia ou seulement une infection transitoire, car les C. gigas semblent résister à l'infection (Berthe et al. 2004), et le parasite M. refringens se développe rarement jusqu'aux stades matures chez les C. gigas (Engelsma et Hine 2009a; Carrasco et al. 2015). Grijalva-Chon et al. (2015) ont détecté le parasite M. refringens chez des huîtres C. gigas et des Crassostrea corteziensis du golfe de la Californie, au Mexique. Cependant, chez les deux espèces d'huîtres, la prévalence de l'infection était faible, il n'y avait pas de mortalité associée et le seul essai utilisé était la PCR par amorces incluses. Comme l'ont indiqué les auteurs, les études histologiques, par hybridation in situ et par microscopie électronique à transmission sont nécessaires pour déterminer si M. refringens s'est établi dans l'huître du golfe de Californie (Grijalva-Chon et al. 2015).
Chez les moules, les M. refringens ont été observés chez des Mytilus edulis et Mytilus galloprovincialis (Tige et Rabouin 1976, Comps et Joly 1980, Villalba et al. 1993, Le Roux et al. 2001, Balseiro et al. 2007, ICES 2012). Marteilia refringens a également été détecté chez une espèce de moule envahissante non indigène, Xenostrobus securis,t dans la Ria de Vigo, en Espagne (Pascual et al. 2010). En plus des huîtres et des moules, le parasite M. refringens a été signalé chez diverses espèces de myes et de coques qui sont décrites sur une autre page web. M. refringens dans d'autres organismes marins que peuvent servir d'hôtes intermédiaires ou alternatifs (voir ci-dessous).
Impact sur l'hôte
Depuis 1968, le parasite M. refringens a causé des mortalités récurrentes graves ayant des effets négatifs considérables sur l'industrie européenne des O. edulis (Comps 1970, Herrbach 1971, Alderman 1979, Grizel 1983, Englesma et Hine 2009b). Cependant, d'importantes mortalités liées à des pathologies similaires ont été déclarées chez les O. edulis en Europe avant les années 1960 (Mackin 1959). Grizel et al. (1974a) ont déclaré un taux de mortalité de 50 à 90 % pendant l'été et l'automne lié à la sporulation du parasite, qui se produit dans les cellules épithéliales des tubules digestifs. Plus récemment, le parasite M. refringens a été associé à la baisse considérable touchant la production des O. edulis du golfe de Thermaïque (Thessalonique), au nord de la Grèce, de 1994 à 1998 (Virvilis et al. 2003). L'infection entraîne une diminution de l'indice de condition et une perte de glycogène (émaciation), une décoloration de la demande digestive, un arrêt de la croissance, une nécrose des tissus et des mortalités. La glande digestive, dans laquelle on peut trouver le parasite M. refringens et d'autres espèces de Marteilia, est l'endroit où se produit la digestion intracellulaire des aliments et l'un des premiers endroits de stockage des réserves métaboliques (Berthe et al. 2004). Marteilia refringens peut aussi interférer avec le stockage de glycogène chez les O. edulis (Robert et al. 1991). Des infections graves peuvent entraîner une diminution de l'indice de condition en raison de la baisse de l'acquisition d'énergie, et le parasite peut interférer avec l'alimentation et l'absorption de l'hôte tout simplement par sa présence physique (OIE 2012). Dans la plupart des cas, l'infection par M. refringens est associée à une grave infiltration hémocytaire entourant le parasite dans les tubules digestifs primaires et secondaires de l'espèce O. edulis (Carrasco et al. 2015). Cependant, on peut observer la présence de Marteilia chez certaines huîtres sans que la maladie ne se développe (Grizel et al. 1974a; van Banning 1979b; Carrasco et al. 2015). On ne connaît pas assez les facteurs qui déclenchent une réaction hôte-pathogène, mais ces derniers peuvent être liés aux facteurs de stress environnemental, aux différences de résistance à la maladie au sein des stocks et / ou à la virulence des pathogènes (Carrasco et al. 2015).
Le développement d'infections par M. refringens est directement lié à la température élevée de l'eau et à la faible salinité (CIEM 2012). Des études ont montré qu'une température de 17 °C semble être un déclencheur de la multiplication et de la transmission du parasite suivies de l'épidémie de la maladie (Audemard et al. 2001, Carrasco et al. 2015). Tige et al. (1979) ont signalé que les O. edulis en Bretagne (France) ont été infectées par M. refringens à partir du début du mois de juillet jusqu'à la fin du mois d'août. Grizel et Tigé (1979) ont déterminé que la période d'infection variait entre mai et août et que pendant l'hiver, le parasite semblait être éliminé des tissus des O. edulis. Cependant, des études récentes ont révélé que, du moins dans les eaux méditerranéennes où les températures atteignent des valeurs élevées, M. refringens avait deux périodes ou cycles, pour une multiplication et une transmission optimale pendant l'année : le printemps / l'été et l'automne (Boyer et al. 2013, Carrasco et al. 2015). La prévalence la plus élevée semble se situer dans les zones d'élevage fermées et M. refringens pourrait avoir été transmis dans toute l'Europe par des transferts d'huîtres et de moules par les échanges commerciaux de stocks entre producteurs dans différentes régions (Guo et Ford 2016). Comme cet agent pathogène n'est pas transmis directement chez les huîtres et les moules, d'autres hôtes potentiels inconnus auraient déjà été présents dans les nouveaux emplacements ou auraient été transférés avec les bivalves (Guo et Ford 2016).
Bien que Comps et Joly (1980) aient réussi à infecter des moules (Mytilus galloprovincialis), mais pas des huîtres (O. edulis), avec le parasite M. refringens extrait d'huîtres (O. edulis), les résultats d'autres études expérimentales n'ont pas permis d'obtenir de preuves pour appuyer la transmission horizontale directe de M. refringens (Berthe et al. 1998). Audemard et al. (2001) ont indiqué que les hôtes intermédiaires ou alternatifs (inconnus) ou autonomes (également inconnus) étaient essentiels durant le cycle de vie de ce parasite, hypothèse soutenue par Berthe et al. (2004). Audemard et al. (2002, 2004) ont utilisé des techniques moléculaires pour démontrer que M. refringens peut apparaître dans des tissus ovariens de copépode calanoïde Paracartia (=Acartia) grani, et ont indiqué que ce copépode peut être impliqué dans le cycle de vie de M. refringens, au moins dans des bassins d'huîtres (« claires ») en eau peu profonde en France. Arzul et al. (2014) ont aussi détecté le parasite M. refringens dans le tissu ovarien de Paracartia latisetosa de l'étang de Diane, en Corse. Le parasite Marteilia refringens observé chez les huîtres (O. edulis) et les moules (M. galloprovincialis) a pu infecter l'espèce P. grani. Cependant, les essais visant à transmettre M. refringens de l'espèce P. grani aux huîtres (O. edulis) et aux moules (Mytilus edulis) se sont soldées par un échec (Audemard et al. 2002, Carrasco et al. 2008a). De plus, Carrasco et al. (2008a) ont révélé que les modes d'infection de M. refringens / maurini chez les P. grani étaient différents de ceux des copépodes infectés par des M. galloprovincialis ou O. edulis, et seules les premières étapes de l'infection ont été observées dans le tractus intestinal des P. grani infectées par des moules, par rapport à une plus haute prévalence et intensité des infections dans le tractus intestinal et la gonade des P. grani infectées par des huîtres. Bien que la participation des P. grani au cycle de vie de M. refringens (au moins chez les huîtres) semble correspondre aux caractéristiques écologiques de ce copépode et à l'épidémiologie de la maladie, il reste encore à déterminer si les P. grani peuvent être des hôtes alternatifs sans participer au cycle de vie (Berthe et al. 2004). Boyer et al. (2013) ont fourni des preuves supplémentaires indiquant que l'espèce P. grani pourrait être impliquée dans le cycle vital de M. refringens. Plus précisément, le parasite M. refringens a été détecté aux stades copépodites de P. grani entre juin et novembre au moyen d'essais moléculaires (PCR et analyse par hybridation) lorsque la maladie était active chez les M. galloprovincialis qui lui étaient associées. Au troisième stade copépodite de P. grani, M. refringens a été observé dans le tube digestif et les gonades, ce qui laisse entendre que le parasite pourrait infecter un copépode par ingestion et être libéré par les gonades. En effet, l'ADN de M. refringens a été détecté dans des œufs de P. grani obtenus à partir de femelles positives aux essais de réaction en chaîne de la polymérase (PCR), ce qui semble indiquer que les œufs pourraient contribuer à la propagation du parasite dans l'eau et permettre à M. refringens d'hiverner. De plus, l'efficacité de rétention (nombre de copépodes retenus par une moule) pour tous les stades de développement de P. grani (en particulier les œufs et les nauplius) par les M. galloprovincialis atteignait 90 %, ce qui incriminait l'implication de P. grani dans le cycle vital de M. refringens (Boyer et al. 2013). Cependant, des études expérimentales démontrant la transmission de Marteilia spp. des copépodes infectés aux mollusques non infectés sont nécessaires afin de corroborer l'implication des copépodes dans le cycle vital de ces parasites (Carrasco et al. 2015).
L'ADN du parasite Marteilia a été détecté dans d'autres organismes marins qui ne sont pas des bivalves grâce à une réaction en chaîne de la polymérase (PCR). Plus précisément, Audemard et al. (2002) ont détecté l'ADN de Marteilia dans 13 espèces, y compris des espèces non planctoniques, notamment Cereus pendunculatus (Cnidaria) et Lineus gisserensis (Nematoda), des claires françaises destinées à la culture d'huîtres, et la prévalence la plus élevée a été observée chez les P. grani. Carrasco et al.(2007a,b, 2008b) ont détecté de l'ADN de M. refringens dans d'autres copépodes (3 calanoïdes, Acartia discaudata, A. clausi et A. italica; 1 cyclopidé, Oithona sp.; et au moins 1 harpacticoïde, Euterpina acutifrons et une espèce d'harpacticoïde non identifiée) et dans les stades larvaires des crustacés décapodes (larves zoés de Brachyura, probablement Portumnus sp.) des baies naturelles du delta de l'Èbre (nord-ouest de la mer méditerranéenne, Espagne) où la moule est le principal mollusque élevé. Burreson (2008) a indiqué que l'essai de PCR utilisé par Carrasco et al. (2007a, b) n'a pas été validé pour détecter Marteilia spp. Comme les résultats se rapportant uniquement à l'essai de PCR et provenant d'essais non validés n'ont pas été confirmés histologiquement, ils devraient être interprétés avec prudence et la contribution de ces organismes au cycle de vie des parasites M. refringens / maurini reste à établir.
Les stades de développement de Marteilia spp. chez les bivalves ont été décrits par Grizel et al. (1974a, b), Perkins (1976), Grizel (1976 1987), Franc (1980), Lauckner (1983), et Kleeman et al. (2002a), puis résumés par Bower (2006) comme suit. Dans tous les cas de Marteilia spp., les infections commencent vraisemblablement à partir d'une cellule primaire ou d'une cellule souche (de 5 à 8 μm de diamètre) parmi les cellules épithéliales de l'intestin (habituellement l'estomac) et probablement des branchies et des palpes labiaux. La cellule primaire uninucléée développe une cellule fille secondaire uninucléée dans une vacuole de son cytoplasme. La cellule fille se divise par fission binaire et produit quatre cellules filles au sein de la cellule primaire (souche) élargie, et dans chaque cellule fille une cellule uninucléé se produit par clivage interne. La cellule primaire se dégénère et libère les cellules filles, qui deviennent à leur tour de nouvelles cellules primaires. Dans l'intestin, le parasite pénètre la membrane basale des tubules de la glande digestive et s'établit sous la forme de cellules nourricières à la base des cellules épithéliales. Les cellules nourricières contenant des cellules filles prolifèrent et finissent par se dégrader. Les cellules filles dans les cellules épithéliales des tubules de la glande digestive deviennent des sporangiosorus appelés « cellules primaires » par Perkins et Wolf (1976), et pansporoblastes par Mialhe et al. (1985). La sporulation s'est produite dans le sporangiosorus par l'intermédiaire d'un processus de clivages internes (endosporulation, bourgeonnement endogène) qui produit des cellules à l'intérieur de cellules (fig. 1). Au début de la sporulation du parasite M. refringens, des segments uninucléés sont délimités au sein du cytoplasme du sporangiosorus et forment les primordiums des sporanges (cellules secondaires). Finalement, de 8 à 16 primordiums des sporanges (d'environ 12 μm de diamètre chacun à maturité) se forment au sein du sporangiosorus qui retient son noyau et gonfle jusqu'à atteindre 30 μm de diamètre. Chaque primordium des sporanges devient un sporonte contenant de 2 à 4 primordiums de spores (cellules tertiaires) qui deviennent à leur tour des spores (fig. 1). Chaque spore contient 3 sporoplasmes uninucléés répartis selon leur taille, chacun étant entouré du cytoplasme contenu dans les sporoplasmes de taille plus importante (c.-à-d. clivage interne consécutif de deux sporoplasmes à l'intérieur du primordium de la spore) (Perkins 1976). Une paroi continue de spore sans opercule apparaît autour de chaque spore sphéroïde mature mesurant de 3,5 à 4,5 μm de diamètre. À mesure que la spore grandit, des corps d'inclusion réfractiles et clairs apparaissent dans le cytoplasme du sporonte entourant les spores. Le nom spécifique de M. refringens dérive de ces corps d'inclusion « réfringents ». Les spores matures sont évacuées de l'huître à partir de la lumière du tube, et les huîtres infectées peuvent décharger d'importantes quantités de spores avant de mourir.
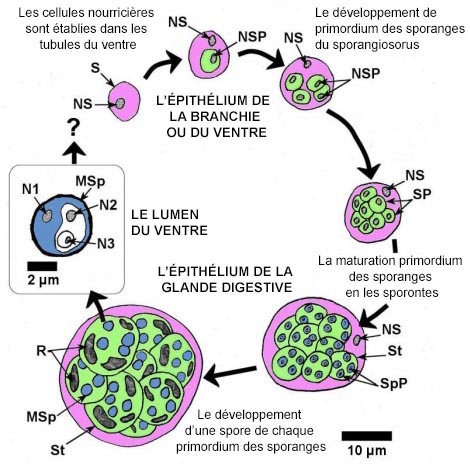
L'image a été modifiée par rapport à l'original pour la traduction française.
Figure 1. Schéma à l'échelle des différentes étapes du processus de sporulation de Marteilia spp. avec le cytoplasme, en couleur pour faciliter la compréhension. S = sporangiosorus (ou cellule primaire, cytoplasme rose), NS = noyau du sporangiosorus, SP = primordium des sporanges qui se transforme en sporonte (cellule secondaire, cytoplasme vert), NSP = noyau du primordium des sporanges, St = sporonte, SpP = primordium des spores qui se transforme en spore (cellule tertiaire, cytoplasme bleu), MSp = spore mature, R = corps réfringents, N1 = noyau du sporoplasme le plus éloigné, N2 = noyau du sporoplasme du milieu, N3 = le noyau du sporoplasme le plus proche.
Les premières étapes de l'infection (sans formation de spores) ont été observées dans l'épithélium de la zone apicale de l'estomac des C. gigas de Bretagne, en France (Cahour 1979) et Galicie, en Espagne (Montes et al. 1998). Montes et al. (1998) ont indiqué que les infections par Marteilia sp. chez les C. gigas étaient transitoires et ne constituaient pas un obstacle à la culture des huîtres du Pacifique, C. gigas, dans les régions enzootiques du parasite M. refringens.
Techniques de diagnostic
Résumé
Il n'existe aucune caractéristique morphologique connue qui puisse être utilisée pour différencier entre M. refringens, M. maurini et de M. pararefringens.L'OIE (2012) recommande les empreintes tissulaires et l'histologie des huîtres juvéniles et adultes comme méthodes de diagnostic standard, notamment pour les infections modérées à graves dans les zones enzootiques. Cependant, Darriba Couñago (2017) a souligné qu'il n'est pas toujours possible d'identifier les espèces de Marteilia uniquement par observation au microscope optique, à moins qu'une identification précise ne soit déjà indiquée avec d'autres techniques. Par conséquent, l'analyse moléculaire à l'aide d'essais spécifique de la réaction en chaîne de la polymérase (PCR) qui ciblent la région de l'ITS1 de M. refringens est la méthode de choix pour les infections mineures (Le Roux et al. 2001), ou mises en quarantaine avant la remise de liberté des stocks introduits. La réaction en chaîne de la polymérase peut également être utilisée pour la surveillance ciblée et le diagnostic de présomption (OIE 2012, Aranguren et Figueras 2016). Cependant, Burreson (2008) a averti qu'un résultat positif à l'essai de PCR ne confirme une infection chez un hôte testé que si l'essai a été correctement validé pour la zone géographique et les hôtes examinés. De plus, les outils moléculaires détectent les séquences d'ADN de l'agent pathogène, ce qui ne signifie pas que l'agent pathogène est viable dans la cellule hôte et que l'infection est établie (Aranguren et Figueras 2016). Le diagnostic de confirmation peut être effectué au moyen du séquençage de produits de réaction en chaîne de la polymérase qui peut être également étayé par l'hybridation in situ (Le Roux et al. 1999) ou la microscopie électronique à transmission (Englesma et Hine 2010a). Cependant, les critères après hybridation in situ ou ultrastructuraux uniquement ne sont pas suffisants pour distinguer M. refringens et M. maurini (s'ils s'avèrent être des espèces distinctes) et diverses autres espèces de Marteilia spp. (Arzul 2011, Carrasco et al. 2015).
Observations générales
Les signes cliniques comprennent des mollusques morts ou présentant des valves béantes (mollusques de 2 ans ou plus), surtout les températures supérieures à 17° C (OIE 2012). On a observé chez les O. edulis infectées des glandes digestives pâles, une chair mince et aqueuse, un rétrécissement du manteau et une baisse du taux de croissance, et les spécimens faibles sont exposés à d'autres facteurs de stress (Grizel et al. 1974a). Cependant, ces signes cliniques ne sont pas propres à l'infection par le parasite M. refringens et pourraient indiquer la présence d'autres infections (Berthe et al. 2004, ICES 2012).
Préparations humides
Dans les cas d'infections avancées, on a pu observer des sporanges matures avec des granules 'réfringents' dans les préparations humides d'huîtres présentant des valves béantes, d'huîtres récemment mortes ou de fèces d'huîtres vivantes. Écrasement sur une lame de verre d'une portion de glande digestive ou de fèces provenant d'huîtres suspectes. Les lames sont observées à un grossissement de 400x, et sont susceptibles de révéler des granules 'réfringents' dans les sporanges matures. On considère que le résultat est positif lorsque l'on observe des corps sphériques de taille importante (20–30 μm) contenant des parois sphériques épaisses (spores). Chez les espèces sensibles, dans l'aire de répartition géographique connue de l'infection par M. refringens/maurini, un résultat positif révèle une infection par ces parasites. Chez d'autres, ou en dehors de l'aire de répartition géographique connue de l'infection par M. refringens/maurini, un résultat positif révèle une infection par un parasite de type Marteilia qui doit être confirmée par le laboratoire de référence de l'OIE (OIE 2012).
Frottis / Empreintes du tissu
En cas d'infection avancée, on peut observer des parasites dont les tailles varient de 30–40 μm dans les empreintes des glandes digestives d'huîtres présentant des valves béantes ou d'huîtres récemment mortes. Préparer des empreintes des glandes digestives d'huîtres suspectes en retirant l'excès de liquide des tissus excisés sur du papier absorbant et en plaçant plusieurs préparations sur une lame de verre. Ensuite, les lames séchées à l'air sont fixées dans du méthanol ou de l'éthanol absolu et colorées à l'aide d'une trousse de coloration de frottis sanguins disponible dans le commerce, conformément aux instructions du fabricant (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter). Après le rinçage à l'eau du robinet et le séchage, on place sur chaque lame un couvre-objet à l'aide d'une résine synthétique appropriée. Dans un premier temps, les lames sont observées à un grossissement de 200×, puis sous un film d'huile à un grossissement de 1000×. Il convient de noter que dans la mesure où les infections peuvent être focales et que les étapes initiales et avancées de l'infection ciblent divers tissus, il se peut que les empreintes ne révèlent pas les niveaux d'infection précoces et faibles. On obtient un résultat positif lorsqu'on observe des cellules de 30 à 40 μm de diamètre contenant du cytoplasme basophile, un noyau éosinophile, des auréoles pâles autour de granules de grande taille et très tachetés (réfringents) et, dans les cellules plus grandes, on peut observer des cellules à l'intérieur des structures cellulaires (Grizel et al.1974a, b; Berthe et al. 2000, 2004; ICES 2012) pour des images en couleur voir Arzul 2011; et Elgharsalli et al. 2013. Chez les espèces sensibles, dans l'aire de répartition géographique connue de l'infection par M. refringens/maurini, un résultat positif révèle à coup sûr une infection par ces parasites. Chez d'autres, ou en dehors de l'aire de répartition géographique connue de l'infection par M. refringens/maurini, un résultat positif révèle une infection par un parasite de type Marteilia qui doit être confirmée par le laboratoire de référence de l'OIE (OIE 2012).
Histologie
Des sections transversales d'huîtres contaminées montrent des parasites d'une taille variant de 4 à 40 μm (Darriba Couñago 2017). On trouve principalement les plasmodes jeunes (uninucléés) dans l'épithélium de l'estomac et des lamelles branchiales ou possiblement du tissu conjonctif du manteau, des palpes labiaux ou des branchies (Carrasco et al. 2015). La sporulation consiste en divisions de cellules à l'intérieur d'autres cellules, et ces dernières se déroulent dans les cellules épithéliales des tubules et les conduits du gland digestif. Des granules 'réfringents' apparaissent pendant la phase de sporulation, mais on n'en a pas observé pendant la phase initiale. Dans les phases avancées de l'infection, des sporanges détachés sont observés dans la lumière du tube digestif. Les coupes tissulaires imprégnées d'hématoxyline et d'éosine révèlent que le cytoplasme présente une coloration basophile, le noyau présente une coloration éosinophile et que des granules peuvent présenter une coloration allant d'orange foncé à rouge foncé (ICES 2012, Elgharsalli et al. 2013). La caractéristique unique du clivage interne permettant de produire des cellules à l'intérieur d'autres cellules pendant la sporulation différencie les Paramyxida comprenant des Marteilia spp. de tous les autres protistes. Les valeurs de sensibilité et de spécificité pour l'histologie ont été estimées respectivement à 70 % et 99 % (Thébault et al. 2005). Une technique de coloration modifiée par Gutiérrez (1977) peut améliorer la détection du parasite dans des coupes histologiques enrobées dans de la paraffine.

Figure 2. sporangiosorus (flèches) et spores en développement (pointes de flèches) de Marteilia refringensdans l'épithélium du tubule de la glande digestive de Ostrea edulis. Image des coupes histologiques fournies par I. Arzul à partir du laboratoire de référence de l'OIE pour ce pathogène. Coloration à l'hématoxyline et à l'éosine
Microscope électronique
Bonami et al. (1971) ont décrit les corps osmophiles (réfringents) dans le cytoplasme de M. refringens et Grizel et al. (1974b) ont fait rapport sur les cellules à l'intérieur des structures cellulaires de ce parasite. Des organites cytoplasmiques appelés haplosporosomes semblables à ceux décrits dans les cas de Haplosporidia ont été déclarés pour M. refirngens (Perkins 1979, Comps et al. 1980). Comps et al. (1981 (1982)) ont indiqué que M. refringens peut être différencié de Marteilia maurini chez les Mytilus galloprovincialis par des différences subtiles, dont la forme des haplosporosomes et l'« existence d'une enveloppe constituée de plusieurs membranes à côté de la paroi des spores ». Toutefois, Longshaw et al. (2001) ont conclu que ces critères étaient invalides. Les haplosporosomes des Marteilia matures présents dans les huîtres et les moules avaient une forme similaire (sphéroïdes et aplaties), même si celles des moules étaient un peu plus petites, et la morphologie de la paroi des spores variait en fonction de l'état de maturité du parasite. Par contre, les critères ultrastructuraux ne sont pas suffisants pour différencier les parasites Marteilia refringens et M. maurini (Arzul 2011). Elgharsalli et al. (2013) ont illustré l'ultrastructure des différents stades du parasite M. refringens chez les Ostrea stentina.
Comps et al. (1979) ont décrit un hyperparasite de l'espèce Microspora (Nosema ormieresi) dans les M. refringens présents chez les O. edulis cueillies dans le bassin d'Arcachon, en France. Cet hyperparasite a entraîné des changements nécrotiques des cellules primaires et des sporanges comme la dégénérescence, une altération de la membrane, une condensation du cytoplasme et une réduction du nombre de spores. Même s'il a été proposé comme solution potentielle de contrôle biologique, cet hyperparasite n'a plus été signalé depuis sa première observation, ce qui explique probablement sa rareté dans l'environnement naturel, et étant donné que l'on ne connaît pas son mode de transmission, il est peu probable qu'on l'utilise aux fins de contrôle biologique (Berthe et al. 2004). Des hyperparasites microsporidies ont également été signalées pour le parasite M. refringens infectant les M. galloprovincialis en Galice (Espagne) (Villalba et al. 1993) et pour le parasite Marteilia cochillia infectant les Cerastoderma edule provenant aussi de la Galice (Espagne) (Villalba et al. 2014).
Isolement et purification
Mialhe et al. (1985) ont décrit une procédure d'isolement et de purification des Marteilia sp. des huîtres et des moules par l'application de gradients de densité sur un homogénat de glandes digestives gravement infectées. Rodriguez (1997) a utilisé des gradients de densité de Percoll pour obtenir des isolats de Marteilia sp. aux fins d'analyse moléculaire.
Sondes à ADN
En 1997, Rodriguez (1997) a indiqué qu'il avait réussi l'identification initiale d'un contig de 244 paires de bases contenant un segment du gène ARN ribosomique de la petite sous-unité (ADNr de la petite sous-unité ou de la région 18S) provenant de Marteilia sp. Depuis, la séquence nucléotide du gène de l'ADNr 18S a été comparée à celle de plusieurs organismes eucaryotes, et des amorces de la réaction en chaîne de la polymérase ont été élaborées (Le Roux et al. 1999). At that time, la spécificité du fragment amplifié de Marteilia sp. a été confirmée par le transfert de Southern à l'aide d'une oligosonde. Berthe et al. (2000) ont déclaré que la séquence génétique de l'ADNr de la sous-unité de Marteilia sp. qu'ils ont isolée à partir des O. edulis et M. edulis cueillies dans plusieurs endroits en France était identique. Par la suite, il s'est avéré que cet essai de la réaction en chaîne de la polymérase (PCR) détectait M. refringens, M. cochillia, M. sydneyi et probablement d'autres espèces de Marteilia spp. et qu'il pourrait mieux convenir à la détection de parasites du genre Marteilia (Carrasco et al. 2015). Par conséquent, l'Organisation mondiale de la santé animale recommande l'utilisation d'amorces de PCR ciblant la région de l'ITS1 (espaceur transcrit interne) décrit par Le Roux et al. (2001) pour amplifier M. refringens (OIE 2012). Le Roux et al. (2001) ont soumis les produits de réaction en chaîne de la polymérase de la région de l'ITS1 au polymorphisme de longueur des fragments de restriction (RFLP) avec l'endonucléase HhaI, ce qui a généré deux profils différents utilisés pour distinguer le type « O » et le type « M » de M. refringens. Cependant, comme le type « M » affiche le même profil que le parasite M. cochillia provenant des coques (Cerastoderma edule), il est possible que l'utilisation de cette méthode conduise à des erreurs d'identification (Carrasco et al. 2012). Carrasco et al. (2017) ont élaboré un essai de la réaction en chaîne de la polymérase compétitive et en temps réel basé sur l'ITS1 du parasite M. refringens pour la détection rapide et sensible de M. refringens qui différenciait entre les génotypes « M » et « O » de M. refringens et du parasite étroitement apparenté M. cochillia. Cet essai de la réaction en chaîne de la polymérase en temps réel s'est révélé d'être analytiquement sensible et précis, et la répétabilité et l'efficacité élevées (Carrasco et al. 2017). Kerr et al. (2018) ont conçu et ont testé des nouvelles amorces de PCR propres à l'espèce Marteilia qui s'amplifiaient de l'extrémité 3' du gène de l'ARNr 18S au gène 5.8S, ce qui amplifiait précisément la région cible des échantillons de tissu et de l'environnement et permettait de différencier M. refringens et M. pararefringens.
Outre l'analyse, un essai de PCR à plusieurs critères de classification seulement avec M. refringens provenant d'huîtres O. edulis, et M. galloprovincialis de Huelva, au sud-ouest de l'Espagne et de deux emplacements au nord-ouest de l'Italie, a été mis au point à l'aide d'amorces ciblant l'espaceur intergénique (IGS) de l'ADNr (López-Flores et al. 2004). Il s'est avéré que cet essai était plus sensible que la PCR ciblant l'ITS1, mais des essais plus approfondis doivent être effectués pour évaluer la spécificité (OIE 2012). La méthode du polymorphisme de longueur des fragments de restriction de réaction en chaîne de la polymérase (RFLP-PCR) sur l'espaceur intergénique (IGS) avec l'enzyme BglII a affiché des profils différents pour les parasites M. refringens et M. cochillia (Carrasco et al. 2012). Étant donné que l'infection peut être focale et parce qu'elle cible différents tissus aux étapes initiales et avancées, la sensibilité de la détection par PCR peut être inférieure au résultat de PCR prévu théoriquement. De faux résultats négatifs peuvent aussi se produire en raison d'inhibiteurs qui peuvent être présents dans l'échantillon et qui pourraient nuire à l'activité de l'ADN polymérase (Aranguren et Figueras 2016). Une réaction PCR à plusieurs critères de classification a été mise au point pour le diagnostic de M. refringens chez les Mytilus galloprovincialis de Galicie, en Espagne (Pernas et al. 2001). On peut trouver des séquences des régions de l'ADNr de et IGS dans des banques de gènes publiques.
Des protocoles d'hybridisation in situ (ISH) ont été mis au point et publiés (Le Roux et al. 1999, Berthe et al. 2000). Les sondes qui ciblent la région de la petite sous-unité (18S) du complexe de gènes de l'ARNr ont été validées par rapport à l'histologie (Le Roux et al. 1999, Thébault et al. 2005). Cependant, on a observé que la sonde, nommée SMART 2, réagit avec les parasites Marteilia sydneyi et Marteilioïdes chungmuensis (Kleeman et al. 2002b). De plus, un essai d'hybridation in situ a été mis au point grâce à une sonde ciblant l'espaceur intergénique (IGS) de l'ADNr (Lopez-Flores et al. 2008a, b). Cet essai s'est révélé plus spécifique que l'hybridation in situ portant sur la sous-unité, mais doit encore faire l'objet d'une validation approfondie. l'hybridisation in situ peut aider à détecter des infections précoces, qui sont plus difficiles à détecter à partir de coupes histologiques traditionnelles (Arzul 2011, ICES 2012).
Méthodes de contrôle
Actuellement, la principale méthode de contrôle consiste à limiter les déplacements entre les zones infectées et celles qui ne le sont pas, ainsi qu'à capturer ou à éliminer le cheptel conchylicole infecté (Berthe et al. 2004, Carrasco et al. 2015). Les huîtres provenant de zones infectées connues (actuelles ou historiques) ne doivent pas être transférées vers des zones où aucune trace de M. refringens n'a été détectée. Les huîtres provenant de zones où les espèces M. galloprovincialis ou M. edulissont infectées par Marteilia spp. doivent être traitées avec la même précaution. Dans les zones enzootiques, on peut effectuer un contrôle en réduisant le semis de naissains d'O. edulis pendant la période de transition (juillet et août) et en élevant les O. edulisdans des zones à salinité élevée (35 à 37 ppt) et des eaux plus profondes (zones subtidales ou sublittorales comme les eaux de la côte extérieure) afin de limiter la prolifération de M. refringens (Berthe et al. 2004, Alfjorden et al. 2017). La température seuil de la sporulation et la transmission du parasite est de 17 °C (Grizel 1987). Cette température et des températures plus chaudes sont courantes dans les estuaires ou les baies où la prévalence est habituellement élevée dans les parties supérieures de la colonne d'eau (Audemard et al. 2001, Berthe et al. 2004). Les infections par M. refringens sont rares en eau libre (OIE 2012). La salinité élevée et le renouvellement de l'eau pourraient nuire au développement et à la transmission de M. refringens, bien que ces paramètres semblent avoir un effet moins important que la température (Audemard et al. 2001). L'ensemencement à de faibles densités ou en association avec des espèces de mollusques résistants, comme les huîtres du Pacifique introduites Crassostrea gigas, pourrait être efficace pour lutter contre les maladies (Bodoy et al. 1991, OIE 2012). Cependant, Bodoy et al. (1991) et le CIEM (2012) ont soutenu que toute production importante d'O. edulis dans les étangs salins de marée où le parasite M. refringens est présent pouvait être obtenue seulement avec des cycles de production très courts, de manière à ce que la taille commerciale soit atteinte avant que la contamination par M. refringens provoque une forte mortalité. De plus, la hausse de la production de C. gigas a permis de remplacer la culture d'O. edulis (Grizel 1983). Comps (1975) a indiqué que le fait de maintenir des huîtres infectées hors de l'eau pendant cinq (5) jours semblait réduire l'intensité de l'infection, une fois les huîtres remises à l'eau. Peu de tentatives ont été faites pour développer une résistance aux maladies provoquées par le parasite M. refringens grâce à la sélection génétique, bien que les observations laissent entendre qu'un fondement biologique existe.(Berthe et al. 2004, Carrasco et al. 2015).
Références
- Alderman, D.J. 1979. Epizootiology of Marteilia refringens in Europe. Marine Fisheries Review 41: 67-69.
- Alfjorden, A., M. Areskog, D. Bruno, R. Carnegie, D. Cheslett, S. Feist, S. Ford, S. Jones, A. Lillehaug, L. Madsen, T. Renault, N. Ruane and P. Vennerström. 2017. New Trends in Important Diseases Affecting the Culture of Fish and Molluscs in the ICES Area 2002 – 2015. In: Anderson, E.D., N. Ruane, R. Carnegie (eds.) ICES Cooperative Research Report No. 337, International Council for the Exploration of the Sea, Conseil International pour l'Exploration de la Mer, Copenhagen, Denmark. 50 pp.
- Aranguren, R. and A. Figueras. 2016. Moving from histopathology to molecular tools in the diagnosis of molluscs diseases of concern under EU Legislation. Frontiers in Physiology 7: 538.
- Arzul, I. 2011. EURL (European Union Reference Laboratory) for Molluscs Diseases: Marteilia refringens.
- Arzul, I., B. Chollet, S. Boyer, D. Bonnet, J. Gaillard, Y. Baldi, M. Robert, J.-P. Joly, C. Garcia and M. Bouchoucha. 2014. Contribution to the understanding of the cycle of the protozoan parasite Marteilia refringens. Parasitology 141: 227-240.
- Audemard, C., A. Barnaud, C.M. Collins, F. Le Roux, P.-G. Sauriau, C. Coustau, P. Blachier and F.C.J. Berthe. 2001. Claire ponds as an experimental model for Marteilia refringens life-cycle studies: new perspectives. Journal of Experimental Marine Biology and Ecology 257: 87-108.
- Audemard, C., F. Le Roux, A. Barnaud, C. Collins, B. Sautour, P.-G. Sauriau, X. De Montaudouin, C. Coustau, C. Combes and F. Berthe. 2002. Needle in a haystack: involvement of the copepod Paracartia grani in the life-cycle of the oyster pathogen Marteilia refringens. Parasitology 124: 315-323.
- Audemard, C., M.-C. Sajus, A. Barnaud, B. Sautour, P.G. Sauriau and F.J.C. Berthe. 2004. Infection dynamics of Marteilia refringens in flat oyster Ostrea edulis and copepod Paracartia grani in a claire pond of Marennes-Oléron Bay. Diseases of Aquatic Organisms 61: 103-111.
- Balouet, G. 1978. Etudes sur la pathologie des huîtres. Contrat C.N.E.X.O. 78/1857. Document nº 1927. 47 pp.
- Balouet, G. 1979. Marteilia refringens - considerations of the life cycle and development of Abers disease in Ostrea edulis. Marine Fisheries Review 41: 64-66.
- Balouet, G., A. Cahour et C. Chastel. 1979. Epidémiologie de la maladie de la glande digestive de l'huître plate: hypothèses sur le cycle de Marteilia refringens. (Epidemiology of flat oyster digestive tract disease: hypothesis on Marteilia refringens). Haliotis 8, 1977: 323-326.
- Balouet, G., C. Chastel, A. Cahour, A. Quillard et M. Poder. 1979. Étude épidémiologique et pathologique de la maladie de l'huître plate en Bretagne. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 289: 13-23.
- Balseiro, P., A. Montes, G. Ceschia, C. Gestal, B. Novoa and A. Figueras. 2007. Molecular epizootiology of the European Marteilia spp., infecting mussels (Mytilus galloprovincialis and M.edulis) and oysters (Ostrea edulis): an update. Bulletin of the European Association of Fish Pathologists 27: 148-156.
- Berthe, F.C., M. Pernas, M. Zerabib, P. Haffner, A. Thébault and A.J. Figueras. 1998. Experimental transmission of Marteilia refringens with special consideration of its life cycle. Diseases of Aquatic Organisms 34: 135-144.
- Berthe, F.C.J., F. Le Roux, E. Peyretaillade, P. Peyret, D. Rodriguez, M. Gouy and C.P. Vivarès. 2000. Phylogenetic analysis of the small subunit ribosomal RNA of Marteilia refringens validates the existence of Phylum Paramyxea (Desportes and Perkins 1990). The Journal of Eukaryotic Microbiology 47: 288-293.
- Berthe, F.C.J., F. Le Roux, R.D. Adlard and A. Figueras. 2004. Marteiliosis in molluscs: A review. Aquatic Living Resources 17: 433-448.
- Bodoy, A., S. Bougrier, P. Geairon, J. Garnier, V. Boulo and S. Heurtebise. 1991. Does the prevalence of Bonamia and Marteilia diseases be reduced on flat oysters (Ostrea edulis) of Atlantic and Mediterranean origin, when they are reared together with the Japanese oyster (Crassostrea gigas) in tidal ponds? International Council for Exploration of the Sea C.M. 1991/K:28: 10 pp.
- Bonami, J.R., H. Grizel, C. Vago et J.L. Duthoit. 1971. Recherches sur une maladie épizootique de l'huître plate, Ostrea edulis Linne. Revue des Travaux de l'Institut des Pêches Maritimes 35: 415-418.
- Bougrier, S., G. Tigé, E. Bachère and H. Grizel. 1986. Ostrea angasi acclimatization to French coasts. Aquaculture 58: 151-154.
- Bower, S.M. 2006. Parasitic diseases of shellfish. In: Woo, P.T.K. (ed.) Fish Diseases and Disorders, Volume 1: Protozoa and Metazoan Infections, Second Edition, CABI, Wallingford. pp. 629-677.
- Boyer, S., B. Chollet, D. Bonnet and I. Arzul. 2013. New evidence for the involvement of Paracartia grani (Copepoda, Calanoida) in the life cycle of Marteilia refringens (Paramyxea). International Journal for Parasitology 43: 1089-1099.
- Burreson, E.M. 2008. Misuse of PCR assay for diagnosis of mollusc protistan infections. Diseases of Aquatic Organisms 80: 81-83.
- Cahour, A. 1979. Marteilia refringens and Crassostrea gigas. Marine Fisheries Review 41: 19-20.
- Cavalier-Smith, T. and E.E.Y. Chao. 2003. Phylogeny and Classification of Phylum Cercozoa (Protozoa). Protist 154: 341-358.
- Carrasco, N., I. López-Flores, M. Alcaraz, M.D. Furones, F.C.J. Berthe and I. Arzul. 2007a. First record of a Marteilia parasite (Paramyxea) in zooplankton populations from a natural estuarine environment. Aquaculture 269: 63-70.
- Carrasco, N., I. López-Flores, M. Alcaraz, M.D. Furones, F.C.J. Berthe and I. Arzul. 2007b. Dynamics of the parasite Marteilia refringens (Paramyxea) in Mytilus galloprovincialis and zooplankton populations in Alfacs Bay (Catalonia, Spain). Parasitology 134: 1541-1550.
- Carrasco, N., I. Arzul, B. Chollet, M. Robert, J.P. Joly, M.D. Furones and F.C.J. Berthe. 2008a. Comparative experimental infection of the copepod Paracartia grani with Marteilia refringens and Marteilia maurini. Journal of Fish Diseases 31: 497-504.
- Carrasco, N., I. Arzul, F.C.J. Berthe, M. Fernández-Tejedor, M. Durfort and M.D. Furones. 2008b. Delta de l'Ebre is a natural bay model for Marteilia spp. (Paramyxea) dynamics and life-cycle. Diseases of Aquatic Organisms 79: 65-73.
- Carrasco, N., K.B. Andree, B. Lacuesta, A. Roque, C. Rodgers and M.D. Furones. 2012. Molecular characterization of the Marteilia parasite infecting the common edible cockle Cerastoderma edule in the Spanish Mediterranean coast. A new Marteilia species affecting bivalves in Europe? Aquaculture 324-325: 20-26.
- Carrasco, N., P.M. Hine, M. Durfort, K.B. Andree, N. Malchus, B. Lacuesta, M. González, A. Roque, C. Rodgers and M.D. Furones. 2013. Marteilia cochillia sp. nov., a new Marteilia species affecting the edible cockle Cerastoderma edule in European waters. Aquaculture 412–413: 223-230.
- Carrasco, N., T.J. Green and N. Itoh. 2015. Marteilia spp. parasites in bivalves: A revision of recent studies. Journal of Invertebrate Pathology 131: 43-57.
- Carrasco, N., M. Voorbergen-Laarman, B. Lacuesta, D. Furones and M.Y. Engelsma. 2017. Application of a competitive real time PCR for detection of Marteilia refringens genotype "O" and "M" in two geographical locations: the Ebro Delta, Spain and the Rhine-Meuse Delta, the Netherlands. Journal of Invertebrate Pathology 149: 51-55.
- Comps, M. 1970. Observations sur les causes d'une mortalite anormale des huîtres plates dans le bassin de Marennes. Revue des Travaux de l'Institut des Pêches Maritimes. 34: 317-326.
- Comps, M. 1975 (1976). Etude expérimentale de différentes conditions de mileu sur le comportement du parasite de la glande digestive de l'huître plate (Ostrea edulis L.). Colloque International de Malacologie Marine Appliquée, Actes du colloque, La Rochelle, 16-20 juin 1975. Haliotis 5: 68-74.
- Comps, M. 1976. Marteilia lengehi n. sp., parasite of the oyster Crassostrea cucullata. Born. Revue des Travaux de l'Institut des Pêches Maritimes 40: 347-349.
- Comps, M. et J.P. Joly. 1980. Contamination expérimentale de Mytilus galloprovincialis Lmk par Marteilia refringens. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 301: 19-21.
- Comps, M., H. Grizel, G. Tige‚ et J.L. Duthoit. 1975. Parasites nouveaux de la glande digestive des mollusques marins Mytilus edulis L. et Cardium edule L. Comptes Rendus Académie des Sciences de Paris, Série D 281: 179-181
- Comps, M., Y. Pichot et J.P. Deltreil. 1979. Mise en evidence d'une microsporidie parasite de Marteilia refringens agent de la maladie de la glande digestive de Ostrea edulis L. Revue des Travaux de l'Institut des Pêches Maritimes. 43: 409-412.
- Comps, M., G. Tigé et H. Grizel. 1980. Étude ultrastructurale d'un protiste parasite de l'huître Ostrea edulis. Comptes Rendus Académie des Sciences Paris, Série D 290: 383-384.
- Comps, M., Y. Pichot et P. Papagianni. 1981 (1982). Recherche sur Marteilia maurini n. sp. parasite de la moule Mytilus galloprovincialis Lmk. Revue des Travaux de l'Institut des Pêches Maritimes 45: 211-214.
- Comps, M., H. Grizel et Y. Papayanni.1982. Infection parasitaire causée par Marteilia maurini sp. n. chez la moule Mytilus galloprovincialis. Conseil International pour l'Exploration de la Mer C.M. 1982/F: 24: 3 pp.
- Darriba Couñago, S. 2017. Atlas de Histopatoloxía, Moluscos bivalvos mariños. Histopathological Atlas, Marine bivalve molluscs. Published by Intecmar. Xunta de Galicia (Consellería do Mar), Edificios administrativos - San Caetano, s/n, Santiago de Compostela, Espagne.
- Elgharsalli, R., N. Aloui-Bejaoui, H. salah, B. Chollet, J.-P. Joly, M. Robert, Y. Couraleau and I. Arzul. 2013. Characterization of the protozoan parasite Marteilia refringens infecting the dwarf oyster Ostrea stentina in Tunisia. Journal of Invertebrate Pathology 112: 175-183.
- Engelsma, M and M. Hine. 2009a. Infection with Marteilia refringens: disease detection, pathogen identification and typing. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen and M. Engelsma. 2010. Epidemiology of different agents causing disease in aquatic animals: scientific review and database development (Parma, Italy, European Food Safety Authority (EFSA), 21 p.) Annex B, pp. 55-57.
- Engelsma, M and M. Hine. 2009b. Infection with Marteilia refringens: occurrence and distribution. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen and M. Engelsma. 2010. Epidemiology of different agents causing disease in aquatic animals: scientific review and database development (Parma, Italy, European Food Safety Authority (EFSA), 21 p.) Annex B, pp. 58-62.
- Feist, S.W., P.M. Hine, K.S. Bateman, G.D. Stentiford and M. Longshaw. 2009. Paramarteilia canceri sp. n. (Cercozoa) in the European edible crab (Cancer pagurus) with a proposal for the revision of the order Paramyxida Chatton 1911. Folia Parasitologica 56: 73-85.
- Figueras, A.J. and J. Montes. 1988. Aber disease of edible oysters caused by Marteilia refringens. American Fisheries Society Special Publication 18: 38-46.
- Franc, A. 1980. Sur quelques aspects inédits du cycle de Marteilia refringens Grizel et col. 1974, parasite de l'huître plate Ostrea edulis L. Cahiers de Biologie Marine 21: 99-106.
- Grijalva-Chon, J.M., R. Castro-Longoria, T.L. Enríquez-Espinoza, A.N. Maeda-Martínez and F. Mendoza-Cano. 2015. Molecular evidence of the protozoan parasite Marteilia refringens in Crassostrea gigas and Crassostrea corteziensis from the Gulf of California. Latin American Journal of Aquatic Research 43: 776-780.
- Grizel, H. 1976. Parasitologie des mollusques. Oceanis 3: 190-207.
- Grizel, H. 1979. Marteilia refringens and oyster disease - recent observations. Marine Fisheries Review 41: 38-39.
- Grizel, H. 1983. Impact de Marteilia refringens et de Bonamia ostreae sur l'ostréiculture bretonne. Conseil International pour l'Exploration de la Mer C.M. 1983/Gen: 9: 30 pp.
- Grizel, H. 1987. Les maladies des mollusques : étiologie et progrès récents des recherches. Oceanis 13: 357-370.
- Grizel, H. et G. Tige. 1973. La maladie de la glande digestive d'Ostrea edulis Linne. Conseil International pour l'Exploration de la Mer C.M.1973/K:13: 7 pp.
- Grizel, H. et G. Tige. (1977) 1979. Observations sur le cycle de Marteilia refringens. Haliotis 8, 1977: 327-330.
- Grizel, H., M. Comps, J.R. Bonami, F. Cousserans, J.L. Duthoit et M.A. LePennec. 1974a. Recherche sur l'agent de la maladie de la glande digestive de Ostrea edulis Linné. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 240: 7-30.
- Grizel, H., M. Comps, F. Cousserans, J.-R. Bonami et C. Vago. 1974b. Etude d'un parasite de la glande digestive observé au cours de l'épizootie actuelle de l'huître plate. Comptes Rendus Académie des Sciences de Paris, Série D279: 783-785.
- Grizel, H., M. Comps, D. Raguenes, Y. Leborgne, G. Tige et A.G. Martin. 1982. Bilan des essais d'acclimatation d'Ostrea chilensis sur les cotes de Bretagne. Revue des Travaux de l'Institut des Pêches Maritimes. 46: 209-225.
- Guo, X. and S.E. Ford. 2016. Infectious diseases of marine molluscs and host responses as revealed by genomic tools. Philosophical Transactions of the Royal Society B: Biological Sciences 371: 20150206.
- Gutiérrez, M. 1977. Técnica de coloración del agente de la enfermedad de la glándula digestiva de la ostra plana, Ostrea edulis L. Investigacion Pesquera (Barcelona) 41: 643-645.
- Herrbach, B. 1971. Sur une affection parasitaire de la glande digestive de l'huître plate, Ostrea edulis Linne. Revue des Travaux de l'Institut des Pêches Maritimes. 35: 79-87.
- Hine, P.M. and T. Thorne. 2000. A survey of some parasites and diseases of several species of bivalve mollusc in northern Western Australia. Diseases of Aquatic Organisms 40: 67-78.
- ICES. 2004. Trends in important diseases affecting the culture of fish and molluscs in the ICES area 1998-2002. Prepared and edited by the Working Group on Pathology and Diseases of Marine Organisms. ICES Cooperative Research Report No. 265. 26 pp. International Council for the Exploration of the Sea, Copenhagen, Denmark.
- ICES. 2012. Marteiliosis of oysters caused by Marteilia refringens. Revised and updated by T. Renault and S. E. Ford. ICES (International Council for the Exploration of the Sea) Identification Leaflets for Diseases and Parasites of Fish and Shellfish. Leaflet No. 19. 5 pp.
- Itoh, N., T. Yamamoto, H.-S. Kang, K.-S. Choi, T.J. Green, N. Carrasco, M. Awaji and S. Chow. 2014. A novel paramyxean parasite, Marteilia granula sp. nov. (Cercozoa), from the digestive gland of Manila clam Ruditapes philippinarum in Japan. Fish Pathology 49: 181-193.
- Kerr, R., G.M. Ward, G.D. Stentiford, A. Alfjorden, S. Mortensen, J.P. Bignell, S.W. Feist, A. Villalba, M.J. Carballal, A. Cao, I. Arzul, D. Ryder and D. Bass. 2018. Marteilia refringens and Marteilia pararefringens sp. nov. are distinct parasites of bivalves and have different European distributions. Parasitology 145: 1483-1492.
- Kleeman, S.N., R.D. Adlard and R.J.G. Lester. 2002a. Detection of the initial infective stages of the protozoan parasite Marteilia sydneyi in Saccostrea glomerata and their development through to sporogenesis. International Journal for Parasitology 32: 767-784.
- Kleeman, S.N., F. Le Roux, F. Berthe and R.D. Adlard. 2002b. Specificity of PCR and in situ hybridization assays designed for detection of Marteilia sydneyi and M.refringens. Parasitology 125: 131-141.
- Lauckner, G. 1983. Diseases of Mollusca: Bivalvia, In: Kinne, O. (ed.) Diseases of marine animals. Volume II: Introduction, Bivalvia to Scaphopoda. Biologische Anstalt Helgoland, Hamburg, pp. 477-961.
- Le Roux, F., C. Audemard, A. Barnaud and F. Berthe. 1999. DNA Probes as potential tools for the detection of Marteilia refringens. Marine Biotechnology 1: 588-597.
- Le Roux, F., G. Lorenzo, P. Peyret, C. Audemard, A. Figueras, C. Vivarès, M. Gouy and F. Berthe. 2001. Molecular evidence for the existence of two species of Marteilia in Europe. The Journal of Eukaryotic Microbiology 48: 449-454.
- Longshaw, M., S.W. Feist, R.A. Matthews and A. Figueras. 2001. Ultrastructural characterisation of Marteilia species (Paramyxea) from Ostrea edulis, Mytilus edulis and Mytilus galloprovincialis in Europe. Diseases of Aquatic Organisms 44: 137-142.
- López-Flores, I., R. de la Herrán, M.A. Garrido-Ramos, J.I. Navas and M. Ruiz Rejón. 2004. The molecular diagnosis of Marteilia refringens and differentiation between Marteilia strains infecting oysters and mussels based on the rDNA IGS sequence. Parasitology 129: 411-419.
- López-Flores, I., M.A. Garrido-Ramos, R. de la Herran, C. Ruiz-Rejón, M. Ruiz-Rejón and J.I. Navas. 2008a. Identification of Marteilia refringens infecting the razor clam Solen marginatus by PCR and in situ hybridization. Molecular and Cellular Probes 22: 151-155.
- López-Flores, I., F. Robles, J.M. Valencia, A. Grau, A. Villalba, R. de la Herrán, M.A. Garrido-Ramos, C. Ruiz-Rejón, M. Ruiz-Rejón and J.I. Navas. 2008b. Detection of Marteilia refringens using nested PCR and in situ hybridisation in Chamelea gallina from the Balearic Islands (Spain). Diseases of Aquatic Organisms 82: 79-87.
- Mackin, J.G. 1959. Mortalities in oysters. Proceedings of the National Shellfisheries Association 50: 21-40.
- Marteil, L. 1976. La conchyliculture française, 2 partie : biologie de l'huître et de la moule. Chapitre VI: maladies et mortalites. Revue des Travaux de l'Institut des Pêches Maritimes. 40: 285-313.
- Meyers, T. 2006. 5.2.9 Marteiliasis and marteilioidiasis of shellfish. In: Fish Health Section Blue Book, 2016 Edition, Suggested Procedures for the Detection and Identification of Certain Finfish and Shellfish Pathogens. American Fisheries Society's Fish Health Section.
- Mialhe, E., E. Bachère, C. LeBec et H. Grizel. 1985. Isolement et purification de Marteilia (Protozoa: Ascetospora) parasites de bivalves marins. Compte Rendu Hebdomadaire des Séances de l'Académie des Sciences, Paris. Série III, nº 4 301: 137-142.
- Montes, J., M.A. Longa, A. Lama and A. Guerra. 1998. Marteiliosis of Japanese oyster (Crassostrea gigas) reared in Galicia NW Spain. Bulletin of the European Association of Fish Pathologists 18: 124-126.
- Morel, M. et G. Tige. 1974. Maladie de la glande digestive de l'huître plate. Etude histochimique. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 241: 33-36.
- Novoa, B., D. Posada and A. Figueras. 2005. Polymorphisms in the sequences of Marteilia internal transcribed spacer region of the ribosomal RNA genes (ITS-1) in Spain: genetic types are not related with bivalve hosts. Journal of Fish Diseases 28: 331-338.
- OIE. 2012. Manual of Diagnostic Tests for Aquatic Animals (2019). Chapter 2.4.4. — Infection with Marteilia refringens. There is an OIE (World Organisation for Animal Health) Reference Laboratory for Infection with Marteilia refringens (Veuiller consulter le site internet de l'OIE pour une liste à jour).
- Ormières, R. et H. Grizel. (1977) 1979. Les haplosporidies parasites de mollusques. (Haplosporidia parasites of molluscs.). Haliotis 8, 1977: 49-56.
- Pascual, M., A.-G. Martin, E. Zampatti, D. Coatanea, J. Defossez and R. Robert. 1991. Testing of the Argentina oyster, Ostrea puelchana, in several French oyster farming sites. International Council for Exploration of the Sea C.M.1991/K:30: 17 pp.
- Pascual, S., A. Villalba, E. Abollo, M. Garci, A.F. González, M. Nombela, D. Posada and A. Guerra. 2010. The mussel Xenostrobus securis: a well-established alien invader in the Ria de Vigo (Spain, NE Atlantic). Biological Invasions 12: 2091-2103.
- Perkins, F.O. 1976. Ultrastructure of sporulation in the European flat oyster pathogen, Marteilia refringens - taxonomic implications. Journal of Protozoology 23: 64-74.
- Perkins, F.O. 1979. Cell structure of shellfish pathogens and hyperparasites in the genera Minchinia, Urosporidium, Haplosporidium, and Marteilia - taxonomic implications. Marine Fisheries Review 41: 25-37.
- Pernas, M., B. Novoa, F. Berthe, C. Tafalla and A. Figueras. 2001. Molecular methods for the diagnosis of Marteilia refringens. Bulletin of the European Association of Fish Pathologists 21: 200-208.
- Renault, T. 2008. Genomics and mollusc pathogens: trends and perspective. Journal of Veterinary Clinical Science 1: 4-14.
- Renault, T., N. Cochennec and B. Chollet. 1995. Marteiliosis in American oysters Crassostrea virginica reared in France. Diseases of Aquatic Organisms 23: 161-164.
- Robert, R., M. Borel, Y. Pichot and G. Trut. 1991. Growth and mortality of the European oyster Ostrea edulis in the Bay of Arcachon (France). Aquatic Living Resources 4: 265-274.
- Rodriguez, D. 1997. Essais de caractérisation moléculaire des parasites du genre Marteilia (Phylum Paramyxea) à l'aide de l'ADNr. Diplome d'Etudes Appronfondies de Biologie, Module : Biologie des Protistes. Université Blaise Pascal and Université d'Auvergne.
- Ruiz, M., C. López, R.-S. Lee, R. Rodríguez and S. Darriba. 2016. A novel paramyxean parasite, Marteilia octospora n. sp. (Cercozoa) infecting the grooved razor shell clam Solen marginatus from Galicia (NW Spain). Journal of Invertebrate Pathology 135: 34-42.
- Taveekijakarn, P., G. Nash, T. Somsiri and S. Puttinaowarat. 2002. Marteilia-like species: first report in Thailand. The Aquatic Animal Health Research Institute Newsletter 11: 1-2.
- Taveekijakarn, P., T. Somsiri, P. Puttinaowarat, S. Tundavanitj, S. Chinabut and G. Nash. 2008. Parasitic fauna of rock oyster (Saccostrea forskali) cultured in Thailand, In: Bondad-Reantaso, M.G., C.V. Mohan, M. Crumlish, R.P. Subasinghe (eds.) Diseases in Asian aquaculture VI. Proceedings of the Sixth Symposium on Diseases in Asian Aquaculture, 25-28 October 2005, Colombo, Sri Lanka. Fish Health Section, Asian Fisheries Society, Quezon City, Philippines, pp. 335-342.
- Thébault, A., S. Bergman, R. Pouillot, F. Le Roux and F.C.J. Berthe. 2005. Validation of in situ hybridisation and histology assays for the detection of the oyster parasite Marteilia refringens. Diseases of Aquatic Organisms 65: 9-16.
- Tige, G. et M.A. Rabouin. 1976. Étude d'un lot de moules transférées dans un centre touché par l'épizootie affectant l'huître plate. Conseil International pour l'Exploration de la Mer C.M. 1976/K:21: 10 pp.
- Tige, G., H. Grizel, A. Langlade et M.-A. Rabouin. 1979. Compléments d'observations sur le cycle du parasite, Marteilia refringens (Grizel et coll. 1974). Conseil International pour l'Exploration de la Mer C.M. 1979/K:23: 9 pp.
- van Banning, P. 1979a. Haplosporidian diseases of imported oysters, Ostrea edulis, in Dutch estuaries. Marine Fisheries Review 41: 8-18.
- van Banning, P. 1979b. Protistan parasites observed in the European flat oyster (Ostrea edulis) and the cockle (Cerastoderma edule) from some coastal areas of the Netherlands. Haliotis 8, 1977: 33-37.
- Villalba, A., S.G. Mourelle, M.C. López, M.J. Carballal and C. Azevedo. 1993. Marteiliasis affecting cultured mussels Mytilus galloprovincialis of Galicia (NW Spain). I. Etiology, phases of the infection, and temporal and spatial variability in prevalence. Diseases of Aquatic Organisms 16: 61-72.
- Villalba, A., D. Iglesias, A. Ramilo, S. Darriba, J.M. Parada, E. No, E. Abollo, J. Molares and M.J. Carballal. 2014. Cockle Cerastoderma edule fishery collapse in the Ría de Arousa (Galicia, NW Spain) associated with the protistan parasite Marteilia cochillia. Diseases of Aquatic Organisms 109: 55-80.
- Virvilis, C. and P. Angelidis. 2006. Presence of the parasite Marteilia sp. in the flat oyster (Ostrea edulis L.) in Greece. Aquaculture 259: 1-5.
- Virvilis, C., P. Angelidis and G. Photis. 2003. Presence of the parasite Marteilia sp. in the shellfish of the Thermaikos Gulf in northern Greece. Bulletin of the European Association of Fish Pathologists 23: 157-162.
- Ward, G.M., M. Bennett, K. Bateman, G.D. Stentiford, R. Kerr, S.W. Feist, S.T. Williams, C. Berney and D. Bass. 2016. A new phylogeny and environmental DNA insight into paramyxids: an increasingly important but enigmatic clade of protistan parasites of marine invertebrates. International Journal of Parasitology 46: 605-619.
Information de citation
Bower, S.M. (2019): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Marteiliosis (Aber Disease) of Oysters
Date de la dernière révision : Decembre 2020
Faire parvenir les commentaires à Susan Bower
- Date de modification :