Marteilia spp. des moules
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Nom courants et généralement admis de l'organisme ou de l'agent pathogène
Marteiliose des moules
Nom scientifique ou classification taxonomique
Marteilia refringens, Marteilia maurini et Marteilia pararefringens appartiennent actuellement au phylum Cercozoa et à l'ordre des Paramyxida (Cavalier-Smith et Chao 2003, Feist et al. 2009, Alfjorden et al. 2017), bien que ces parasites aient été classés dans le phylum Paramyxea par le passé (Berthe et al. 2000). Marteilia refringens a été initialement décrit à partir des Ostrea edulis (Grizel et al. 1974) et par la suite, M. refringens a été signalé chez 2% des Mytilus edulis en Bretagne (France) (Comps et al. 1975). Comps et al. (1981 [1982] 1982) ont décrit M. maurini chez les Mytilus galloprovincialis provenant de la lagune de Venise de la mer Adriatique, en Italie et ils ont indiqué que ses caractéristiques structurelles et son cycle de développement étaient similaires à ceux de M. refringens. Malheureusement, il n'existe pas de caractéristique morphologique permettant de distinguer M. refringens de M. maurini (Villalba et al. 1993a; Longshaw et al. 2001). Cependant, Le Roux et al. (2001) ont identifié le dimorphisme génétique de la région de l'espaceur transcrit interne (ITS1) du gène ARN ribosomique, ont appuyé la reconnaissance de deux espèces de Marteilia en Europe et ont proposé que le type « O » corresponde à M. refringens chez les huîtres (O. edulis) et que le type « M » corresponde à M. maurini chez les moules (M. edulis et M. galloprovincialis). Néanmoins, l'apparition du type « O » chez les moules et du type « M » chez les huîtres et des co-infections d'huîtres et de moules par les deux types génétiques se sont produites, mais elles étaient rares dans certaines régions (Le Roux et al. 2001, Novoa et al. 2005, Arzul et al. 2014) et courantes dans d'autres (Novoa et al. 2005, Balseiro et al. 2007, Carrasco et al. 2015). D'après les résultats des essais moléculaires, López-Flores et al. (2004), Novoa et al. (2005) et Balseiro et al. (2007) ont suggéré que la Marteilia provenant des huîtres et des moules pourrait correspondre à deux souches différentes de la même espèce semblant infecter volontiers les deux hôtes in some locations. Arzul et al. (2014) et Carrasco et al. (2015, 2017) ont également soutenu l'hypothèse selon laquelle les types M et O représentent la même espèce unique, M. refringens. Balseiro et al. (2007) a indiqué que d'autres recherches étaient nécessaires (p. ex. sur l'identité moléculaire des nouveaux gènes, en particulier les gènes de codage, la relation entre le parasite et ses différents hôtes, les études écologiques pour connaître le cycle de vie complet, etc.) avant que la synonymie des deux espèces puisse être confirmée. Le laboratoire de référence qui étudie les infections par le parasite Marteilia refringens de l'Organisation mondiale de la santé animale (Office international des épizooties, OIE) reconnaît deux types de Marteilia refringens, à savoir les types O et M (respectivement pour les huîtres et les moules) tels que définis par Le Roux et al. (2001) (OIE 2012). Alfjorden et al. (2017) ont fait valoir que M. refringens et M. maurini devraient, de manière prudente, être considérés comme une seule espèce, M. refringens, pour la gestion plus efficace de la santé. Cependant, Kerr et al. (2018) ont déterminé qu'il y avait au moins deux espèces de Marteilia chez les moules européennes. Comme il n'a pas été possible de déterminer la lignée ni le profil génétique de M. maurini décrits par Comps et al. (1981 (1982)) à partir de moules de la mer Adriatique, et en raison de la présence de plusieurs variantes génotypiques liées à M. refringens, Kerr et al. (2018) ont nommé Marteilia pararefringens la lignée qu'ils ont caractérisée à partir des M. edulis de l'Europe du Nord (communications personnelles, M. David Bass, Pathology and Molecular Systematics, Cefas, Weymouth, R.-U.). Ils ont également décrit un moyen de distinguer M. refringens et M. pararefringens à partir d'un essai de diagnostic moléculaire précis (Kerr et al. 2018).
Répartition géographique
La confusion quant à l'identité précise du parasite Marteilia détecté chez les moules en Europe rend difficile l'établissement de rapports sur la répartition des différents isolats et des diverses espèces. Dans l'ensemble de l'Europe, des infections par Marteilia spp. ont été recensées chez de nombreuses espèces de mollusques dans une zone s'étendant le long des côtes atlantiques de l'Europe, de la mer Baltique (Suède) en passant par la côte sud de l'Angleterre jusqu'au Maroc, y compris la Bretagne (France), la Galice (Espagne) et le Portugal, et dans la mer Méditerranée (Le Roux et al. 2001, Berthe et al. 2004, Lopez-Flores et al. 2004, Novoa et al. 2005, Engelsma et Hine 2009, Carrasco et al. 2015, Guo et Ford 2016, Alfjorden et al. 2017). Voici d'autres détails et références se rapportant à la répartition géographique de Marteilia spp. chez les moules triées selon l'espèce hôte, l'identité du parasite et l'emplacement, du nord au sud dans l'Atlantique et de l'ouest à l'est dans la mer Méditerranée. Chez les Mytilus edulis, le parasite nommé M. refringens a été signalé dans la mer Baltique (Suède) (OIE 2010, référence 8982 du rapport sur les Mytilus edulis 25/01/2012, Suède), en Bretagne côtière (France) (Comps et al. 1975, Tige et Rabouin 1976, Mialhe et al. 1985, Berthe et al. 2000) et dans la Ria de Arousa (Espagne) (Gutierrez 1977,Perez Camacho et al. 1997). Le parasite nommé M. maurini a été signalé chez les M. edulis dans le nord de la Bretagne (France) (Auffret et Poder 1983 [1985]). Toujours chez les M. edulis, le parasite Marteilia sp. a été isolé par Robledo et al. (1994a) et un parasite s'apparentant à Marteilia a été détecté en Chine (Wang et al. 2012). Le parasite Marteilia pararefringens a été décrit chez les M. edulis de Bømlo, dans l'ouest de la Norvège, de la côte nord-ouest de la Suède; et de l'estuaire de Tamar, dans le sud de l'Angleterre, au Royaume-Uni (Kerr et al. 2018). L'analyse en phylogénie bayésienne de la séquence du gène de l'ADNr pleine longueur (c.-à-d. le gène ribosomique 18S-ITS1-5.8S-ITS2-28S-IGS complet) a permis de regrouper les séquences du parasite Marteilia refringens (type M) chez les M. edulis du Royaume-Uni et de la France avec celles du parasite M. pararefringens (Kerr et al. 2018).
Chez les Mytilus galloprovincialis, le parasite nommé M. refringens a été signalé en Galice (Espagne) (Villalba et al. 1993a,b 1997, Robledo et al. 1994b 1995a; Robledo et Figueras 1995, Fuentes et al. 1995, 2002, Perez Camacho et al. 1997, Carballal et al. 1998, Darriba Couñago, 2017) et sur les côtes méditerranéennes en Espagne, dans le delta de l'Èbre (Carrasco et al. 2007b, 2008c), et en France, dans l'étang de Thau (Boyer et al. 2013). Le parasite indiqué comme étant M. refringens de type M a été signalé sur la côte ouest de l'Espagne (López-Flores et al. 2004, Novoa et al. 2005) et sur les côtes méditerranéennes de l'Espagne, dans le delta de l'Ebre (Carrasco et al. 2017), en Italie, sur la côte ouest (Balseiro et al. 2007, Carella et al. 2010) et dans la mer Adriatique (Gombač et al. 2013, Arzul et al. 2014). Le parasite nommé M. maurini a été signalé chez les M. galloprovincialis de la mer Adriatique (Comps et al. 1981 [1982] 1982, Ceschia et al. 1992) et il a été indiqué comme étant « peut-être le parasite M. maurini », ou le parasite « M. maurini (ou de type M) » en Galice (Espagne) (Figueras et al. 1991, Figueras et Robledo 1993), et dans le delta de l'Èbre, en Espagne (Carrasco et al. 2007a, 2008b). Le parasite Marteilia refringens ou maurini a été signalé chez les M. galloprovincialis du golfe Thermaïque, en mer Égée, dans le nord de la Grèce (Rayyan et al. 2006). Des espèces de Marteilia sp. non identifiées ont été signalées en Galice (Espagne) (Pernas et al. 2000), sur la côte sud de l'Italie (Tiscar et al. 1993), dans la mer Adriatique (Zrnčić et al. 2001, Pellumb et al. 2006), et dans la mer Égée (Virvilis et al. 2003, Karagiannis et Angelidis 2007, Anestis et al. 2010). Les analyses de phylogénie bayésienne ou de phylogénie à probabilité maximale de la séquence du gène de l'ADNr pleine longueur (c.-à-d. le gène ribosomique 18S-ITS1-5.8S-ITS2-28S-IGS complet) ont permis de grouper les séquences du parasite Marteilia refringens (de type M) chez les M. galloprovincialis de France, d'Espagne et d'Italie avec celles du parasite M. pararefringens (Kerr et al. 2018).
Wang et al. (2012) ont signalé la présence d'un organisme s'apparentant à Marteilia-dans la glande digestive de 2,8 % des Mytilus edulis de la côte est de la Chine. La séquence génétique du produit de la paire de bases 641 résultant de l'amplification par PCR d'un fragment du gène de l'ARN ribosomique 18S de ce parasite à l'aide d'amorces décrites par Le Roux et al. (1999) était similaire à 88 % à celle de Marteilia refringens (Wang et al. 2012) et est probablement différente du parasite Marteilia spp. présent dans les moules d'Europe (Carrasco et al. 2015).
Espèces hôtes
Le parasite Marteilia maurini a été décrit à l'origine chez les Mytilus galloprovincialis (Comps et al. 1981 [1982] 1982) et il a été plus tard signalé chez les Mytilus edulis (Auffret et Poder 1983 [1985]), mais comme cela a été mentionné plus haut, la validité de cette espèce est maintenant remise en question. Cependant, en plus des moules, M. refringens / maurini / pararefringens et Marteilia sp. ont été signalés chez les huîtres, probablement les palourdes et les coques, les pétoncles et d'autres bivalves (Berthe et al. 2004, Engelsma et Hine 2009, Carrasco et al. 2015, Guo et Ford 2016, Alfjorden et al. 2017). Également signalée récemment chez une moule pygmée noire, Xenostrobus securis, une espèce invasive non indigène dans la Ria de Vigo, en Galice [Espagne], où elle cohabite avec M. galloprovincialis infectée (Pascual et al. 2010). Auffret et Poder (1983 [1985]) ont mentionné un rapport non publié sur la moule geante (Modiolus modiolus) de la côte atlantique de l'Europe. Le parasite Marteilia pararefringens a été décrit à partir des Mytilus edulis et a également été détecté chez les Ostrea edulis (Kerr et al. 2018).
Impact sur les hôtes
Ce parasite est considéré comme un pathogène potentiellement létal, mais la marteiliose ne nuit généralement pas aux moules. Par exemple, parmi les 1 280 moules Mytilus galloprovincialis adultes élevées et sauvages recueillies au cours d'une période de surveillance d'un an dans la mer Adriatique slovène, 0,3 % étaient infectées uniquement par le parasite Marteilia refringens de type M et seule une perturbation sporadique des cellules épithéliales des tubules digestifs et une destruction focale des tubules digestifs ont été observées (Gombeč et al. 2014). Tige et Rabouin (1976) n'ont détecté le parasite M. refringens que chez 1,4 % de 703 M. edulis de l'embouchure de la rivière Penzé, en Bretagne (France) où 80 à 100 % des huîtres plates ont été infectées. Auffret et Poder (1983 [1985]) ont signalé que les effets du parasite Marteilia maurini sur les M. edulis étaient variables, mais qu'ils pouvaient être discrets. Robledo et Figueras (1995) ont suggéré que le taux de mortalité des M. galloprovincialis par rapport à la prévalence de l'infection pourrait s'expliquer par une élimination du parasite par les mécanismes de défense des moules plutôt que par la mort des moules infectées. En Angleterre, en Norvège et en Suède, aucune mortalité significative des moules n'est survenue malgré une prévalence globale de 9 % environ de M. pararefringens dans ces pays (Kerr et al. 2018). Berthe (2002) a indiqué que les moules (M. edulis et M. galloprovincialis) provenant de zones enzootiques étaient vulnérables aux infections, mais qu'elles n'étaient pas touchées par le parasite M. refringens/maurini (tolérance à celui-ci) peut-être parce que les moules, associées depuis longtemps au parasite M. refringens, avaient trouvé une relation hôte-parasite équilibrée qui permettait de maintenir le niveau de prévalence parasitaire bas et des mortalités associées réduites ou de le rendre nul. Les moules ayant tendance à présenter des niveaux d'infection par ce parasite relativement faibles par rapport aux huîtres, Guo et Ford (2016) ont suggéré la possibilité que les moules jouent le rôle d'un hôte alternatif ou d'hôte réservoir pour le parasite des huîtres dans les zones où les deux mollusques sont élevés. Cette suggestion est contraire aux résultats expérimentaux de Figueras et Robledo (1993) qui n'ont détecté aucune transmission entre les moules Mytilus galloprovincialis infectées et les huîtres Ostrea edulis non infectées et élevées pendant deux ans sur le même radeau dans la Ría de Vigo, en Galice (Espagne). Il reste à déterminer si les moules jouent un rôle dans la transmission du parasite aux huîtres (CIEM 2012).
Cependant, dans certaines régions, la mortalité attribuée à ce parasite est considérable pour l'industrie de la mytiliculture. Berthe et al. (2004) ont signalé que les M. edulis naïves provenant d'une région exempte de Marteilia spp. ont connu des mortalités massives lors de leur transfert dans la région enzootique. Par exemple, des mortalités de moules (jusqu'à 100 %) associées à une infection grave par M. refringens / maurini ont été signalées par le passé en France chez des M. edulis achetées dans les pays d'Europe du Nord pour un reparcage en France. Ces moules n'avaient pas eu de contact préalable à M. refringens / maurini et étaient probablement très sensibles à la maladie (Arzul 2011, Carrasco et al. 2015). Par ailleurs, Fuentes et al. (2002) ont signalé que des croisements hybrides entre M. edulis et M. galloprovincialis étaient plus fortement parasités que trois stocks de M. galloprovincialis élevés pendant un an sous un radeau commercial au nord-ouest de l'Espagne. La prévalence moyenne de l'infection chez des M. galloprovincialis provenant de cinq rías en Galice, au nord-ouest de l'Espagne, a atteint 35 % entre 1985 et 1989 (Figueras et al. 1991, Villalba et al. 1997). Virvilis et al. (2003) ont suggéré que l'augmentation de la mortalité des M. galloprovincialis pendant l'été pouvait être attribuée à la présence du parasite Marteilia sp. dans le golfe Thermaïque, dans le nord de la Grèce.
Figueras et al. (1991), Villalba et al. (1997), Rayyan et al. (2006) et Anestis et al. (2010) ont remarqué que l'infection des moules par M. refringens / maurini était associée à l'infiltration d'hémocytes de la glande digestive (tissu conjonctif et épithéliums) et que les infections graves entraînaient une destruction importante de la glande digestive. La perturbation pathologique des épithéliums des tubules de la glande digestive était la plus grave au moment de la libération des spores par le sporange (Robledo et Figueras 1995). Les infections importantes causaient également une réduction de l'efficacité de l'absorption, ce qui entraînait une inhibition du développement des gonades et des parenchymes, et ainsi une diminution considérable de la santé des moules infectées (Villalba et al. 1993b, Robledo et al. 1995a, Pérez Camacho et al. 1997, Anestis et al. 2010). Les M. galloprovincialis infectées présentaient également des concentrations totales d'hydrates de carbone inférieures dans l'hémolymphe (Robledo et al. 1995a) et une augmentation considérable des hémocytes circulants, en particulier les hyalinocytes (Carballal et al. 1998), par rapport aux moules non infectées. l'infection provoque généralement une réaction hémocytique qui pourrait ralentir et parfois même arrêter l'infection. L'association entre la mortalité des moules et ce parasite a été suggérée dans certains endroits (Villalba et al. 1993a). Anestis et al. (2010) ont déterminé que par rapport aux moules M. galloprovincialis non infectées, les valeurs des possibilités de croissance chez les moules infectées étaient beaucoup plus faibles (P ˂ 0,05), avec le degré de réduction des possibilités de croissance dépendant de l'intensité de l'infection par Marteilia sp. Ces différences ont été attribuées au taux de filtration plus élevé et à l'efficacité d'absorption plus faible détectés chez les moules infectées (Anestis et al. 2010). En Chine, Wang et al.(2012) ont signalé que les moules M. edulis infectées étaient émaciées. Cependant, un examen plus approfondi est nécessaire pour mieux comprendre l'effet pathologique du parasite sur l'hôte en Chine (Carrasco et al. 2015).
Le cycle de vie complet de Marteilia refringens ou maurini n'a pas été entièrement décrit (Engelsma et Hine 2009). Bien que Comps et Joly (1980) aient été capables d'infecter des moules (Mytilus galloprovincialis) avec M. refringens extrait d'huîtres (Ostrea edulis), Berthe et al. (1998, 2004) a défendu l'hypothèse que des hôtes intermédiaires ou d'autres hôtes (inconnus), ou des stades libres (également inconnus) étaient essentiels dans le cycle de vie de ce parasite. La recherche sur les hôtes intermédiaires potentiels dans les bassins ostréicoles français en eau peu profonde (« claires »), où la diversité des espèces est relativement limitée, a mené à la détection de l'ADN de M. refringens dans divers invertébrés, la possibilité la plus prometteuse étant le copépode calanoïde Paracartia (= Acartia) grani (Audemard et al. 2001, 2002). Boyer et al. (2013) ont soutenu l'hypothèse de la transmission du parasite M. refringens des M. galloprovincialis aux P. grani et Arzul et al. (2014) ont détecté M. refringens (par hybridation in situ) dans le tissu gonadique des femelles Paracartia latisetosa de l'étang de Diane, en Corse, après la prévalence de pointe observée chez les moules (M. galloprovincialis).
Bien que P. grani ait pu être infectée par M. refringens ou maurini provenant des deux huîtres (O. edulis) et des moules (M. galloprovincialis), les essais de transmission de M. refringens provenant de P. grani vers O. edulis et les moules (Mytilus edulis) ont été vains (Audemard et al. 2002, Carrasco et al. 2008a). De plus, Carrasco et al. (2008a) ont révélé que les modes d'infection de M. refringens ou maurini chez les P. grani étaient différents de ceux des copépodes infectés par des M. galloprovincialis ou O. edulis, et seules les premières étapes de l'infection ont été observées dans le tractus intestinal des P. grani infectées par des moules, par rapport à une plus haute prévalence et intensité des infections dans le tractus intestinal et la gonade des P. grani infectées par des huîtres. Cependant, Boyer et al. (2013) ont observé des cellules inhabituelles de M. refringens dans le tube digestif et les gonades à partir du troisième stade copépodite de P. grani et ils ont suggéré que le parasite pourrait infecter un copépode par ingestion, puis qu'il pourrait être libéré par les gonades. Cette hypothèse a été soutenu par la détection par réaction en chaîne de la polymérase de l'ADN du parasite dans les œufs de copépodes femelles positifs aux essais de réaction en chaîne de la polymérase, ce qui laisse entendre que les œufs de P. grani pourraient contribuer à la propagation du parasite dans l'eau et permettre à M. refringens d'hiverner. De plus, les résultats expérimentaux ont montré que tous les stades copépodites de P. grani pouvaient contribuer à la transmission de M. refringens, en particulier les œufs et les nauplius, car ils étaient conservés jusqu'à 90 % par les M. galloprovincialis (Boyer et al. 2013).
Carrasco et al. (2007a, b, 2008b) ont détecté de l'ADN de M. refringens dans d'autres copépodes (3 calanoïdes, Acartia discaudata, A. clausi et A. italica; 1 cyclopidé, Oithona sp.; et au moins 1 harpacticoïde, Euterpina acutifrons et une espèce d'harpacticoïde non identifiée) et dans les stades larvaires des crustacés décapodes (larves zoés de Brachyura, probablement Portumnus sp.) des baies naturelles du delta de l'Èbre (nord-ouest de la mer méditerranéenne, Espagne) où la moule est le principal mollusque élevé. Burreson (2008) a indiqué que l'essai de réaction en chaîne de la polymérase utilisé par Carrasco et al. (2007a, b) n'a pas été validé pour détecter Marteilia spp. Les résultats se rapportant uniquement à l'essai de réaction en chaîne de la polymérase provenant d'essais non validés n'ayant pas été confirmés par histologie, donc ils devraient être interprétés avec prudence et la contribution de ces organismes au cycle vital des parasites M. refringens ou maurini reste à établir.
Les stades de développement de Marteilia spp. chez les bivalves ont été décrits par Grizel et al. (1974), Perkins (1976) et Kleeman et al. (2002a), puis résumés par Bower (2006) comme suit. Dans tous les cas de Marteilia spp., les infections commencent vraisemblablement à partir d'une cellule primaire ou d'une cellule souche (de 5 à 8 μm de diamètre) parmi les cellules épithéliales de l'intestin ou des branchies. Carrasco et al. (2008c) a détecté des infections initiales (précoces) dans les branchies et l'épithélium du manteau de M. galloprovincialis à l'aide de la technique d'hybridation in situ. La cellule primaire uninucléée développe une cellule fille secondaire uninucléée dans une vacuole de son cytoplasme. La cellule fille se divise par fission binaire et produit quatre cellules filles au sein de la cellule primaire (souche) élargie, et dans chaque cellule fille une cellule uninucléée se produit par clivage interne. La cellule primaire dégénère et libère les cellules filles, qui deviennent à leur tour de nouvelles cellules primaires. Dans l'intestin, le parasite pénètre la membrane basale des tubules de la glande digestive et s'établit sous la forme de cellules nourricières à la base des cellules épithéliales. Les cellules nourricières contenant des cellules filles prolifèrent et finissent par se dégrader. Les cellules filles des tubules de la glande digestive deviennent des sporangiosorus appelés « cellules primaires » par Perkins et Wolf (1976), et pansporoblastes par Mialhe et al. (1985). La sporulation se produit dans le sporangiosorus par l'intermédiaire d'un processus de clivages internes (endosporulation) qui produit des cellules à l'intérieur de cellules (fig. 1). Au début de la sporulation, des segments uninucléés sont délimités au sein du cytoplasme du sporangiosorus et forment les primordiums des sporanges (cellules secondaires). Finalement, de 8 à 16 primordiums des sporanges (d'environ 12 μm de diamètre chacun à maturité) se forment au sein du sporangiosorus qui retient son noyau et gonfle jusqu'à atteindre 30 μm de diamètre. Chaque primordium des sporanges devient un sporonte contenant de 2 à 4 primordiums de spores (cellules tertiaires) qui deviennent à leur tour des spores (fig. 1). Chaque spore contient 3 sporoplasmes uninucléés répartis selon leur taille, chacun étant entouré du cytoplasme contenu dans les sporoplasmes de taille plus importante (c.-à-d. clivage interne consécutif de deux sporoplasmes à l'intérieur du primordium de la spore) (Perkins 1976). Une paroi continue de spore sans opercule apparaît autour de chaque spore sphéroïde mature mesurant de 3,5 à 4,5 μm de diamètre. À mesure que la spore grandit, des corps d'inclusion réfractiles et clairs apparaissent dans le cytoplasme du sporonte entourant les spores. Le nom spécifique de M. refringens dérive de ces corps d'inclusion « réfringents ». Les spores matures sont évacuées de la moule à partir de la lumière de la tubule, et les moules infectées peuvent décharger d'importantes quantités de spores avant de mourir.
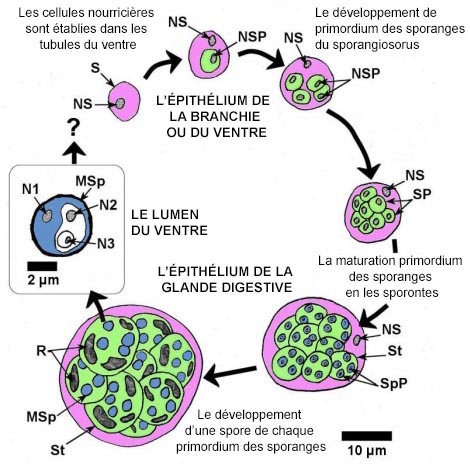
L'image a été modifiée par rapport à l'original pour la traduction française.
Figure 1. Schéma à l'échelle des différentes étapes du processus de sporulation de Marteilia spp. avec le cytoplasme, en couleur pour faciliter la compréhension. S = sporangiosorus (ou cellule primaire, cytoplasme rose), NS = noyau du sporangiosorus, SP = primordium des sporanges qui se transforme en sporonte (cellule secondaire, cytoplasme vert), NSP = noyau du primordium des sporanges, St = sporonte, SpP = primordium des spores qui se transforme en spore (cellule tertiaire, cytoplasme bleu), MSp = spore mature, R = corps réfringents, N1 = noyau du sporoplasme le plus éloigné, N2 = noyau du sporoplasme du milieu, N3 = le noyau du sporoplasme le plus proche.
Le profil saisonnier de l'infection chez les moules était différent d'un site étudié à l'autre. Par exemple, en Galice et en Catalogne (Espagne) on a observé des prévalences plus élevées de Marteilia spp. chez les M. galloprovincialis en juillet, en août et en septembre, avec des sporulations survenant tout au long de l'année (Villalba et al. 1993a; Carrasco et al. 2007b). Dans l'étang de Thau, en France, les formes sporangiales de M. refringens chez les moules étaient bimodales avec des pics au printemps (avril, mai) et en automne (septembre, octobre) lorsque les températures variaient entre 15,0 et 20,5 °C, ce qui semble indiquer que dans l'étang de Thau, le parasite a deux cycles par an et que les moules libèrent des parasites dans la colonne d'eau pendant ces deux périodes (Boyer et al. 2013).
Techniques de diagnostic
Observations générales
Les signes cliniques comprennent des mollusques morts ou grand ouverts (2 ans ou plus), en particulier lorsque la température est au maximum pour les moules (Carrasco et al. 2007b; OIE 2012). On a signalé une réduction du taux de croissance et une inhibition du développement des gonades chez les moules infectées (Villalba et al. 1993b). Cependant, ces signes cliniques ne sont pas spécifiques de l'infection par le parasite M. refringens ou maurini et pourraient indiquer la présence d'autres infections (Berthe et al. 2004).
Préparations humides
Dans les cas d'infections avancées, on a pu observer des sporanges matures avec des granules réfringents dans les préparations humides de moules présentant des valves bâillantes, de moules récemment mortes ou de fèces de moules malades. Écrasement sur une lame de verre d'une portion de glande digestive ou de fèces provenant de moules suspectées. Les lames sont observées à un grossissement de 400x, et sont susceptibles de révéler des granules réfringents dans les sporanges matures. On considère que le résultat est positif lorsque l'on observe des corps sphériques de taille importante (20-30 μm) contenant des parois sphériques épaisses (spores). Chez les espèces sensibles, dans l'aire de répartition géographique connue de l'infection par M. refringens ou maurini, un résultat positif révèle une infection par ces parasites. Chez d'autres, ou en dehors de l'aire de répartition géographique connue de l'infection par M. refringens ou maurini, un résultat positif révèle une infection par un parasite de type Marteilia qui doit être confirmée par le laboratoire de référence de l'OIE (OIE 2012).
Frottis/Empreintes tissulaires
En cas d'infection avancée, on peut observer des parasites dont les tailles varient de 30 à 40 μm dans les tissus écrasés des glandes digestives de moules présentant des valves bâillantes ou de moules récemment mortes (Carella et al. 2010). Préparer des tissus écrasés des glandes digestives de moules suspectées en faisant sécher les tissus excisés sur du papier absorbant et en plaçant plusieurs préparations sur une lame de verre. Ensuite, les lames séchées à l'air sont fixées dans du méthanol ou de l'éthanol absolu et colorées à l'aide d'une trousse de coloration de frottis sanguins disponible dans le commerce, conformément aux instructions du fabricant (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter). Après le rinçage à l'eau du robinet et le séchage, on place sur chaque lame un couvre-objet à l'aide d'une résine synthétique appropriée. Dans un premier temps, les lames sont observées à un grossissement de 200x, puis sous un film d'huile à un grossissement de 1000×. Il convient de noter que dans la mesure où les infections peuvent être focales et que les étapes initiales et avancées de l'infection ciblent divers tissus, il se peut que les préparations de tissus écrasés ne tiennent pas compte des niveaux d'infection précoces et faibles. On obtient un résultat positif lorsqu'on observe des cellules de 30 à 40 μm de diamètre contenant du cytoplasme basophile, un noyau éosinophile, des auréoles pâles autour de granules de grande taille et très tachetés (réfringents) et, dans les cellules plus grandes, on peut observer des cellules à l'intérieur des structures cellulaires (Grizel et al., 1974, Berthe et al. 2000, Berthe et al. 2004, pour des images en couleur voir Arzul 2011). Chez les espèces sensibles, dans l'aire de répartition géographique connue de l'infection par M. refringens ou maurini, un résultat positif révèle à coup sûr une infection par ces parasites. Chez d'autres, ou en dehors de l'aire de répartition géographique connue de l'infection par M. refringens ou maurini, un résultat positif révèle une infection par un parasite de type Marteilia qui doit être confirmée par le laboratoire de référence de l'OIE (OIE 2012).
Histologie
Les différents stades biologiques du parasite (tels qu'ils sont décrits plus haut) peuvent être observés dans les cellules épithéliales des conduits de la glande digestive (stades basophiles, principalement des cellules nourricières [plasmodes]) et les cellules épithéliales des tubules digestifs (stades acidiphiles, principalement des sporangiosorus à divers stades de développement) (Carella et al. 2010, Darriba Couñago 2017). Les parasites situés dans les conduits majeurs et l'estomac (diamètre moyen de 9,9 µm avec des cellules primaires internes de 4,1 µm environ dans l'axe le plus long) sont légèrement plus gros que ceux qui se trouvent dans les tubules digestifs primaires et secondaires (à savoir 8,4 µm de diamètre en moyenne). Les sporangiosorus, qui contiennent huit primordiums de sporanges (sporocyste), atteignent 19,6 µm de diamètre et chaque primordium de sporange finit par contenir de 3 à 4 spores (diamètre moyen de 2,6 µm). Des granules réfringents apparaissent pendant la sporulation, et leur couleur peut être d'orange foncé à rouge foncé dans les tissus colorés à l'hématoxyline et à l'éosine.

Figure 2. Sporangiosorus à différents stades de développement (flèches) et spores en développement (pointes de flèches) de Marteilia maurini dans l'épithélium du tubule de la glande digestive de Mytilus edulis. Image des coupes histologiques fournies par I. Arzul à partir du laboratoire de référence de l'OIE pour Marteilia refringens. Coloration à l'hématoxyline et à l'éosine.
Microscopie électronique
Seul le sporoplasme externe de la spore contient des haplosporosomes (130-400 × 130-200 nm). Comps et al. (1981) ont indiqué que le parasite M. refringens pouvait être différencié de Marteilia maurini chez les Mytilus galloprovincialis par des différences subtiles dans la forme des haplosporosomes et par l'« existence d'une enveloppe constituée de plusieurs membranes à côté de la paroi des spores ». Toutefois, Auffret et Poder (1983) et Longshaw et al. (2001) ont conclu que ces critères étaient invalides. Les haplosporosomes des Marteilia matures présents dans les huîtres et les moules avaient une forme similaire (sphéroïdes et aplaties), même si celles des moules étaient un peu plus petites, et la morphologie de la paroi des spores variait en fonction de l'état de maturité du parasite. Par contre, les critères ultrastructuraux n'était pas suffisants pour différencier les parasites Marteilia refringens et M. maurini (Arzul et Joly 2011).
Isolement et purification
Mialhe et al. (1985) ont décrit une procédure d'isolement et de purification des Marteilia sp. des huîtres et des moules par l'application de gradients de densité sur un homogénat de glandes digestives gravement infectées. d'autres informations sur l'isolement à divers stades de développement provenant de la glande digestive de M. galloprovincialis sont décrits par Robledo et al. (1995b).
Essai immunologique
Tiscar et al. (1993) ont préparé des anticorps polyclonaux contre Marteilia sp. isolée de Mytilus galloprovincialis provenant du sud de l'Italie, qui ont été utilisés pour marquer clairement le parasite au moyen d'une coloration directe par immunopéroxidase dans le frottis de la glande digestive des moules infectées. Les anticorps monoclonaux provenant de six clones obtenus chez des souris (Balb/c) contre Marteilia sp. provenant de Mytilus edulis en Bretagne (France) étaient spécifiques de Marteilia spp. et provoquaient une réaction croisée avec Marteilia refringens provenant de Mytilus galloprovincialis à Ria de Vigo, en Espagne. Quatre des anticorps monoclonaux ont réagi avec la paroi des spores et deux avec le cytoplasme des spores (Robledo et al. 1994a). Il s'est avéré que ces anticorps monoclonaux produisaient divers résultats lorsqu'ils étaient utilisés dans différents tests immunologiques (Pernas et al. 2000).
Sondes à ADN
La séquence nucléotidique du gène codant l'ARN ribosomique de la petite sous-unité (« ADNr PSU » ou « ADNr 18S ») a été comparée à celle de plusieurs organismes eucaryotes, et des amorces de réaction en chaîne de la polymérase ont été créées (Le Roux et al. 1999). La spécificité du fragment amplifié de Marteilia sp. a été confirmée par le transfert de Southern à l'aide d'une oligosonde. Berthe et al. (2000) ont déclaré que la séquence génétique de l'ADNr de la sous-unité de Marteilia sp. qu'ils ont isolée à partir des O. edulis et M. edulis cueillies dans plusieurs endroits en France était identique. Par conséquent, l'Organisation mondiale de la santé animale recommande l'utilisation d'amorces de PCR ciblant la région de l'espaceur transcrit interne 1 (ITS1) décrit par Le Roux et al. (2001) pour amplifier M. refringens (OIE 2012). Le Roux et al. (2001) et d'autres chercheurs (Novoa et al. 2005, Balseiro et al. 2007) ont soumis le produit de la réaction en chaîne de la polymérase à un polymorphisme de longueur des fragments de restriction (RFLP) avec l'endonucléase HhaI pour différencier les types O et M des isolats de Marteilia sp. Balseiro et al. (2007) ont utilisé ce polymorphisme de longueur des fragments de restriction de la réaction en chaîne de la polymérase (RFLP-PCR) pour analyser Marteilia sp. chez les huîtres et les moules provenant de plusieurs endroits en Europeafin d'appuyer la ressemblance entre M. maurini et M. refringens. Pour le parasite Marteilia des moules et des huîtres échantillonnées sur les côtes atlantiques et méditerranéennes de l'Espagne, Novoa et al. (2005) ont détecté le type O chez les M. galloprovincialis et les types M chez les O. edulis et ils ont utilisé la phylogénie estimée pour indiquer que certains types « O » étaient devenus des types « M » et inversement. Gombač et al. (2013) ont souligné la nécessité d'un séquençage pour compléter l'analyse établie du RFLP-PCR pour la caractérisation correcte du parasite. Carrasco et al. (2017) ont mis au point un essai de la réaction en chaîne de la polymérase performant et en temps réel basé sur l'ITS1 du parasite M. refringens pour la détection rapide et sensible de M. refringens qui différenciait les génotypes « M » et « O » de M. refringens et du parasite étroitement apparenté M. cochillia. Cet essai de la réaction en chaîne de la polymérase en temps réel s'est révélé être sensible et précis sur le plan de l'analyse et sa répétabilité et son efficacité sont élevées (Carrasco et al. 2017).
Outre l'analyse de la région de l'ITS1, une analyse de PCR (à plusieurs critères de classification seulement avec M. refringens provenant d'huîtres O. edulis de Huelva, au sud-ouest de l'Espagne, et de M. galloprovincialis aussi de Huelva, au sud-ouest de l'Espagne et de deux emplacements au nord-ouest de l'Italie), a été mise au point à l'aide d'amorces ciblant l'espaceur intergénique IGS de l'ADNr (López-Flores et al. 2004). Cette analyse s'est révélée plus sensible que la PCR ciblant l'ITS1, mais des analyses plus approfondies doivent être effectuées pour évaluer la spécificité (OIE 2012). Kerr et al. (2018) ont décrit les amorces de réaction en chaîne de la polymérase par amorces incluses pour le diagnostic qui amplifient une région de 1 034 paires de bases de l'extrémité 3' de la région V9 du gène de l'ARNr 18S au gène de l'ARNr 5.8S qui s'étend sur toute la région ITS1. La séquence des régions du produit permet de différencier M. refringens et M. pararefringens (Kerr et al. 2018). Puisque l'infection peut être focale et parce qu'elle cible différents tissus aux étapes initiales et avancées du développement du parasite, la sensibilité de la détection par PCR peut être inférieure au résultat de PCR prévu théoriquement. Une réaction PCR par amorces incluses qui utilise des sondes placées dans des endroits inconnus dans le génome a été mise au point pour le diagnostic de M. refringens chez les Mytilus galloprovincialis de Galice, en Espagne et cet essai s'est révélé être plus sensible pour détecter Marteilia dans 20 moules que les frottis et l'histologie (Pernas et al. 2001). On peut trouver des séquences qui présentent les régions de l'ADNr dans des banques de gènes publiques.
Des protocoles d'hybridation in situ (ISH) ont été mis au point et publiés (Le Roux et al. 1999, Berthe et al. 2000). L'Organisation mondiale de la santé animale recommande la mise en place de sondes ciblant la sous-unité du gène ADNr et qui ont été validées par rapport à l'histologie (Le Roux et al. 1999, Thébault et al. 2005) (OIE 2012). Cependant, on a observé que la sonde, nommée Smart 2, réagit avec les parasites Marteilia sydneyi et Marteilioïdes chungmuensis (Kleeman et al. 2002b). Toutefois, Zrnčić et al. (2001) ont utilisé cette sonde pour détecter Marteillia sp. chez Mytilus galloprovincialis en Croatie, et Carrasco et al. (2008c) l'ont utilisée pour détecter les stades infectieux initiaux de M. refringens dans l'épithélium des branchies, du manteau, de l'estomac et des tubules digestifs primaires chez les M. galloprovincialis. De plus, un essai d'hybridation in situ a été mis au point grâce à une sonde ciblant l'espaceur intergénique (IGS) de l'ADNr (López-Flores 2008a, 2008b). Cet essai semblait plus précis que l'hybridation in situ portant sur la sous-unité, mais il doit encore faire l'objet d'une validation approfondie. L'hybridation in situ peut aider à détecter des infections précoces, qui sont plus difficiles à détecter à partir de coupes histologiques traditionnelles (Arzul 2011).
Méthodes de contrôle
Les moules provenant de zones infectées connues (actuellement ou par le passé) ne doivent pas être transférées vers des zones où aucune trace de M. refringens ou maurini n'a été détectée à moins qu'une analyse appropriée est effectuée pour estimer le risque d'introduction du parasite incluant les aspects des pratiques culturelles et la connaissance du cycle vital du parasite (Balseiro et al. 2007). Les moules provenant de régions où l'on sait que Ostrea edulis est porteuse de Marteilia refringens devraient être traitées avec une précaution semblable. Carella et al. (2010) ont suggéré que M. refringens de type M pourrait avoir été importé sur la côte campanienne (mer Tyrrhénienne, sud de l'Italie) avec une transplantation récente d'une semence de la moule M. galloprovincialis.
Les pratiques aquacoles dans différentes régions ont permis de déterminer diverses procédures pour régler le problème de la marteiliose chez les moules. Par exemple, les moules provenant de la partie intérieure de deux rías en Galice (Espagne) et celles qui sont maintenues à une profondeur inférieure (2 m au lieu de 5 m) dans une ría avaient une prévalence moyenne supérieure de l'infection. Ainsi, les radeaux de culture situés dans les zones extérieures des rías contribuent à la limitation de l'impact de ce parasite sur l'industrie de la mytiliculture en Galice (Fuentes et al. 1995, Villalba et al. 1997). Dans le golfe Thermaïque, la prévalence de Marteilia sp. était considérablement plus élevée chez les moules élevées sur des tables que chez celles qui sont élevées sur des filières (Karagiannis et Angelidis 2007). De plus, des températures de l'eau supérieures à 25 ºC pendant de longues périodes ont nui aux Mytilus galloprovincialis, en particulier lorsqu'elles étaient infectées par Marteilia sp. (Anestis et al. 2010). Robledo et al. (1994b) ont suggéré que la collecte des naissains de moules provenant de régions exemptes de Marteilia sp. pourrait contribuer à réduire la prévalence du parasite dans les stocks d'élevage.
Références
- Alfjorden, A., M. Areskog, D. Bruno, R. Carnegie, D. Cheslett, S. Feist, S. Ford, S. Jones, A. Lillehaug, L. Madsen, T. Renault, N. Ruane et P. Vennerström. 2017. New Trends in Important Diseases Affecting the Culture of Fish and Molluscs in the ICES Area 2002 – 2015. In: Anderson, E.D., N. Ruane, R. Carnegie (eds.) ICES Cooperative Research Report No. 337, International Council for the Exploration of the Sea, Conseil International pour l'Exploration de la Mer, Copenhagen, Denmark. 50 pp.
- Anestis, A., H.O. Pörtner, D. Karagiannis, P. Angelidis, A. Staikou et B. Michaelidis. 2010. Response of Mytilus galloprovincialis (L.) to increasing seawater temperature and to marteliosis: Metabolic and physiological parameters. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 156: 57-66.
- Arzul, I. 2011. EURL (European Union Reference Laboratory) for Molluscs Diseases: Marteilia refringens..
- Arzul, I., B. Chollet, S. Boyer, D. Bonnet, J. Gaillard, Y. Baldi, M. Robert, J.-P. Joly, C. Garcia et M. Bouchoucha. 2014. Contribution to the understanding of the cycle of the protozoan parasite Marteilia refringens. Parasitology 141: 227-240.
- Audemard, C., A. Barnaud, C.M. Collins, F. Le Roux, P.-G. Sauriau, C. Coustau, P. Blachier et F.C.J. Berthe. 2001. Claire ponds as an experimental model for Marteilia refringens life-cycle studies: new perspectives. Journal of Experimental Marine Biology and Ecology 257: 87-108.
- Audemard, C., F. Le Roux, A. Barnaud, C. Collins, B. Sautour, P.-G. Sauriau, X. De Montaudouin, C. Coustau, C. Combes et F. Berthe. 2002. Needle in a haystack: involvement of the copepod Paracartia grani in the life-cycle of the oyster pathogen Marteilia refringens. Parasitology 124: 315-323.
- Auffret, M. et M. Poder. 1983 (1985). Recherches sur Marteilia maurini, parasite de Mytilus edulis sur les cotes de Bretagne nord. (Studies on Marteilia maurini, parasite of Mytilus edulis from the north coasts of Brittany). Revue des Travaux de l'Institut des Pêches Maritimes. 47: 105-109.
- Balseiro, P., A. Montes, G. Ceschia, C. Gestal, B. Novoa et A. Figueras. 2007. Molecular epizootiology of the European Marteilia spp., infecting mussels (Mytilus galloprovincialis and M. edulis) and oysters (Ostrea edulis): an update. Bulletin of the European Association of Fish Pathologists 27: 148-156.
- Berthe, F.C.J. 2002. Pacem in terris pathogenibus bonae voluntatis: mollusc-pathogens relationships prospects. Bulletin of the European Association of Fish Pathologists 22: 52-57.
- Berthe, F.C., M. Pernas, M. Zerabib, P. Haffner, A. Thébault et A.J. Figueras. 1998. Experimental transmission of Marteilia refringens with special consideration of its life cycle. Diseases of Aquatic Organisms 34: 135-144.
- Berthe, F.C.J., F. Le Roux, E. Peyretaillade, P. Peyret, D. Rodriguez, M. Gouy et C.P. Vivarès. 2000. Phylogenetic analysis of the small subunit ribosomal RNA of Marteilia refringens validates the existence of Phylum Paramyxea (Desportes and Perkins 1990). The Journal of Eukaryotic Microbiology 47: 288-293.
- Berthe, F.C.J., F. Le Roux, R.D. Adlard et A. Figueras. 2004. Marteiliosis in molluscs: A review. Aquatic Living Resources 17: 433-448.
- Bower, S.M. 1992. Diseases and parasites in mussels. In: E. Gosling (ed.) The Mussel Mytilus: Ecology, Physiology, Genetics and Culture. Elsevier Press, Amsterdam, p. 543-563.
- Bower, S.M. 2006. Parasitic diseases of shellfish. In: Woo, P.T.K. (ed.) Fish Diseases and Disorders, Volume 1: Protozoa and Metazoan Infections, Second Edition, CABI, Wallingford. pp. 629-677.
- Bower, S.M. et A.J. Figueras. 1989. Infectious diseases of mussels, especially pertaining to mussel transplantation. World Aquaculture 20(4): 89-93.
- Boyer, S., B. Chollet, D. Bonnet et I. Arzul. 2013. New evidence for the involvement of Paracartia grani (Copepoda, Calanoida) in the life cycle of Marteilia refringens (Paramyxea). International Journal for Parasitology 43: 1089-1099.
- Burreson, E.M. 2008. Misuse of PCR assay for diagnosis of mollusc protistan infections. Diseases of Aquatic Organisms 80: 81-83.
- Cavalier-Smith, T. et E.E.Y. Chao. 2003. Phylogeny and Classification of Phylum Cercozoa (Protozoa). Protist 154: 341-358.
- Carballal, M.J., A. Villalba et C. López. 1998. Seasonal variation and effects of age, food availability, size, gonad development, and parasitism on the hemogram of Mytilus edulis. Journal of Invertebrate Pathology 72: 304-312.
- Carella, F., S. Aceto, R. Marrone, P. Maiolino et G. De Vico. 2010. Marteilia refringens infection in cultured and natural beds of mussels (Mytilus galloprovincialis) along the Campanian coast (Tirrenian Sea, South of Italy). Bulletin of the European Association of Fish Pathologists 30: 189-196.
- Carrasco, N., I. López-Flores, M. Alcaraz, M.D. Furones, F.C.J. Berthe et I. Arzul. 2007a. First record of a Marteilia parasite (Paramyxea) in zooplankton populations from a natural estuarine environment. Aquaculture 269: 63-70.
- Carrasco, N., I. López-Flores, M. Alcaraz, M.D. Furones, F.C.J. Berthe et I. Arzul. 2007b. Dynamics of the parasite Marteilia refringens (Paramyxea) in Mytilus galloprovincialis and zooplankton populations in Alfacs Bay (Catalonia, Spain). Parasitology 134: 1541-1550.
- Carrasco, N., I. Arzul, B. Chollet, M. Robert, J.P. Joly, M.D. Furones et F.C.J. Berthe. 2008a. Comparative experimental infection of the copepod Paracartia grani with Marteilia refringens and Marteilia maurini. Journal of Fish Diseases 31: 497-504.
- Carrasco, N., I. Arzul, F.C.J. Berthe, M. Fernández-Tejedor, M. Durfort et M.D. Furones. 2008b. Delta de l'Ebre is a natural bay model for Marteilia spp. (Paramyxea) dynamics and life-cycle. Diseases of Aquatic Organisms 79: 65-73.
- Carrasco, N., I. Arzul, F.C.J. Berthe et M.D. Furones. 2008c.In situ hybridization detection of initial infective stages of Marteilia refringens (Paramyxea) in its host Mytilus galloprovincialis. Journal of Fish Diseases 31: 153-157.
- Carrasco, N., T.J. Green et N. Itoh. 2015. Marteilia spp. parasites in bivalves: A revision of recent studies. Journal of Invertebrate Pathology 131: 43-57.
- Carrasco, N., M. Voorbergen-Laarman, B. Lacuesta, D. Furones et M.Y. Engelsma. 2017. Application of a competitive real time PCR for detection of Marteilia refringens genotype “O” and “M” in two geographical locations: the Ebro Delta, Spain and the Rhine-Meuse Delta, the Netherlands. Journal of Invertebrate Pathology 149: 51-55.
- Ceschia, G., A. Mion, G. Orel et G. Giorgetti. 1992. Indagine parassitologica delle mitillicolture del Friuli-Venezia Giulia (Nord-Est Italia). Parasitological research in mussel cultures of Friuli-Venezia Giulia (North-East Italy). Bollettino Societa Italiana di Patologia Ittica 9: 24-36. (In Italian with English summary).
- Comps, M. et J.P. Joly. 1980. Contamination expérimentale de Mytilus galloprovincialis Lmk par Marteilia refringens. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 301: 19-21. (In French).
- Comps, M., H. Grizel, G. Tige‚ et J.L. Duthoit. 1975. Parasites nouveaux de la glande digestive des mollusques marins Mytilus edulis L. et Cardium edule L. (New parasites in the digestive gland of Mytilus edulis L. and Cardium edule L.). Comptes Rendus Académie des Sciences de Paris, Série D 281: 179-181.
- Comps, M., Y. Pichot et P. Papagianni. 1981. Recherche sur Marteilia maurini n. sp. parasite de la moule Mytilus galloprovincialis Lmk.(Revue des Travaux de l'Institut des Pêches Maritimes 45: 211-214.
- Comps, M., H. Grizel et Y. Papayanni.1982. Infection parasitaire causée par Marteilia maurini sp. n. chez la moule Mytilus galloprovincialis. International Council for Exploration of the Sea C.M. 1982/F: 24: 3 pp.
- Darriba Couñago, S. 2017. Atlas de Histopatoloxía, Moluscos bivalvos mariños. Histopathological Atlas, Marine bivalve molluscs Publié par Intecmar. Xunta de Galicia (Consellería do Mar), Edificios administrativos - San Caetano, s/n, Saint-Jacques-de-Compostelle, Espagne. (En espagnol et en anglais).
- Engelsma, M et M. Hine. 2009. Infection with Marteilia refringens: disease detection, pathogen identification and typing. In: Hill, B., A. Reese, P. Dixon, B. Oidtmann, R. Paley, E. Peeler, G. Stentiford, D. Stone, K. Way, M. Hine, P. Calistri, C. Ippoliti, A. Di Lorenzo, L. Savini, O. Haenen and M. Engelsma. 2010. Epidemiology of different agents causing disease in aquatic animals: scientific review and database development (Parma, Italy, European Food Safety Authority (EFSA), 21 p.) Annex B, pp. 55-57.
- Feist, S.W., P.M. Hine, K.S. Bateman, G.D. Stentiford et M. Longshaw. 2009. Paramarteilia canceri sp. n. (Cercozoa) in the European edible crab (Cancer pagurus) with a proposal for the revision of the order Paramyxida Chatton 1911. Folia Parasitologica 56: 73-85.
- Figueras, A. et J.A.F. Robledo. 1993. Does the Marteilia present in mussels (Mytilus galloprovincialis) infect flat oysters (Ostrea edulis)? Bulletin of the European Association of Fish Pathologists 13: 97-99.
- Figueras, A.J. et J. Montes. 1988. Aber disease of edible oysters caused by Marteilia refringens. American Fisheries Society Special Publication 18: 38-46.
- Figueras, A.J., C.F. Jardon et J.R. Caldas. 1991. Diseases and parasites of rafted mussels (Mytilus galloprovincialis Lmk): preliminary results. Aquaculture 99: 17-33.
- Fuentes, J., A. Villalba, C. Zapata et G. Alvarez. 1995. Effects of stock and culture environment on infections by Marteilia refringens and Mytilicola intestinalis in the mussel Mytilus galloprovincialis cultured in Galicia (NW Spain). Diseases of Aquatic Organisms 21: 221-226.
- Fuentes, J., J.L. López, E. Mosquera, J. Vázquez, A. Villalba et G. Alvarez. 2002. Growth, mortality, pathological conditions and protein expression of Mytilus edulis and M. galloprovincialis crosses cultured in the Ría de Arousa (NW of Spain). Aquaculture 213: 233-251.
- Gombač, M., D. Kušar, M. Ocepek, M. Pogačnik, I. Arzul, Y. Couraleau et V. Jenčič. 2013. Marteiliosis in mussels: a rare disease? Journal of Fish Diseases 37: 805-814.
- Grizel, H., M. Comps, J.R. Bonami, F. Cousserans, J.L. Duthoit et M.A. LePennec. 1974. Research on the agent of digestive gland disease of Ostrea edulis Linné. Science et Pêche Bulletin d'Information et de Documentation de l'Institut Scientifique et Technique des Pêches Maritimes 240: 7-30.
- Guo, X. et S.E. Ford. 2016. Infectious diseases of marine molluscs and host responses as revealed by genomic tools. Philosophical Transactions of the Royal Society B: Biological Sciences 371: 20150206.
- Gutiérrez, M. 1977. Nota sobre marteiliasis en el mejillón, Mytilus edulis (L), de la costa Noroeste de España. Investigaciones pesquas 41: 637-642. (En español).
- Karagiannis, D. et P. Angelidis. 2007. Infection of cultured mussels Mytilus galloprovincialis by the protozoan Marteilia sp. in the Thermaikos Gulf (N Greece). Bulletin of the European Association of Fish Pathologists 27: 131-141.
- Kerr, R., G.M. Ward, G.D. Stentiford, A. Alfjorden, S. Mortensen, J.P. Bignell, S.W. Feist, A. Villalba, M.J. Carballal, A. Cao, I. Arzul, D. Ryder et D. Bass. 2018. Marteilia refringens and Marteilia pararefringens sp. nov. are distinct parasites of bivalves and have different European distributions. Parasitologie Publication en ligne : 11 June 2018: pp. 1-10.
- Kleeman, S.N., R.D. Adlard et R.J.G. Lester. 2002a. Detection of the initial infective stages of the protozoan parasite Marteilia sydneyi in Saccostrea glomerata and their development through to sporogenesis. International Journal for Parasitology 32: 767-784.
- Kleeman, S.N., F. Le Roux, F. Berthe et R.D. Adlard. 2002b. Specificity of PCR and in situ hybridization assays designed for detection of Marteilia sydneyi and M. refringens. Parasitology 125: 131-141.
- Le Roux, F., C. Audemard, A. Barnaud et F. Berthe. 1999. DNA Probes as potential tools for the detection of Marteilia refringens. Marine Biotechnology 1: 588-597.
- Le Roux, F., G. Lorenzo, P. Peyret, C. Audemard, A. Figueras, C. Vivarès, M. Gouy et F. Berthe. 2001. Molecular evidence for the existence of two species of Marteilia in Europe. The Journal of Eukaryotic Microbiology 48: 449-454.
- Longshaw, M., S.W. Feist, R.A. Matthews et A. Figueras. 2001. Ultrastructural characterisation of Marteilia species (Paramyxea) from Ostrea edulis, Mytilus edulis and Mytilus galloprovincialis in Europe. Diseases of Aquatic Organisms 44: 137-142.
- López-Flores, I., R. de la Herrán, M.A. Garrido-Ramos, J.I. Navas et M. Ruiz Rejón. 2004. The molecular diagnosis of Marteilia refringens and differentiation between Marteilia strains infecting oysters and mussels based on the rDNA IGS sequence. Parasitology 129: 411-419.
- López-Flores, I., M.A. Garrido-Ramos, R. de la Herran, C. Ruiz-Rejón, M. Ruiz-Rejón et J.I. Navas. 2008a. Identification of Marteilia refringens infecting the razor clam Solen marginatus by PCR and in situ hybridization. Molecular and Cellular Probes 22: 151-155.
- López-Flores, I., F. Robles, J.M. Valencia, A. Grau, A. Villalba, R. de la Herrán, M.A. Garrido-Ramos, C. Ruiz-Rejón, M. Ruiz-Rejón et J.I. Navas. 2008b. Detection of Marteilia refringens using nested PCR and in situ hybridisation in Chamelea gallina from the Balearic Islands (Spain). Diseases of Aquatic Organisms 82: 79-87.
- Mialhe, E., E. Bachère, C. LeBec et H. Grizel. 1985. Isolement et purification de Marteilia (Protozoa: Ascetospora) parasites de bivalves marins. (Isolation and purification of Marteilia (Protozoa: Ascetospora) parasites of marine Bivalvia: ultrastructural study of pansporoblasts.). Compte Rendu Hebdomadaire des Séances de l'Académie des Sciences, Paris. Série III 301: 137-142.
- Novoa, B., D. Posada et A. Figueras. 2005. Polymorphisms in the sequences of Marteilia internal transcribed spacer region of the ribosomal RNA genes (ITS-1) in Spain: genetic types are not related with bivalve hosts. Journal of Fish Diseases 28: 331-338.
- OIE. 2012. Manual of Diagnostic Tests for Aquatic Animals 2017. Chapter 2.4.4. — Infection with Marteilia refringens. Il existe un laboratoire de référence de l'OIE (Organisation mondiale de la santé animale) qui étudie les infections par le parasite Marteilia refringens (consulter le site Internet de l'OIE pour obtenir la liste la plus récente.
- Pascual, S., A. Villalba, E. Abollo, M. Garci, A.F. González, M. Nombela, D. Posada et A. Guerra. 2010. The mussel Xenostrobus securis: a well-established alien invader in the Ria de Vigo (Spain, NE Atlantic). Biological Invasions 12: 2091-2103.
- Pëllumb, A., G. Ceschia et S. Kapllan. 2006. First report of Marteiliosis in Mytilus galloprovincialis in Albania. Ittiopatologia 3: 47-52.
- Pérez Camacho, A., A. Villalba, R. Beiras et U. Labarta. 1997. Absorption efficiency and condition of cultured mussels (Mytilus edulis galloprovincialis Linnaeus) of Galicia (NW Spain) infected by parasites Marteilia refringens Grizel et al. and Mytilicola intestinalis Steuer. Journal of Shellfish Research 16: 77-82.
- Perkins, F.O. 1976. Ultrastructure of sporulation in the European flat oyster pathogen, Marteilia refringens- taxonomic implications. Journal of Protozoology 23: 64-74.
- Pernas, M., B. Novoa, C. Tafalla et A. Figueras. 2000. Efficiency of different monoclonal antibodies in immunological assays developed for the detection of Marteilia sp. isolated from Mytilus galloprovincialis. Bulletin of the European Association of Fish Pathologists 20: 193-198.
- Pernas, M., B. Novoa, F. Berthe, C. Tafalla et A. Figueras. 2001. Molecular methods for the diagnosis of Marteilia refringens. Bulletin of the European Association of Fish Pathologists 21: 200-208.
- Rayyan, A., P. Damianidis, C. Antoniadou et C.C. Chintiroglou. 2006. Protozoan parasites in cultured mussels Mytilus galloprovincialis in the Thermaikos Gulf (north Aegean Sea, Greece). Diseases of Aquatic Organisms 70: 251-254.
- Robledo, J.A.F. et A. Figueras. 1995. The effect of culture-site, depth, season, and stock source on the prevalence of Marteilia refringens in cultured mussels (Mytilus galloprovincialis Lmk.) from Galicia, Spain. The Journal of Parasitology 81: 354-363.
- Robledo, J.A.F., V. Boulo, E. Mialhe, B. Desprès et A. Figueras. 1994a. Monoclonal antibodies against sporangia and spores of Marteilia sp. (Protozoa: Ascetospora). Diseases of Aquatic Organisms 18: 211-216.
- Robledo, J.A.F., J. Cáceres-Martínez et A. Figueras. 1994b. Marteilia refringens in mussel (Mytilus galloprovincialis Lmk.) beds in Spain. Bulletin of the European Association of Fish Pathologists 14: 61-63.
- Robledo, J.A.F., M.M. Santarém, P. González et A. Figueras. 1995a. Seasonal variations in the biochemical composition of the serum of Mytilus galloprovincialis Lmk. and its relationship to the reproductive cycle and parasitic load. Aquaculture 133: 311-322.
- Robledo, J.A.F., E. Mialhe et A. Figueras. 1995b. Purification of several phases of the parasite Marteilia (Protozoa: Ascetospora) from mussels (Mytilus edulis). In: Stolen, J.S., T.C. Fletcher, S.A. Smith, J.T. Zelikoff, S.L. Kaattari, R.S. Anderson, K. Söderhäll, B.A. Weeks-Perkins (eds.). Techniques in Fish Immunology, Immunology and Pathology of Aquatic Invertebrates, Vol. 4 Fish Immunology Technical Communications. SOS Publications, Fair Haven. pp. 117-121.
- Tige, G. et M.A. Rabouin. 1976. Étude d'un lot de moules transférées dans un centre touché par l'épizootie affectant l'huître plate. International Council for Exploration of the Sea C.M.1976/K:21: 10 pp.
- Tiscar, P.G., M. Tempesta et M. Compagnucci. 1993. Peroxidase conjugated polyclonal antibody against Marteilia sp. purified from infected mussels (Mytilus galloprovincialis, Lmk) cultivated in Apulia, southern Italy. Bulletin of the European Association of Fish Pathologists 13: 53-55.
- Villalba, A., S.G. Mourelle, M.C. López, M.J. Carballal et C. Azevedo. 1993a. Marteiliasis affecting cultured mussels Mytilus galloprovincialis of Galicia (NW Spain). I. Etiology, phases of the infection, and temporal and spatial variability in prevalence. Diseases of Aquatic Organisms 16: 61-72.
- Villalba, A., S.G. Mourelle, M.J. Carballal et M.C. López. 1993b. Effects of infection by the protistan parasite Marteilia refringens on the reproduction of cultured mussels Mytilus galloprovincialis in Galicia (NW Spain). Diseases of Aquatic Organisms 17: 205-213.
- Villalba, A., S.G. Mourelle, M.J. Carballal et C. López. 1997. Symbionts and diseases of farmed mussels Mytilus galloprovincialisthroughout the culture process in the Rías of Galicia (NW Spain). Diseases of Aquatic Organisms 31: 127-139.
- Virvilis, C., P. Angelidis et G. Photis. 2003. Presence of the parasite Marteilia sp. in the shellfish of the Thermaikos Gulf in northern Greece. Bulletin of the European Association of Fish Pathologists 23: 157-162.
- Wang, Z., X. Lu, Y. Liang et Z. Zheng. 2012. A Marteilia-like parasite in blue mussels Mytilus edulis in China. Journal of Aquatic Animal Health 24: 161-164.
- Zrnčić, S., F. Le Roux, D. Oraić, B. Šoštarić et F.C.J. Berthe. 2001. First record of Marteillia sp. in mussels Mytilus galloprovincialis in Croatia. Diseases of Aquatic Organisms 44: 143-148.
Information de citation
Bower, S.M. (2019): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Marteilia spp. of Mussels.
Date de la dernière revision: Novembre 2020
Faire parvenir les commentaires à Susan Bower
- Date de modification :