Marteilia sydneyi de l'huître
Sur cette page
Catégorie
Catégorie 3 (pas d'hôte au Canada)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Maladie QX (maladie inconnue du Queensland)
Nom scientifique ou affiliation taxonomique
Le parasite Marteilia sydneyi associé au phylum Paramyxea par le passé (Berth et al. 2000, 2004) est était transféré au phylum Cercozoa, au supergroupe des rhizarias, au groupe des Ascetosporea et à l'ordre des Paramyxida (Cavalier-Smith et Chao 2003, Feist et al. 2009, Ward et al. 2016). L'haplosporidium signalé par Wolf (1972) dans les huîtres de roche de Sydney, Saccostrea (= Crassostrea) glomerata (=commercialis), provenant de la baie de Moreton, au Queensland (Australie), a été nommé M. sydneyi par Perkins et Wolf (1976).
Répartition géographique
Estuaires côtiers du sud du Queensland et de la Nouvelles-Galles du Sud, en Australie (Nell 1993, Adlard et Ernst 1995, Kleeman et al. 2004, Adlard et Wesche 2005), représentant un rayon de 950 km environ (Guo et Ford 2016). L'infection par M. sydneyi a été détectée chez une des 117 huîtres S. glomerata provenant de l'archipel de Dampier, en Australie-Occidentale (Hine et Thorne 2000) et chez une des 411 huîtres prélevées dans la même zone en 1995 (Jones et Creeper 2006). Hine et Thorne (2000) ont aussi détecté un parasite Marteilia sp. chez une des 26 huîtres Saccostrea cucullata provenant des îles Montebello, en Australie-Occidentale. Ils ont indiqué que ce parasite ressemblait à Marteilia lengehi chez l'huître S. cucullata du golfe Persique qui a été décrit par Comps (1976). Un parasite s'apparentant à Marteilia a été signalé chez deux des 29 huîtres Saccostrea forskali prélevées en Thaïlande (Taveekijakarn et al. 2002, 2008). Carrasco et al. (2015) ont suggéré que ce parasite présente des ressemblances morphologiques avec M. sydneyi
Espèces hôtes
Le parasite Marteili sydneyi a été décrit à partir de l'huître Saccostrea glomerata (= Crassostrea) (= commercialis) et il est peut-être aussi présent chez les Saccostrea et les Saccostrea cucullata (= forskali) (Wolf 1977, Kleeman et al. 2002b; Taveekijakarn et al. 2008). Des protistes similaires ont été observés chez Ostrea angasi et dans les populations de palourdes, y compris les palourdes géantes Tridacna maxima. Apparemment, les Crassostrea gigas ne sont pas atteintes de la maladie QX provoquée par l'infection au parasite Marteilia sydneyi (Nell 2001). Adlard et Nolan (2009, 2015) ont détecté, à l'aide d'outils moléculaires, le parasite M. sydneyi dans l'épithélium du tube digestif du ver polychète Nephtys australiensis (Aranguren et Figueras 2016).
Impact sur les hôtes
En règle générale, les huîtres infectées sont en mauvais état, leur gonade étant complètement résorbée. Apparemment, M. sydneyi peut faire mourir jusqu'à 80 % des huîtres infectées, cette prévalence pouvant atteindre 100 % (Wolf 1977, Hines et al. 1996). Selon Nell (1993, 2001, 2002), partout où M. sydneyi a été détecté, l'industrie ostréicole a connu une baisse considérable. Bien que le déclin ait été lent (30 ans) dans certaines régions du nord de la Nouvelles-Galles du Sud, dans la rivière Georges, à Sydney, l'industrie s'est complètement effondrée en 2001, moins de sept ans après la détection initiale de M. sydneyi dans cette zone. Cette maladie représente également une menace pour les autres zones de production de S. glomerata en Australie (Bezemer et al. 2006). L'invasion massive des cellules épithéliales de la glande digestive par M. sydneyi entraîne une désorganisation totale des tissus infectés. La mort par inanition peut survenir moins de 60 jours après l'infection initiale (Wolf 1977). Des valeurs de salinité plus faibles favorisent l'apparition de la maladie (Meyers 2006). Peters et Raftos (2003) ont indiqué que l'activité phénoloxydase avait été considérablement inhibée chez les huîtres associées à la maladie QX et que cette inhibition de la cascade prophénoloxydase pourrait favoriser une infection mortelle par M. sydneyi. Cependant, la présence de M. sydneyi chez les huîtres n'entraîne pas systématiquement l'apparition de la maladie QX, qui est plus étroitement liée à la sporulation du parasite (Simonian et al. 2009a). Les hémocytes de S. glomerata peuvent reconnaître M. sydneyi et déclencher une phagocytose, pendant laquelle les granules se fusionnent aux membranes phagosomes, le pH des phagasomes diminue et un dépôt de phénoloxydase se produit. M. sydneyi a été détecté in vivo sous forme ingérée et mélanisée chez des hémocytes d'huîtres infectées (Kuchel et al. 2010). Butt et Raftos (2008) ont indiqué que l'activité phénoloxydase a mené à une mélanisation complète des phagosomes et ont suggéré que la phagocytose et la mélanisation cellulaire étaient essentielles aux mécanismes de défense de S. glomerata lorsqu'elle est infectée par M. sydneyi. Butt et Raftos (2007) ont également suggéré que la présence de certains facteurs de stress environnementaux transitoires pourrait avoir une incidence sur l'activité phénoloxydase au cours d'une période clé de l'infection et, par conséquent, pourrait accroître la vulnérabilité de l'huître à la maladie. Des techniques d'analyse de l'ADN ont permis à Green et Barnes (2010) de déterminer que le microbiote de la glande digestive de S. glomerata a été modifié par une infection par M. sydneyi, alors qu'il est dominé par un procaryote de type rickettsiales et est généralement moins diversifié.
Il semble que les huîtres soient vulnérables à une maladie causée par M. sydneyi pendant les mois chauds (Guo and Ford 2016), bien que Wolf (1979) a rapporté des épidémies en toutes saisons dans les estuaires nordiques de la Nouvelle-Galles-du-Sud, en Australie. Lester (1986), Anderson et al. (1994), Wesche (1995) et Adlard (1996) ont mené des expériences de transplantation et ont déterminé que les huîtres peuvent être exposées à l'infection pendant un très court intervalle (qui pourrait être de deux semaines par année). Cependant, Rubio et al. (2013) ont signalé que le début de la fenêtre de l'infection par M. sydneyi chez les S. glomerata pouvait durer entre 8 et 18 semaines et qu'elle suivait souvent une diminution rapide de la salinité de l'eau, bien qu'ils n'étaient pas capables de déterminer les conditions environnementales exactes ayant provoqué le début de cette fenêtre de l'infection. Cependant, la température s'est avérée être un paramètre clé du cycle vital du parasite M. sydneyi (Rubio et al. 2013). Une fois l'infection était contractée, les températures chaudes favorisent le développement du parasite, et la mortalité chez l'hôte est plus élevée à la fin de l'été. À des températures plus basses, on observe un décès plus tardif de l'hôte et une suppression du développement du parasite. Dans certains cas, les huîtres infectées peuvent survivre à la maladie pendant les mois d'été et pendant l'hiver; toutefois, le retour des températures élevées provoque généralement la mort. Dans certains cas, M. sydneyi a entraîné une mortalité de plus de 90 % dans les élevages d'huîtres du nord de la Nouvelles-Galles du Sud et du sud du Queensland (Lester 1986, Anderson et al. 1994b; Adlard 1996). Aucune mortalité n'a été associée au parasite s'apparentant à M. sydneyi détecté dans les populations de Saccostrea forskali de deux sites dans la partie supérieure du golfe de Thaïlande (Taveekijakarn et al. 2008).
Il ne semblait pas y avoir de corrélation avec les épizooties (épidémies) de M. sydneyi et les fluctuations de la température, de la salinité et du pH (Anderson et al. 1994a, Wesche 1995). L'absence de corrélation entre le pH et l'infection par M. sydneyi de S. glomerata (Anderson et al. 1994a) pourrait signifier que le pH exerce une plus grande influence sur l'huître hôte que sur le protozoaire parasite lui-même (King et al. 2019). Adlard et Wesche (2005) ont déterminé que la présence de M. sydneyi dans les estuaires où la maladie n'a pas encore été observée fait ressortir le rôle probable de la dynamique du cycle de vie du parasite, combinée aux défenses immunitaires de l'hôte et, probablement, à certains facteurs environnementaux, comme régulateur des épidémies chez S. glomerata. Plus précisément, les études immunologiques réalisées par Peters et Raftos (2003) et par Butt et Raftos (2007) ont montré que le système immunitaire de S. glomerata était compromis par la présence d'un facteur de stress environnemental transitoire dans les estuaires enzootiques pour la maladie QX. De plus, les données historiques semblent indiquer que les pratiques d'utilisation des terres ont entraîné la sédimentation des rivières et des estuaires australiens, ce qui a entraîné une prévalence accrue du parasite M. sydneyi en raison de la dégradation de la qualité de l'eau et de l'abondance accrue d'autres hôtes possibles dans l'habitat utilisé par les huîtres (Diggles 2013). Ainsi, la dégradation de l'environnement est probablement un facteur contributif de la maladie QX (Carrasco et al. 2015).
Les stades de développement de M. sydneyi chez S. glomerata ont été cernés et illustrés par Kleeman et al. (2002a). Au stade infectieux initial, M. sydneyi pénètre dans S. glomerata par les palpes et les branchies, où une prolifération extrasporogonique (prolifération n'entraînant pas la formation de spores) se produit dans l'épithélium. Dans le cytoplasme des cellules souches uninucléées, une cellule fille d'une vacuole se divise par fission binaire pour produire quatre cellules filles dans la cellule souche élargie. Le clivage interne produit une cellule uninucléée dans chaque cellule fille. La cellule souche se dégrade et libère les cellules filles, qui deviennent à leur tour de nouvelles cellules souches. Après cette prolifération, les cellules souches contenant chacune une cellule fille sont libérées dans les tissus conjonctifs environnants et dans les espaces de l'hémolymphe pour former un stade systémique transitoire. Après la diffusion systémique, les parasites infiltrent la glande digestive, pénètrent la membrane basale des tubules et s'établissent comme cellules nourricières à la base des cellules épithéliales des tubules digestifs. Les cellules nourricières s'allongent et forment des extensions pseudopodiales qui débordent de la membrane basale. Les cellules filles formées dans les cellules nourricières se divisent et se répandent le long de la membrane basale pour établir de nouvelles infections entre les cellules épithéliales adjacentes, jusqu'à ce que tous les sites du tubule digestif soient occupés. Dans les cas d'infection mature, les cellules nourricières se dégradent et chaque cellule fille devient la cellule principale décrite par Perkins et Wolf (1976). La cellule primaire déclenche un clivage interne d'une cellule secondaire qui se divise pour former un sporangiosorus (primordiums du sporonte) contenant de huit à 16 sporontes (sporanges), ce qui marque le début de la sporulation. Au cours du processus de sporulation, il se produit un clivage interne donnant naissance à deux précurseurs tertiaires, chacun d'entre eux se transformant en des spores tricellulaires dans chaque sporonte d'un sporangiosorus (Perkins et Wolf 1976). Les spores matures sont évacuées de l'huître à partir de la lumière du tube, et les huîtres infectées déchargent d'importantes quantités (presque la totalité) de spores avant de mourir (Carrasco et al. 2015, King et al. 2019). Cependant, on a observé que quelques S. glomerata éliminent les infections de faible niveau par M. sydneyi en excrétant le parasite, puis qu'elles se rétablissent complètement (Roubal et al. 1989). Néanmoins, les spores de M. sydneyi n'infectaient pas les S. glomerata.
Le reste du cycle de vie est inconnu, mais Roubal et al. (1989) ont mis en cause l'alimentation par filtrage ou des invertébrés détritivores plutôt que des invertébrés ou des poissons charognards dans le cycle de vie. Adlard et Nolan (2009, 2015) ont échantillonné le macrobenthos de la rivière Hawkesbury, en Nouvelle-Galles-du-Sud (Australie) où la présence de M. sydneyi est connue et ils ont examiné des vers polychètes par la méthode de la réaction en chaîne de la polymérase quantitative (qPCR), à l'aide de l'hybridation in situ et de l'histologie. En tout, 76 des 1 247 échantillons d'au moins huit espèces de vers polychètes étaient positifs aux essais de réaction en chaîne de la polymérase pour M. sydneyi. Sur 116 spécimens de cinq des espèces positives aux essais de réaction en chaîne de la polymérase testées par hybridation in situ, seuls deux spécimens de Nephtys australiensis étaient positifs pour M. sydneyi. Néanmoins, ils ont trouvé chez ces deux spécimens de N. australiensis deux stades de développement différents (30 par 10 µm de dimension) de M. sydneyi associés ou adhérés à l'épithélium intestinal du ver polychète. Une cellule « primordiale » avec un noyau bien défini et peu de différenciation dans le cytoplasme et une cellule « plasmodiale » qui présentait une structure syncytiale multinucléée visible. Ils ont spéculé que l'espèce N. australiensis peut être déterminante pour la maturation et la transmission de M. sydneyi. (Adlard et Nolan 2015). Cependant, comme l'indiquent Carrasco et al. (2015), il reste à déterminer si N. australiensis pourrait jouer le rôle de réservoir de M. sydneyi, en tant qu'hôte secondaire soutenant le stade suivant du cycle vital de M. sydneyi ou s'il s'agit d'une infection sans issue.
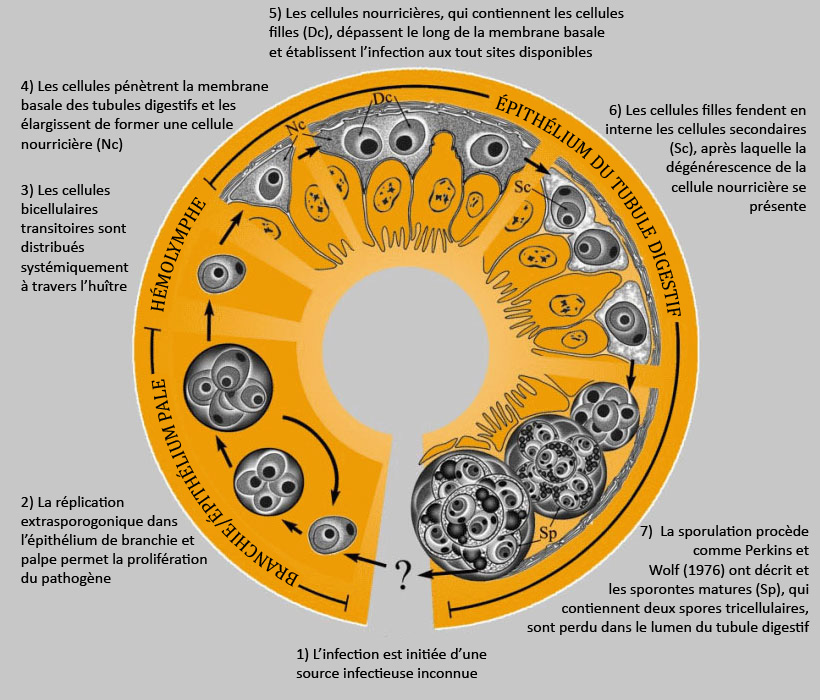
Figure 1. Développement hypothétique de Marteilia sydneyi dans l'huître de roche de Sydney, Saccostrea glomerata. Image fournie par S.N. Kleeman, Biosecurity Australia.
L'image a été modifiée par rapport à l'original pour la traduction française.
Le développement hypothèque de Marteilia sydneyi en l'huître Saccostrea glomerata procède en sept étages :
- l'infection est initiée d'une source infectieuse inconnue,
Branchie/épithélium pale
- la réplication extrasporogonique dans l'épithélium de branchie et palpe permet la prolifération du pathogène,
Hémolymphe
- les cellules bicellulaires transitoires sont distribués systémiquement à travers l'huître,
Épithélium du tubule digestif
- les cellules pénètrent la membrane basale des tubules digestifs et les élargissent de former une cellule nourricière,
- les cellules nourricières, qui contiennent les cellules filles, dépassent le long de la membrane basale et établissent l'infection aux tout sites disponibles,
- les cellules filles fendent en interne les cellules secondaires (Sc), après laquelle la dégénérescence de la cellule nourricière se présente, et
- la sporulation procède comme Perkins et Wolf (1976) ont décrit et les sporontes matures (Sp), qui contiennent deux spores tricellulaires, sont perdu dans le lumen du tubule digestif.
Techniques de diagnostic
Observations
La couleur variant du jaune pâle au brun de la glande digestive contraste avec le vert foncé des huîtres en bonne santé. Le corps est grandement atrophié et les tissus sont translucides en raison de la résorption complète de la gonade.
Préparations humides
Les corps réfractiles observés dans des sporontes dans des frottis humides de la glande digestive (hépatopancréas) fournissent un diagnostic rapide et simple lorsque des sporontes sont présents chez les huîtres infectées.
Figures 2 et 3. Préparations humides de la glande digestive écrasée de Saccostrea glomerata infectée par Marteilia sydneyi à des stades matures. Images fournies par S.N. Kleeman, Biosecurity Australia.
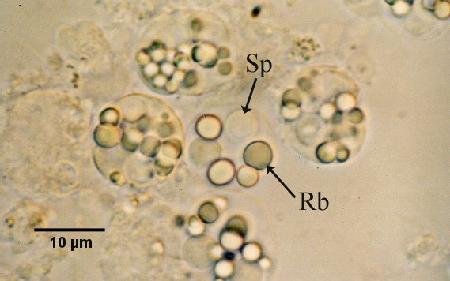
Figure 2. Sporontes de M. sydneyi contenant des corps refractile (Rb) et des spores (Sp).
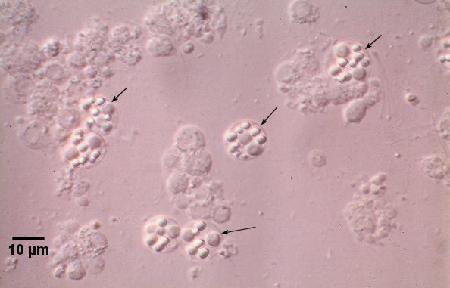
Figure 3. Sporontes de M. sydneyi (flèches) observés sous un microscope à contraste interférentiel.
Empreintes tissulaires
Des empreintes séchées de la glande digestive (hépatopancréas) sur des lames en verre avec coloration Wright, Wright-Giemsa ou une coloration équivalente (p. ex., Hemacolor, Merck; Diff-QuiK, Baxter) permettent la détection rapide de tous les stades de développement, y compris les étapes présporulation non détectables dans les préparations humides quelques jours après l'infection initiale (Kleeman et Adlard 2000). Analyser les lames pour déterminer la présence de M. sydneyi, à un grossissement de 200 à 400x. Un objectif à immersion (1000x) pourrait être nécessaire pour identifier de façon définitive les premiers stades de l'infection de la glande digestive (c.-à-d. les cellules filles ou primaires). À tous les stades (sauf les tout premiers) de l'incursion de M. sydneyi dans la glande digestive, l'infection était suffisamment homogène pour que le sous-échantillonnage de tissu aux fins de diagnostic n'ait pas de répercussions négatives importantes sur la capacité des tests de diagnostic pour détecter la maladie (Adlard et Wesche 2005). Une comparaison entre les empreintes de tissus (cytologie) et l'histologie a montré que la cytologie (96,88 % des individus infectés) offrait une plus grande sensibilité que l'histologie (86,11 % des individus infectés) (Adlard et Wesche 2005).
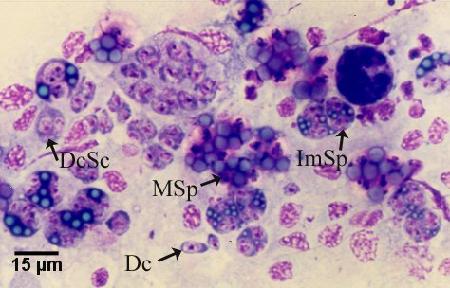
Figure 4. Empreinte tissulaire de la glande digestive de Saccostrea glomerata infectée par Marteilia sydneyi, colorée par Hemacolor (Merck), montrant les différentes étapes du cycle de vie, y compris les cellules filles (Dc), les cellules filles contenant des cellules secondaires (DcSc), les sporontes immatures (ImSp) et les sporontes matures (MSp). Il est à noter que les différents stades observés sont souvent séparés des cellules qui les contiennent (c.-à-d. cellule nourricière ou sporangiosorus). Image fournie par S.N. Kleeman, Biosecurity Australia.
Histologie
Examiner des coupes transversales de la glande digestive pour détecter la présence de Marteilia dans des cellules de l'épithélium de la glande digestive. Marteilia sydneyi se distingue de Marteilia refringens par 1) l'absence d'inclusions striées dans les primordiums du sporonte, 2) la formation de huit à 16 sporontes (primordiums des sporanges, sporanges) dans chaque sporangiosorus (plasmodium), au lieu de huit, 3) la présence de deux plutôt que quatre spores dans chaque sporonte (sporange), et 4) l'épaisse couche de membranes concentriques entourant les spores matures, par rapport à l'absence de telles membranes autour des spores de M. refringens. La détection de l'infection a été facilitée par de récentes descriptions des premiers stades de développement et du site d'infection (Kleeman et al. 2001, 2002a,c). De plus, l'infiltration d'hémocytes dans les tissus est courante dans le cas des infections au stade de présporulation (Adlard et Wesche 2005). De plus, Dang et al. (2011) ont signalé que certaines huîtres ne présentaient que des parasites morts dans l'épithélium des tubules digestifs et que la combinaison de parasites M. sydneyi vivants et morts n'était pas observée sur la même lame. Une infiltration intense des hémocytes s'est produite dans la glande digestive des S. glomerata présentant des parasites morts, et les hémocytes ont envahi les tubules digestifs, les rendant anormalement minces (Dang et al. 2011). Cependant, la détection des infections initiales est facilitée par l'application de sondes à ADN par l'intermédiaire de l'hybridation in situ (voir les figures 8 et 9, la figure 10 et les détails concernant les sondes à ADN, ci-dessous) (Kleeman et al. 2002b; Adlard et Wesche 2005).
Figures 5 à 7. Réplication extrasporogonique de Marteilia sydneyi dans l'épithélium des branchies et des palpes de Saccostrea glomerata après le déclenchement d'une infection à partir d'une source inconnue. Coloration à l'hématoxyline et à l'éosine. Images fournies par S.N. Kleeman, Biosecurity Australia.
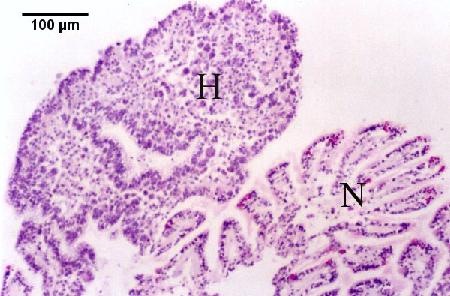
Figure 5. Réaction de l'huître consistant en une hyperplasie de l'épithélium et des tissus conjonctifs (H) et une fusion des filaments en raison de la présence de nombreux stades extrasporogoniques dans l'épithélium des branchies, en comparaison avec un tissu branchial d'apparence relativement normale (N).
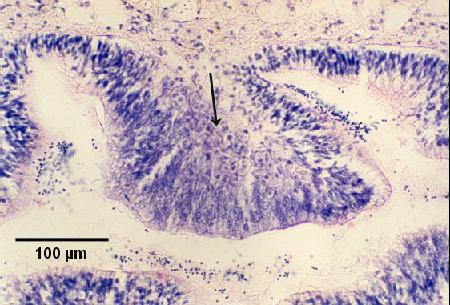
Figure 6. Stade de réplication dans l'épithélium des palpes. Il faut noter l'hypertrophie des cellules épithéliales en présence de parasites proliférant (flèche) dans les zones infectées.
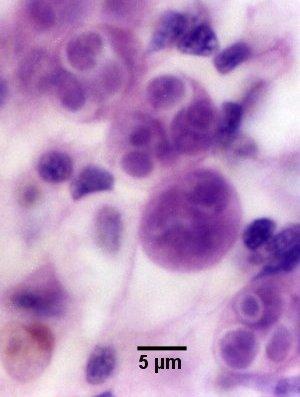
Figure 7. Grossissement plus élevé des stades extrasporogoniques dans l'épithélium des branchies (voir le stade 2 du diagramme du cycle de vie).
Figures 8 et 9. Coupes de tissu de la glande digestive de Saccostrea glomerata montrant un stade précoce de développement de la maladie. Images fournies par S.N. Kleeman, Biosecurity Australia.
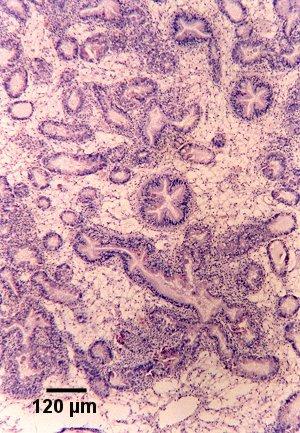
Figure 8. Section montrant l'infiltration hémocytaire du tissu conjonctif entourant les tubules digestifs infectés. Coloration à l'hématoxyline et à l'éosine.
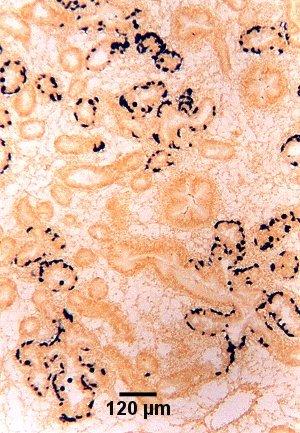
Figure 9. Coupe de tissu adjacente à celle présentée à la figure 8 et indiquant l'emplacement de cellules nourricières au stade de présporulation (colorées en noir) dans l'épithélium de la glande digestive, détectées par hybridation in situ à l'aide de la sonde Smart 2, comme il est décrit ci-dessous.
Figures 10 à 15. Stades de présporulation de Marteilia sydneyi dans les tubules digestifs de Saccostrea glomerata. Coloration à l'hématoxyline et à l'éosine, sauf pour la figure 10, qui était colorée par hybridation in situ à l'aide de la sonde Smart 2, comme il est décrit ci-dessous. Images fournies par S.N. Kleeman, Biosecurity Australia.
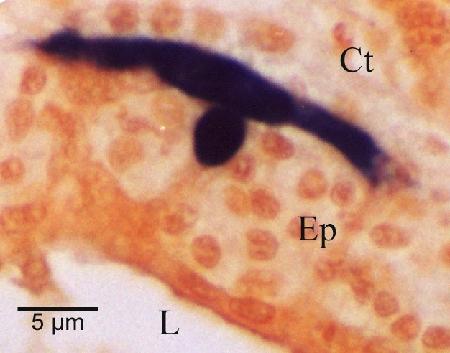
Figure 10. Cellule nourricière (colorée en noir par hybridation in situ) montrant l'étendue des extensions pseudopodiales le long de la membrane basale de l'épithélium du tubule digestif (Ep). Cette caractéristique n'est pas mise en évidence par la coloration à l'hématoxyline et à l'éosine. Les autres caractéristiques indiquées sont le tissu conjonctif (Ct) qui entoure le tubule et la lumière (L) du tubule.
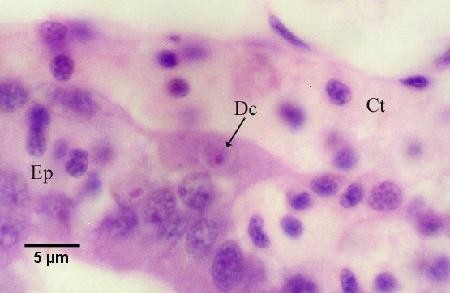
Figure 11. Cellule nourricière contenant une cellule fille (Dc), logée le long de la membrane basale du tubule, entre les tissus conjonctifs (Ct) entourant les tubules et l'épithélium du tubule (Ep).
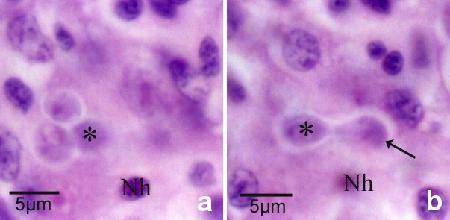
Figure 12a and b. Même section, mais à un plan focal différent montrant le bourgeonnement d'une cellule fille (flèche à la figure 12b) au sein de la cellule nourricière. l'astérisque indique la même cellule fille et la mention Nh indique le même noyau de la cellule hôte dans chaque figure. On remarque deux autres cellules filles dans la cellule nourricière (figure 12A).
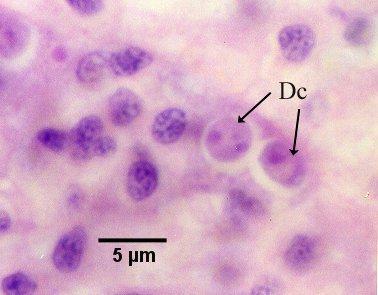
Figure 13. Cellule nourricière contenant deux cellules filles (Dc, voir le stade 5 du diagramme du cycle de vie).
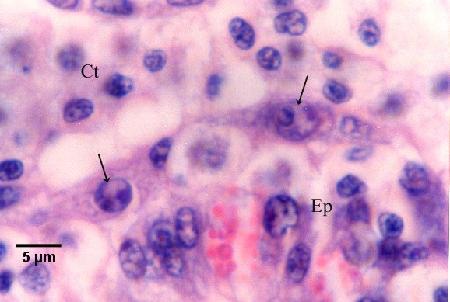
Figure 14. Cellules nourricières contenant des cellules filles bicellulaires (flèches) le long de la membrane basale entre l'épithélium du tubule (Ep) et le tissu conjonctif contenant de nombreux hémocytes infiltrants (voir le stade 6 du diagramme du cycle de vie).
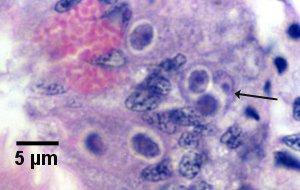
Figure 15. Cellule primaire (flèche) contenant deux cellules secondaires (primordiums du sporonte) juste avant la sporulation (voir le stade 7 du diagramme du cycle de vie).
Figures 16 et 17. Section de tissu de la glande digestive de Saccostrea glomerata montrant la maladie à un stade avancé et le stade de sporulation de Marteilia sydneyi. Coloration à l'hématoxyline et à l'éosine. Images fournies par S.N. Kleeman, Biosecurity Australia.
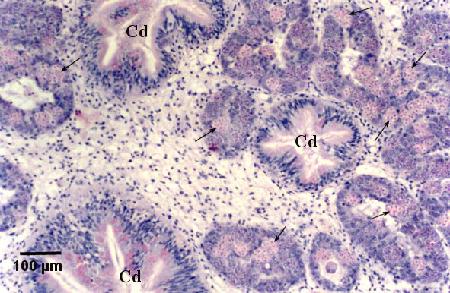
Figure 16. Nombreux stades de sporulation (flèches) dans les tubules digestifs. Il est à noter que la sporulation ne se déroule pas dans les conduits ciliés de la glande digestive (Cd).
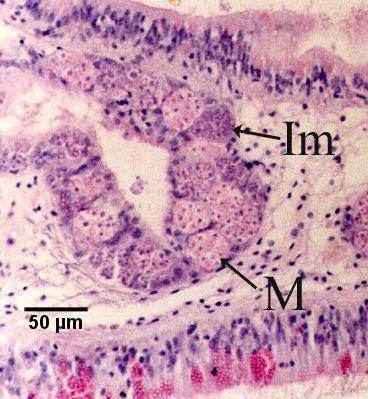
Figure 17. Sporontes immatures (Im) et matures (M) dans le sporangiosorus d'un tubule de la glande digestive. Il est à noter que l'épithélium du tubule est presque complètement remplacé par M. sydneyi.
Microscope électronique
Matière fixée au formol traité pour la microscopie électronique en transmission, qui peut être utilisée pour la détermination des espèces de M. sydneyi par la visualisation des deux spores tricellulaires d'un sporonte (Adlard et Wesche 2005).
Essai immunologique
Une épreuve de dépistage par immunofluorescence indirecte (IFAT) pour détecter la présence de la plupart des stades de M. sydneyi était élaborée par Roubal et Lester (1987). Toutefois, cette épreuve n'a pas réagi au contenu des spores (Roubal et al. 1989). Anderson et al. (1994b) ont déterminé que l'épreuve IFAT fondée sur les anticorps polyclonaux anti-QX développée par Roubal et al. (1989) a reconnu les stades de sporulation de M. sydneyi, mais pas ceux des espèces apparentées. Toutefois, cet anticorps polyclonal n'a pas détecté les stades de présporulation présumés de M. sydneyi dans les tissus conjonctifs d'huîtres récemment infectées. Par conséquent, Anderson et al. (1994b) ont suggéré que les antigènes de M. sydneyi sont propres au stade et ont indiqué qu'une sonde à ADN serait plus utile que des essais immunohistochimiques pour détecter ce parasite.
Sondes à ADN
Les données de séquence pour la première région de l'espaceur transcrit interne (ITS1) de l'ADNr de M. sydneyi décrite par Anderson et al. (1995) ont été utilisées pour la préparation de l'analyse de la réaction en chaîne de la polymérase (RCP) et l'essai d'hybridation in situ (Kleeman et Adlard 2000). Les analyses de la PCR portant sur des nombres connus de sporontes purifiés à partir de la glande digestive d'huîtres infectées ont révélé qu'un ADN équivalant à 0,01 sporonte était décelable à l'électrophorèse en gel d'agarose. Toutefois, les concentrations d'ADN hôte de plus de 50 ng par réaction de 20 µl ont réduit la sensibilité du test. Une sonde à ADN avec système DIG construite à partir d'amorces uniques de M. sydneyi pourrait détecter 10 pg d'ADN amplifiés par PCR de M. sydneyi à l'hybridation sur tache. Cette sonde a produit une hybridation à tous les stades de développement de M. sydneyi dans les coupes de paraffine de la glande digestive d'huîtres infectées sans liaison non spécifique; cependant, une détection non uniforme des stades des sporontes matures a été observée (Kleeman et Adlard 2000). Les protocoles de la réaction en chaîne de la polymérase qui utilisent cette sonde pour la détection de M. sydneyi dans les tissus d'huîtres ont été optimisés et validés par Adlard et Worthington Wilmer (2003), et l'indiquent Adlard et Wesche (2005). La PCR s'est révélée plus sensible pour détecter l'infection que l'examen des empreintes tissulaires (98,99 % des individus infectés par rapport à 58,11 % dans un échantillon de 1 839 huîtres) puisque la PCR peut détecter les infections par M. sydneyi à un stade de développement beaucoup plus précoce, bien avant que la présporulation et la sporulation soient facilement repérables par microscope dans la glande digestive de l'huître (Adlard et Wesche 2005). Toutefois, selon Simonian et al. (2009a), la sporulation est un marqueur de la maladie QX plus fiable que la PCR, puisque ce stade correspond à l'état pathologique et ne fait pas qu'indiquer la présence de M. sydneyi. Simonian et al. (2009a) ont utilisé des cartes protéomiques produites par électrophorèse bidimensionnelle pour déterminer les principales différences dans l'expression de quatre sources de protéines chez les huîtres infectées par M. sydneyi au stade de sporulation.
La sonde « Smart 2 » conçue par Le Roux et al. (1999) à partir de la région 18S de l'ARNr de M. refringens a également détecté M. sydneyi par hybridation in situ, et bien qu'il ne s'agisse pas d'un essai propre à l'espèce, celui-ci a permis une détection plus fiable de tous les stades du cycle de vie (Kleeman et al. 2002b). l'utilisation combinée de la sonde ITS1 spécifique de M. sydneyi et de la sonde Smart 2 dans l'hybridation in situ a permis de comprendre la présence de cellules nourricières de M. sydneyi entre les cellules épithéliales et à proximité de la membrane basale des tubules de la glande digestive (figure 10). Les cellules nourricières ne sont généralement pas évidentes dans l'histologie normale colorée à l'hématoxyline et à l'éosine. l'application de l'épreuve d'hybridation in situ à des huîtres légèrement infectées a permis de visualiser les premiers stades de développement de l'infection (figure 9) et de déterminer le cycle de développement hypothétique de M. sydneyi dans S. glomerata (voir la figure 1 et Kleeman et al. 2002a).
La PCR ciblant l'ITS1 et l'essai d'hybridation in situ se sont avérés spécifiques de M. sydneyi lorsqu'on a vérifié leur potentiel de réaction croisée avec les espèces de Paramyxea, y compris Marteilia refringens chez l'huître Ostrea edulis provenant de France, Marteilioides chungmuensis chez l'huître Crassostrea gigas provenant du Japon et l'espèce Marteilioides chez l'huître à lèvres noires Saccostrea echinata (= Striostrea mytiloides) provenant de Darwin Harbour, en Australie (Kleeman et al. 2002b). Bien que la sonde Smart 2 (Le Roux et al. 1999) ait présenté une réaction croisée avec diverses espèces de Paramyxea (Kleeman et al. 2002b), elle fournit un signal plus fort dans la détection des stades des sporontes et s'est avérée plus fiable que la sonde ITS1 pour la détection des spores matures de M. sydneyi (comparer les figures 20 à 19 et 21 à 22). Par conséquent, Kleeman et al. (2002b) ont indiqué que la sonde Smart 2 était préférable pour le dépistage ou la surveillance des populations d'huîtres et que la sonde ITS1 devrait être utilisée pour confirmer l'identité précise de l'agent pathogène M. sydneyi. Kleeman et al. (2002b) ont aussi déterminé qu'en l'absence de données de séquence comparatives, les amorces conçues dans les régions des espaceurs transcrits internes (ITS) sont plus appropriées pour la production d'analyses de la PCR propres à chaque espèce. Les sondes ITS1 et Smart 2 ont été utilisées pour détecter un autre hôte possible du parasite M. sydneyi (Adlard et Nolan 2015).
Figures 18 à 20. Détection de Marteilia sydneyi dans les tubules digestifs de Saccostrea glomerata. Images fournies par S.N. Kleeman, Biosecurity Australia.
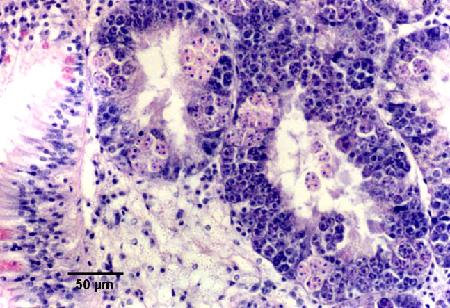
Figure 18. Détection par histologie classique. L'épithélium des tubules de la glande digestive est presque complètement remplacé par des stades de sporulation de M. sydneyi.
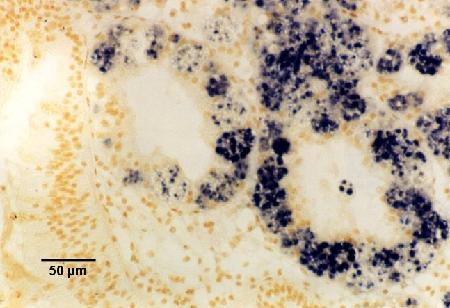
Figure 19. Détection par la sonde ITS1.
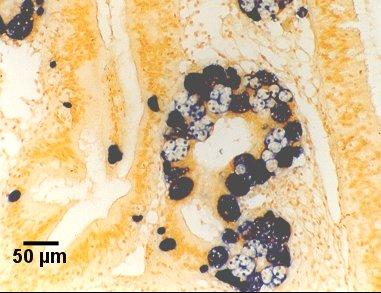
Figure 20. Détection par la sonde Smart 2.
Figures 21 et 22. Détection de stades de sporontes matures et immatures dans le sporangiosorus de Marteilia sydneyi dans des coupes de tissu de Saccostrea glomerata par hybridation in situ. Images fournies par S.N. Kleeman, Biosecurity Australia.
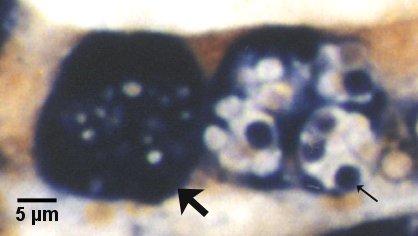
Figure 21. Détection par la sonde Smart 2. Les deux sporangiosorus, un contenant des sporontes immatures (flèche) et l'autre contenant des sporontes matures (petite flèche), sont fortement colorés par cette sonde. Il est à noter que les granules réfringentes (les plus évidentes dans le sporangiosorus contenant des sporontes matures) ne sont pas colorées.
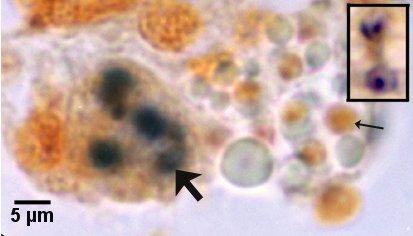
Figure 22. Détection avec la sonde ITS1. Le sporangiosorus contenant des sporontes immatures (grande flèche) est moins hybridé que celui de la figure 21. Il est à noter que la plupart des spores matures (petite flèche) ne sont pas hybridées. L'encadré au même facteur de grossissement montre deux spores matures qui ont été marquées avec succès au moyen de la sonde ITS1.
Kleeman et al. (2004) ont déterminé que l'analyse fondée sur le polymorphisme de conformation des simples brins (SSCP) d'une région (195 bp) de l'ITS1 de l'ADN ribosomique pourrait être utilisée pour détecter l'existence d'au moins deux variantes génétiques de M. sydneyi. Ces données moléculaires appuient la proposition concernant l'origine et la répartition ultérieure de ce parasite vers le sud, le long de la côte sud-est de l'Australie (Kleeman et al. 2004). La région codante conservée de l'ADNr 18S a été utilisée pour démontrer les relations phylogénétiques entre plusieurs espèces de l'ordre Paramyxida y compris les espèces Marteilia refringens et Marteilia cochillia (Europe), M. sydneyi (Australie) et les espèces asiatiques Marteilia granula (Japon) et Marteilioides chungmuensis (Corée, Japon) (Itoh et al. 2014, Carrasco et al. 2015, Ward et al. 2016).
Méthodes de contrôle
On tente de lutter contre la maladie en modifiant les techniques d'élevage : les huîtres ne sont pas semées dans des zones de risque pendant l'été austral (de janvier à mars), les jeunes huîtres sont conservées dans une eau à salinité élevée où elles croissent plus lentement, mais demeurent exemptes d'infection jusqu'à ce que le risque d'infection soit passé (fin avril), les grandes huîtres sont cueillies avant le début de la période de transmission (avant la fin du mois de décembre) et le repeuplement en vue du grossissement se fait en automne à partir de zones exemptes de la maladie QX. En outre, la détermination des facteurs de risque qui entraînent les épidémies de maladie QX permettra aux exploitants de positionner leurs exploitations aux endroits où les épidémies sont moins susceptibles de se produire (Green et al. 2011). Par exemple, le fait d'accrocher des grappes d'huîtres en flottaison, comme sur des radeaux ou dans des tonneaux (Wisely et al. 1979) ou le grossissement d'huîtres à des niveaux plus élevés dans la zone intertidale des zones enzootiques (Meyer 2006) pourraient réduire l'exposition des huîtres d'élevage au parasite M. sydneyi. Les pratiques de gestion des exploitations qui consistent à transférer les stocks d'huîtres entre les estuaires augmentent le risque d'introduction du parasite dans de nouvelles zones (Guo et Ford 2016). En Nouvelles-Galles du Sud, des lois (zonage en fonction de la maladie) ont été instaurées depuis 1986 afin d'éviter le transfert de stocks potentiellement infectés des zones où la maladie QX est endémique aux estuaires du sud qui ne sont pas touchés par la maladie (Nell 1993, 2001, Adlard et Ernst 1995). Cependant, cette mesure de contrôle a nui à l'élevage de S. glomerata, qui se fait traditionnellement en transférant les naissains sauvages capturés entre les estuaires à des fins d'engraissement jusqu'à ce qu'ils atteignent leur taille commerciale, et n'a pas permis de prévenir l'apparition de la maladie QX à de nouveaux endroits (Green et al. , 2011). Bien que l'approche législative ait été choisie uniquement parce qu'elle était le seul outil de gestion disponible à l'époque pour prévenir la maladie QX, la justification de sa mise en œuvre était erronée, car la maladie QX n'était présente que dans une minorité d'estuaires de la Nouvelle-Galles-du-Sud. En revanche, l'agent pathogène, M. sydneyi, était présent dans la plupart des estuaires de la Nouvelle-Galles-du-Sud (Adlard et Wesche 2005, Carrasco et al. 2015). Adlard et Wesche (2005) ont conclu que la maladie QX était causée soit par un mécanisme environnemental, soit par une abondance de l'hôte intermédiaire dans l'environnement, soit par une immunosuppression de l'hôte. Différentes souches de M. sydneyi existent aussi dans les réseaux hydrographiques du sud du Queensland et du nord de la Nouvelle-Galles-du-Sud (Kleeman et al. 2004), mais on ne sait pas si elles sont différentes sur le plan de leur pathogénicité. Si les différentes souches varient du point de vue de leur pathogénicité, il pourrait être approprié de concevoir des fermetures basées sur le risque de la maladie QX pour limiter la propagation de différentes variantes du parasite M. sydneyi entre les réseaux hydrographiques (Carrasco et al. 2015). Selon Green et al. (2011), l'avenir de l'industrie de l'huître S. glomerata dépend en partie du succès de la commercialisation d'huîtres S. glomerata résistantes à la maladie QX provenant d'écloseries.
Pour contrôler la maladie, un programme d'élevage résistant à la maladie QX a été établi en 1996 par l'Australian New South Wales Department of Primary Industries (Nell et al., 2000, Nell 2001, Nell et Hand 2003, Dove et al. 2013a). Au départ, on a signalé une amélioration de l'activité phénoloxydase dans les populations de S. glomerata élevées de manière sélective pour leur résistance à la maladie QX (Newton et al. 2004). Malheureusement, après environ 10 ans (quatre générations) de reproduction sélective, on a, par mégarde, créé un stock possédant beaucoup moins de phénoloxydase POb, une enzyme défensive assurant une résistance aux maladies (Bezemer et al. 2006). Néanmoins, Nell et Perkins (2006) et Dove et al. (2013a, b) ont observé que les descendants de troisième et de quatrième génération, respectivement, de lignées de S. glomerata sélectionnées, présentaient une résistance évaluée à la maladie causée par M. sydneyi et Bonamia roughleyi comparativement aux lignées de contrôle non sélectionnées. Par contre, la sélection en fonction de la résistance à M. sydneyi n'a pas semblé conférer de résistance à B. roughleyi, et l'inverse non plus (Nell et Perkins 2006, Dove et al. 2013a, b). Toutefois, le processus de sélection qui a été utilisé pourrait avoir permis la sélection de géniteurs ayant fait face à de multiples maladies et, par conséquent, ayant acquis une résistance à l'égard de certaines (Green et al. 2008, 2009). Simonian et al. (2009b) ont élaboré une approche protémique en faisant appel à l'électrophorèse bidimensionnelle et à la spectrométrie de masse afin de déterminer la possibilité de créer deux marqueurs de résistance à la maladie QX venant s'ajouter à l'activité phénoloxydase. Kuchel et al. (2010) ont suggéré que la résistance à la maladie QX pourrait être associée à l'activité phagolysosomale supérieure des huîtres résistantes à la maladie QX.
Dang et al. (2011) ont analysé la réaction hémocytaire des S. glomerata qui étaient la descendance de la cinquième génération d'huîtres élevées pour leur résistance à la maladie QX en la comparant à celle des S. glomerata non sélectionnées à l'aide de la cytométrie en flux et de l'histologie pour évaluer la viabilité du parasite. Ils ont déterminé que parmi les huîtres résistantes à la maladie QX, 20 % étaient infectées par des parasites viables, 74 % avaient tué le parasite M. sydneyi et 6 % n'étaient pas infectées. En revanche, 86 % des huîtres non sélectionnées étaient infectées, 2 % avaient tué le parasite M. sydneyi et 12 % étaient en bonne santé. Bien que le taux de phagocytose et l'activité oxydative moyenne par hémocyte soient similaires entre les deux lignées d'huîtres, les huîtres résistantes à la maladie QX présentaient un nombre plus élevé d'hémocytes infiltrants et circulants et un pourcentage plus élevé de granulocytes circulants dont la taille et la complexité étaient supérieures à celles d'huîtres non sélectionnées. L'abondance élevée de M. sydneyi dans l'épithélium des tubules digestifs de ces deux lignées d'huîtres sous-entendait une incapacité de tuer le parasite dès le début de l'infection. Cependant, les huîtres résistantes à la maladie QX étaient capables de tuer le sporangiosorus de M. sydneyi, probablement par encapsulation (Dang et al. 2011).
Jenkins et al. (2013) ont indiqué que l'huître Crassostrea gigas (non originaire d'Australie) est devenue la principale huître commerciale en Tasmanie et en Australie-Méridionale et qu'elle était élevée de préférence dans certains estuaires de la Nouvelle-Galles-du-Sud en raison de l'incidence de la maladie QX (provoquée par M. sydneyi) sur l'espèce indigène S. glomerata. Dans la rivière Georges, en Nouvelles-Galles du Sud, les huîtres triploïdes C. gigas sont élevées avec les S. glomerata, et il faut compter généralement 7 à 18 mois environ pour que le petit naissain (hauteur de la coquille : 4 mm) de C. gigas atteigne une taille marchande (hauteur de la coquille : 50 à 120 mm). Cependant, dans la rivière Parramatta (port de Sydney), seules les populations sauvages d'huîtres diploïdes C. gigas et S. glomerata sont présentes et l'huître C. gigas est considérée comme une espèce envahissante/parasite. Dans ces deux zones, des mortalités élevées (plus de 95 %) de C. gigas causées par l'herpèsvirus de l'huître de type 1 (OsHV-1) ont débuté en été (novembre) 2010. Heureusement, les stocks voisins de S. glomerata n'étaient pas touchés et les S. glomerata semblent être résistantes à l'infection par OsHV-1 (Jenkins et al. 2013).
Wesche et al. (1999) ont déterminé que les spores de M. sydneyi ont une durée de vie relativement courte une fois isolées des huîtres et que la majorité meurent dans les 7 à 9 jours (la longévité maximale est de 35 jours à 15 °C et à un degré de salinité de 34 ppt). Les spores n'ont pas survécu plus de deux heures suivant l'ingestion par des oiseaux ou des poissons, mais sont restées viables pendant plus de 7 mois à -20 et -70° C. l'exposition au chlore (issu de l'hypochlorite de calcium granulaire à 650 g par kg) à 200 ppm a fait mourir 99,5 % des spores en moins de deux heures, et toutes les spores après une exposition de quatre heures (Wesche et al. 1999).
Références
- Adlard, R.D. 1996. QX disease (Marteilia sydneyi) of the Sydney rock oyster (Saccostrea commercialis) on the central coast of NSW. Final report for Fisheries Research and Development Corporation, FRDC Project No. 1994/156. The University of Queensland, Brisbane, Australia.
- Adlard, R.D. et I. Ernst. 1995. Extended range of the oyster pathogen Marteilia sydneyi. Bulletin of the European Association of Fish Pathologists 15: 119-121.
- Adlard, R.D. et M.J. Nolan. 2009. Identification of host interactions in the life cycle of QX disease, Final Report for Fisheries Research and Development Corporation, Aquatic Animal Health Subprogram FRDC Project No. 2006/062. Queensland Museum, Brisbane, Australia.
- Adlard, R.D. et M.J. Nolan. 2015. Elucidating the life cycle of Marteilia sydneyi, the aetiological agent of QX disease in the Sydney rock oyster (Saccostrea glomerata). International Journal for Parasitology 45: 419-426.
- Adlard, R.D. et S.J. Wesche. 2005. Aquatic Animal Health Subprogram: Development of a disease zoning policy for Marteilia sydneyi to support sustainable production, health certification and trade in the Sydney rock oyster. Final Report 2001/214. Australian Fisheries Research and Development Corporation and Queensland Museum, Brisbane, Australia, pp. 1-46.
- Adlard, R. et J. Worthington-Wilmer. 2003. Validation of DNA-based (PCR) diagnostic tests suitable for use in surveillance programs for QX disease of Sydney rock oysters (Saccostrea glomerata) in Australia. Final report for Fisheries Research and Development Corporation, Aquatic Animal Health Subprogram FRDC Project No. 2001/630. Queensland Museum, Brisbane, Australia.
- Anderson, I.G. 1990. Diseases in Australian invertebrate aquaculture. In: Proceedings and Abstracts, Fifth International Colloquium on Invertebrate Pathology and Microbial Control, Society for Invertebrate Pathology, 20-24 Aug. 1990, Adelaide, Australia, p. 38-48.
- Anderson, T.J., S. Wesche et R.J.G. Lester. 1994a. Are outbreaks of Marteilia sydneyi in Sydney rock oysters, Saccostrea commercialis, triggered by a drop in environmental pH? Australian Journal of Marine and Freshwater Research 45: 1285-1287.
- Anderson, T.J., T.F. McCaul, V. Boulo, J.A.F. Robledo et R.J.G. Lester. 1994b. Light and electron immunohistochemical assays on paramyxea parasites. Aquatic Living Resources 7: 47-52.
- Anderson, T.J., R.D. Adlard et R.J.G. Lester. 1995. Molecular diagnosis of Marteilia sydneyi (Paramyxea) in Sydney rock oysters, Saccostrea commercialis (Angas). Journal of Fish Diseases 18: 507-510.
- Aranguren, R. et A. Figueras. 2016. Moving from histopathology to molecular tools in the diagnosis of molluscs diseases of concern under EU Legislation. Frontiers in Physiology 7: Article 538, 10 pp.
- Berthe, F.C.J., F. Le Roux, E. Peyretaillade, P. Peyret, D. Rodriguez, M. Gouy et C.P. Vivarès. 2000. Phylogenetic analysis of the small subunit ribosomal RNA of Marteilia refringens validates the existence of Phylum Paramyxea (Desportes and Perkins 1990). The Journal of Eukaryotic Microbiology 47: 288-293.
- Berthe, F.C.J., F. Le Roux, R.D. Adlard et A. Figueras. 2004. Marteiliosis in molluscs: A review. Aquatic Living Resources 17: 433-448.
- Bezemer, B., D. Butt, J. Nell, R. Adlard et D. Raftos. 2006. Breeding for QX disease resistance negatively selects one form of the defensive enzyme, phenoloxidase, in Sydney rock oysters. Fish and Shellfish Immunology 20: 627-636.
- Butt, D. et D. Raftos. 2007. Immunosuppression in Sydney rock oysters (Saccostrea glomerata) and QX disease in the Hawkesbury River, Sydney. Marine and Freshwater Research 58: 213-221.
- Butt, D. et D. Raftos. 2008. Phenoloxidase-associated cellular defence in the Sydney rock oyster, Saccostrea glomerata, provides resistance against QX disease infections. Developmental and Comparative Immunology 32: 299-306.
- Carrasco, N., T.J. Green et N. Itoh. 2015. Marteilia spp. parasites in bivalves: A revision of recent studies. Journal of Invertebrate Pathology 131: 43-57.
- Cavalier-Smith, T. et E.E.Y. Chao. 2003. Phylogeny and Classification of Phylum Cercozoa (Protozoa). Protist 154: 341-358.
- Comps, M. 1976. Marteilia lengehi n. sp., parasite de l'huître Crassostrea cucullata Born. Revue des Travaux de l'Institut des Pêches Maritimes 40: 347-349.
- Dang, C., C. Lambert, P. Soudant, J. Delamare-Deboutteville, M.M. Zhang, J. Chan, T.J. Green, N. Le Goïc et A.C. Barnes. 2011. Immune parameters of QX-resistant and wild caught Saccostrea glomerata hemocytes in relation to Marteilia sydneyi infection. Fish & Shellfish Immunology 31: 1034-1040.
- Diggles, B.K. 2013. Historical epidemiology indicates water quality decline drives loss of oyster (Saccostrea glomerata) reefs in Moreton Bay, Australia. New Zealand Journal of Marine and Freshwater Research 47: 561-581.
- Dove, M.C., J.A. Nell, S. Mcorrie et W.A. O'Connor. 2013a. Assessment of Qx and winter mortality disease resistance of mass selected Sydney rock oysters, Saccostrea glomerata (Gould 1850), in the Hawkesbury River and Merimbula Lake, NSW Australia. Journal of Shellfish Research 32: 681-687.
- Dove, M.C., J.A. Nell et W.A. O'Connor. 2013b. Evaluation of the progeny of the fourth-generation Sydney rock oyster Saccostrea glomerata (Gould 1850) breeding lines for resistance to QX disease (Marteilia sydneyi) and winter mortality (Bonamia roughleyi). Aquaculture Research 44: 1791-1800.
- Feist, S.W., P.M. Hine, K.S. Bateman, G.D. Stentiford et M. Longshaw. 2009. Paramarteilia canceri sp. n. (Cercozoa) in the European edible crab (Cancer pagurus) with a proposal for the revision of the order Paramyxida Chatton 1911. Folia Parasitologica 56: 73-85.
- Green, T.J. et A.C. Barnes. 2010. Bacterial diversity of the digestive gland of Sydney rock oysters, Saccostrea glomerata infected with the paramyxean parasite, Marteilia sydneyi. Journal of Applied Microbiology 109: 613-622.
- Green, T.J., B.J. Jones, R.D. Adlard et A.C. Barnes. 2008. Parasites, pathological conditions and mortality in QX-resistant and wild-caught Sydney rock oysters, Saccostrea glomerata. Aquaculture 280: 35–38.
- Green, T.J., T.J. Dixon, E. Devic, R.D. Adlard et A.C. Barnes. 2009. Differential expression of genes encoding anti-oxidant enzymes in Sydney rock oysters, Saccostrea glomerata (Gould) selected for disease resistance. Fish & Shellfish Immunology 26: 799-810.
- Green, T.J., D. Raftos, W. O'connor, R.D. Adlard et A.C. Barnes. 2011. Disease prevention strategies for QX disease (Marteilia sydenyi) of Sydney rock oysters (Saccostrea glomerata). Journal of Shellfish Research 30: 47-53.
- Guo, X. and S.E. Ford. 2016. Infectious diseases of marine molluscs and host responses as revealed by genomic tools. Philosophical Transactions of the Royal Society B: Biological Sciences 371: 20150206, 16pp.
- Hine, P.M. 1996. Southern hemisphere mollusc diseases and an overview of associated risk assessment problems. Revue Scientifique et Technique de l'Office International des Epizooties 15: 563-577.
- Hine, P.M. et T. Thorne. 2000. A survey of some parasites and diseases of several species of bivalve mollusc in northern Western Australia. Diseases of Aquatic Organisms 40: 67-78.
- Itoh, N., T. Yamamoto, H.-S. Kang, K.-S. Choi, T.J. Green, N. Carrasco, M. Awaji et S. Chow. 2014. A novel paramyxean parasite, Marteilia granula sp. nov. (Cercozoa), from the digestive gland of Manila clam Ruditapes philippinarum in Japan. Fish Pathology 49: 181-193.
- Jenkins, C., P. Hick, M. Gabor, Z. Spiers, S.A. Fell, X. Gu, A. Read, J. Go, M. Dove, W. O'Connor, P.D. Kirkland et J. Frances. 2013. Identification and characterisation of an ostreid herpesvirus-1 microvariant (OsHV-1 µ-var) in Crassostrea gigas (Pacific oysters) in Australia. Diseases of Aquatic Organisms 105: 109-126.
- Jones, J.B. et J. Creeper. 2006. Diseases of pearl oysters and other molluscs: a Western Australian perspective. Journal of Shellfish Research 25: 233-238.
- King, W.L., C. Jenkins, J.R. Seymour et M. Labbate. 2019. Oyster disease in a changing environment: Decrypting the link between pathogen, microbiome and environment. Marine Environmental Research 143: 124-140.
- Kleeman, S.N. et R.D. Adlard. 2000. Molecular detection of Marteilia sydneyi, pathogen of Sydney rock oysters. Diseases of Aquatic Organisms 40: 137-146.
- Kleeman, S.N., R.D. Adlard et R.J.G. Lester. 2001. Detection of early infective stages of Marteilia sydneyi and their development through to sporogenesis. Book of Abstracts, European Association of Fish Pathologists, Tenth International Conference “Diseases of Fish and Shellfish”. Trinity College Dublin, Ireland, 9 - 14 September 2001. pg. O-004.
- Kleeman, S.N., R.D. Adlard et R.J.G. Lester. 2002a. Detection of the initial infective stages of the protozoan parasite Marteilia sydneyi in Saccostrea glomerata and their development through to sporogenesis. International Journal for Parasitology 32: 767-784.
- Kleeman, S.N., F. Le Roux, F. Berthe et R.D. Adlard. 2002b. Specificity of PCR and in situ hybridization assays designed for detection of Marteilia sydneyi and M. refringens. Parasitology 125: 131-141.
- Kleeman, S., R. Adlard et B. Lester. 2002c. Discovery of the early infective stage of the protozoan parasite Marteilia sydneyi in oysters and the implications for disease detection and control. Handbook and Abstracts, Fifth Symposium on Diseases in Asian Aquaculture, Queensland, Australia, 24-28 November 2002. Pg. 100.
- Kleeman, S.N., R.D. Adlard, X. Zhu et R.B. Gasser. 2004. Mutation scanning analysis of Marteilia sydneyi populations from different geographical locations in eastern Australia. Molecular and Cellular Probes 18: 133-138.
- Kuchel, R.P., S. Aladaileh, D. Birch, N. Vella et D.A. Raftos. 2010. Phagocytosis of the protozoan parasite, Marteilia sydneyi, by Sydney rock oyster (Saccostrea glomerata) hemocytes. Journal of Invertebrate Pathology 104: 97-104.
- Le Roux, F., C. Audemard, A. Barnaud et F. Berthe. 1999. DNA Probes as potential tools for the detection of Marteilia refringens. Marine Biotechnology 1: 588-597.
- Lester, R.J.G. 1986. Field and laboratory observations on the oyster parasite Marteilia sydneyi. In: M. Cremin, C. Dobson and D.E. Moorhouse (eds), 'Parasite Lives'. University of Queensland Press, pp. 33-40.
- Meyers, T. 2006. 5.2.9 Marteiliasis and marteilioidiasis of shellfish, In: Fish Health Section Blue Book, 2014 Edition, Suggested Procedures for the Detection and Identification of Certain Finfish and Shellfish Pathogens. American Fisheries Society's Fish Health Section.
- Nell, J.A. 1993. Farming the Sydney rock oyster (Saccostrea commercialis) in Australia. Reviews in Fisheries Science 1: 97-120.
- Nell, J.A. 2001. The history of oyster farming in Australia. Marine Fisheries Review 63: 14-25.
- Nell, J. 2002. The Australian oyster industry. World Aquaculture 33: 8-10.
- Nell, J.A. et R.E. Hand. 2003. Evaluation of the progeny of second-generation Sydney rock oyster Saccostrea glomerata (Gould 1850) breeding lines for resistance to QX disease Marteilia sydneyi. Aquaculture 228: 27-35.
- Nell, J.A. et B. Perkins. 2006. Evaluation of the progeny of third-generation Sydney rock oyster Saccostrea glomerata (Gould 1850) breeding lines for resistance to QX disease Marteilia sydneyi and winter mortality Bonamia roughleyi. Aquaculture Research 37: 693-700.
- Nell, J.A., I.R. Smith et C.C. McPhee. 2000. The Sydney rock oyster Saccostrea glomerata (Gould 1850) breeding program: progress and goals. Aquaculture Research 31: 45-49.
- Newton, K., R. Peters et D. Raftos. 2004. Phenoloxidase and QX disease resistance in Sydney rock oysters (Saccostrea glomerata). Developmental and Comparative Immunology 28: 565-569.
- Perkins, F.O. et P.H. Wolf. 1976. Fine structure of Marteilia sydneyi sp. n. - haplosporidan pathogen of Australian oysters. The Journal of Parasitology 62: 528-538.
- Peters, R. et D.A. Raftos. 2003. The role of phenoloxidase suppression in QX disease outbreaks among Sydney rock oysters (Saccostrea glomerata). Aquaculture 223: 29-39.
- Potter, M.A. 1983. Growth rates of cultivated Sydney rock oysters, Saccostrea (Crassostrea) commercialis, in two estuaries in subtropical southern Queensland. Queensland Journal of Agriculture and Animal Science 40: 137-140.
- Roubal, F.R., J. Masel et R.J.G. Lester. 1989. Studies on Marteilia sydneyi, agent of QX disease in the Sydney rock oyster, Saccostrea commercialis, with implications for its life cycle. Australian Journal of Marine and Freshwater Research 40: 155-167.
- Rubio, A., J. Frances, P. Coad, J. Stubbs et K. Guise. 2013. The onset and termination of the QX Disease window of infection in Sydney rock oyster (Saccostrea glomerata) cultivated in the Hawkesbury River, NSW, Australia. Journal of Shellfish Research 32: 483-496.
- Simonian, M., S.V. Nair, W.A. O'connor et D.A. Raftos. 2009a. Protein markers of Marteilia sydneyi infection in Sydney rock oysters, Saccostrea glomerata. Journal of Fish Diseases 32: 367-375.
- Simonian, M., S.V. Nair, J.A. Nell et D.A. Raftos. 2009b. Proteomic clues to the identification of QX disease-resistance biomarkers in selectively bred Sydney rock oysters, Saccostrea glomerata. Journal of Proteomics 73: 209-217.
- Taveekijakarn, P., G. Nash, T. Somsiri et S. Putinaowarat. 2002. Marteilia -like species: first report in Thailand. The Aquatic Animal Health Research Institute Newsletter 11: 1-2.
- Taveekijakarn, P., T. Somsiri, S. Puttinaowarat, S. Tundavanitj, S. Chinabut et G. Nash. 2008. Parasitic fauna of rock oyster (Saccostrea forskali) cultured in Thailand. In: Bondad-Reantaso, M.G., Mohan, C.V., Crumlish, M. and Subasinghe, R.P. (eds.) Diseases in Asian Aquaculture VI. Fish Health Section, Asian Fisheries Society, Manila, Philippines, pp. 335-342. Proceedings of The Sixth Symposium on Diseases in Asian Aquaculture held in Colombo, Sri Lanka in 2005.
- Ward, G.M., M. Bennett, K. Bateman, G.D. Stentiford, R. Kerr, S.W. Feist, S.T. Williams, C. Berney et D. Bass. 2016. A new phylogeny and environmental DNA insight into paramyxids: an increasingly important but enigmatic clade of protistan parasites of marine invertebrates. International Journal of Parasitology 46: 605-619.
- Wesche, S.J. 1995. Outbreaks of Marteilia sydneyi in Sydney rock oysters and their relationship with environmental pH. Bulletin of the European Association of Fish Pathologists 15: 23-27.
- Wesche, S.J., R.D. Adlard et R.J.G. Lester. 1999. Survival of spores of the oyster pathogen Marteilia sydneyi (Protozoa, Paramyxea) as assessed using fluorogenic dyes. Diseases of Aquatic Organisms 36: 221-226.
- Wisely, B., J.E. Holliday et B.L. Reid. 1979. Experimental deepwater culture of the Sydney rock oyster (Crassostrea commercialis = Saccostrea cucullata). 1. Growth of vertical clumps of oysters (“ren”). Aquaculture 16: 127-140.
- Wolf, P.H. 1972. Occurrence of a haplosporidan in Sydney rock oysters Crassostrea commercialis from Moreton Bay, Queensland, Australia. Journal of Invertebrate Pathology 19: 416-417.
- Wolf, P.H. 1977. Diseases and parasites in Australian commercial shellfish. Haliotis 8: 75-83.
- Wolf, P.H. 1979. Life cycle and ecology of Marteilia sydneyi in the Australian oyster, Crassostrea commercialis. Marine Fisheries Review 41 (1-2): 70-72.
Information de citation
Bower, S.M. (2019): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Marteilia sydneyi of Oysters
Date de la dernière révision : Novembre 2020
Faire parvenir les commentaires à Susan Bower
- Date de modification :