Marteiliose des palourdes et coques
Sur cette page
Catégorie
Catégorie 1 (non observée au Canada)
Nom courants et généralement admis de l'organisme ou de l'agent pathogène
Marteiliose des palourdes.
Nom scientifique ou classification taxonomique
Marteilia chriestenseni, Marteilia cochillia, Eomarteilia (=Marteilia) granula, Marteilia octospora, Marteilia tapetis, Marteilia refringens et Marteilia sp., a été signalé chez diverses espèces de palourdes et de coques dans les eaux côtières d'Europe et d'Asie. Le parasite Marteilia spp. classé dans le phylum Paramyxea par le passé (Berth et al. 2004) était transféré au phylum Cercozoa et à l'ordre Paramyxida (Cavalier-Smith et Chao 2003, Feist et al. 2009). Les spores tricellulaires permettent de distinguer Marteilia et Eomarteilia d'autres genres paramyxides. Le nombre maximal de cellules secondaires (primordiums des sporanges) dans une cellule primaire (sporangiosorus), en combinaison avec le nombre maximal de spores dans chaque cellule secondaire, est habituellement propre à l'espèce de Marteilia spp. (Carrasco et al. 2013). Dans certains cas, l'analyse moléculaire a été utilisée pour déterminer les affiliations taxonomiques avec des espèces décrites (p. ex., Marteilia refringens et Marteilia sydneyi). Dans d'autres cas, on connaît peu de choses sur l'identité de l'espèce (p. ex., une espèce non nommée de parasite de type Marteilia chez Tridacna maxima). Itoh et al. (2014) ont indiqué que les caractérisations moléculaires et morphologiques sont nécessaires pour l'identification d'espèces inconnues. Dans le texte suivant, on a attribué à chaque espèce de Marteilia et parasite s'apparentant à Marteilia une lettre code qui est appliquée de manière uniforme à tous les renseignements sous chaque en-tête.
- Marteilia christenseni décrit à partir de la mye Scrobicularia plana (=piperata) par Combs (1983 [1985]). Le nombre de cellules secondaires dans chaque cellule primaire n'était pas indiqué, mais chaque cellule secondaire contenait quatre spores (Combs 1983 [1985]).
- Marteilia cochillia décrit à partir de coques Cerastoderma edule par Carrasco et al. (2013) et appelé Marteilia génotype « C » dans les rapports antérieurs (Carrasco et al. 2012, Arzul et al. 2014). Ce parasite a d'abord été caractérisé comme ayant quatre cellules secondaires dans chaque cellule primaire (sporangiosorus) (Carrasco et al., 2013) mais Villalba et al. (2014) ont suggéré que jusqu'à huit cellules secondaires dans une cellule primaire après avoir étudié les coupes histologiques successives de M. cochillia. Cependant, on dénombre six spores par cellule secondaire (Carrasco et al. 2013, Villalba et al. 2014).
- Eomarteilia (=Marteilia) granula décrit à partir de la mye Ruditapes (=Venerupis) philippinarum (Itoh et al. 2014). Habituellement, huit cellules secondaires (sporontes) étaient présentes dans chaque cellule primaire (sporangiosorus) et quatre spores étaient contenues dans chaque cellule secondaire (Itoh et al. 2014). En se basant sur l'analyse moléculaire de l'ADNr 18S de Marteilia granula comparativement à d'autres espèces des lignées des Paramyxea, Ward et al. (2016) ont proposé de transférer cette espèce dans un nouveau genre, Eomarteilia, pour éviter que le genre Marteilia ne soit dit paraphylétique. Cette proposition a été acceptée par Kerr et al. (2018) et sera utilisée dans le texte suivant. Les caractéristiques morphologiques du genre Eomarteilia n'ayant pas été établies, donc E. granula conserve, sur cette page web, son rang de troisième espèce nommée dans le groupe des Paramyxida décrite à partir des myes et des coques. Le parasite Marteilia sp. (possiblement M. tapetis) signalé par Itoh et al. (2005) chez la même espèce de mye de la préfecture de Yamaguchi (Japon) présentait quelques différences morphologiques par rapport à E. granula et une autre espèce de Marteilia sp. (probablement M. tapetis) isolée à partir de R. philippinarum en Corée avait un ADN qui ne réagissait pas avec les amorces spécifiques développées pour E. granula (Itoh et al. 2014).
- Marteilia octospora décrit à partir du couteau-gaine, Solen marginatus par Ruiz et al. (2016). Ce parasite avait quatre cellules secondaires dans chaque cellule primaire (sporangiosorus) et huit spores plus quatre noyaux étaient contenus dans chaque cellule secondaire (sporange) (Ruiz et al. 2016).
- Marteilia tapetis décrit à partir de la mye Ruditapes philippinarum (Kang et al. 2019). Un grand nombre d'inclusions striées denses aux électrons et un petit nombre de granules réfringents étaient présents dans le cytoplasme de la cellule primaire et chaque cellule primaire produisait quatre cellules secondaires contenant chacune quatre spores tricellulaires (Kang et al. 2019).
- Bien que Marteilia refringens soit un agent pathogène reconnu des huîtres et des moules, il a été signalé chez plusieurs espèces de mye (López-Flores et al. 2008a, b; Boyer et al. 2013).
- En plus du parasite Marteilia spp. indiqué plus haut, une espèce non identifiée de Marteilia et des parasites s'apparentant à Marteilia ont été signalés chez plusieurs autres espèces de myes (Comps et al. 1975, Poder et al. 1983, Auffret and Poder 1987, Norton et al. 1993, Villalba et al. 1999, Ceschia et al. 2001, Berthe et al. 2004, Itoh et al. 2005, 2014, Carrasco et al. 2015, Carballa et al. 2016).
Répartition géographique
- Le parasite Marteilia christenseni a été décrit chez la myeScrobicularia plana dans la région de Ronce-les-Bains, dans le bassin de Marennes-Oléron, en France, sur la côte atlantique (Combs 1983 [1985]).
- Marteilia cochillia a été décrit chez les coques Cerastoderma edule du delta de l'Èbre, dans le sud de la Catalogne, en Espagne, par Carrasco et al. (2013). En 2012, M. cochillia a été associé à l'effondrement de la pêche au C. edule à Ria de Arousa, en Galice, au nord-ouest de l'Espagne (Villalba et al. 2014). A Marteilia sp. a aussi été signalé chez Cerastoderma (=Cardium) edule dansl'estuaire de la rivière d'Auray en Bretagne (France) (Comps et al. 1975) et dans les zones du nord de la Bretagne où l'on pratique l'élevage des huîtres, en France (Poder et al. 1983, Auffret et Poder 1987).
- Eomarteilia (=Marteilia) granula a été décrit chez la mye Ruditapes (=Venerupis) philippinarum de la baie d'Odawa, dans la péninsule de Miura, au Japon (Itoh et al. 2014). Le parasite Marteilia sp. détecté chez les R. philippinarum d'Iwakuni, dans la préfecture de Yamaguchi, au Japon (Itoh et al. 2005) et en Corée n'est pas la même espèce que E. granula (Itoh et al. 2014) et pourrait être M. tapetis (Kang et al. 2019).
- Côtes nord-ouest (Galice) (López et Darriba 2006, et Ruiz et al. 2016).
- Marteilia tapetis a été décrit chez la mye Ruditapes philippinarum provenant de trois emplacements le long de la côte sud-est de la Corée, spécifiquement dans les baies semi-fermées de Goheung, de Yeosu et de Tongyoung (Kang et al. 2019). Il provenait possiblement aussi d'Iwakuni, de la préfecture de Yamaguchi au Japon où Itoh et al. (2005) ont détecté un parasite Marteilia sp. chez R. philippinarum. (Kang et al. 2019).
- Marteilia refringens a été signalé chez les myes comme suit : Solen marginatus de Huelva, sur la côte sud-ouest de (Andalucía) l'Espagne (M. refringens de type M López-Flores et al. 2008a) et Chamelea gallina des îles Baléares, au large de la côte méditerranéenne de l'Espagne (López-Flores et al. 2008b). Cependant, dans l'étang de Thau, sur la côte méditerranéenne de France, Boyer et al. (2013) ont signalé la présence de cellules nécrotiques de M. refringens dans l'épithélium du tube digestif de certaines myes Ruditapes decussatus et ont affirmé que cette espèce de mye n'était pas impliquée dans le cycle vital du parasite.
- Marteilia sp. et des parasites s'apparentant à Marteilia ont été signalés chez les coques et les myes suivantes : Cerastoderma edule de l'estuaire de la rivière d'Auray, en Bretagne (France) (Comps et al. 1975) et du nord de la Bretagne (Poder et al. 1983); Venerupis corrugata(=Tapes pullastra) et Polititapes(=Venerupis) rhomboides des zones de la Bretagne (France) où l'on pratique l'élevage des huîtres (Poder et al. 1983, Auffret et Poder 1987); Polititapes(=Tapes) rhomboides de l'Ensenada de Riveira et de la Ria de Arousa en Galice, au nord-ouest de l'Espagne (Villalba et al. 1999); Enis minor et Enis siliqua de lacôte nord-est de l'Italie, dans la mer Adriatique (Ceschia et al. 2001, Berthe et al. 2004, Carrasco et al. 2015); Ruditapes philippinarum d'Iwakuni, dans la préfecture de Yamaguchi, au Japon (Itoh et al. 2005) et de Corée (Itoh et al. 2014); et Tridacna maxima de l'île Makogai, aux îles Fidji (Norton et al. 1993).
Espèces hôtes
- Le parasite Marteilia christenseni a été signalé chez les Scrobicularia plana (=piperata) sur la côte atlantique française (Combs 1983 [1985]).
- Marteilia cochillia a été signalé chez Cerastoderma edule sur la côte méditerranéenne de l'Espagne (Carrasco et al. 2011, 2012, 2013), à Ria de Arousa, en Galice, au nord-ouest de l'Espagne (Villalba et al. 2014) et possiblement chez Cerastoderma (=Cardium) edule sur la côte bretonne, en France (Comps et al. 1975, Poder et al. 1983, Auffret et Poder 1987). Bien que des plasmodes ressemblant au parasite s'apparentant à Marteilia aux stades immatures aient été observés dans l'épithélium stomacal de quelques Cerastoderma glaucum de la Ría de Arousa, en Galice, l'espèce C. glaucum n'a pas été gravement touchée par M. cochillia, alors que l'espèce sympatrique C. edule a subi une forte épidémie de ce parasite associée à une mortalité massive (Carballa et al. 2016).
- Le parasite Eomarteilia (=Marteilia) granula a été signalé chez les Ruditapes (= Venerupis, = Tapes) philippinarum à un endroit au Japon (Itoh et al. 2014). Des espèces non identifiées de Marteilia (possiblement M. tapetis) sont également présentes chez les R. philippinarum au Japon (Itoh et al., 2005) et en Corée (Itoh et al. 2014).
- Le parasite Marteilia octospora a été décrit chez les Solen marginatus provenant de Ria de Arousa, en Galice, au nord-ouest de l'Espagne (López et Darriba 2006, Ruiz et al. 2016).
- Marteilia tapetis a été décrit chez les Rupitapes philippinarum provenant de la côte sud-est de la Corée (Kang et al. 2019).
- Outre les huîtres et les moules, le parasite Marteilia refringens a été signalé chez Solen marginatus (López-Flores et al. 2008a), Chamelea gallina (López-Flores et al. 2008b) et des cellules d'aspect nécrotique ont été détectées chez R. decussatus (Boyer et al. 2013).
- On a signalé la présence de Marteilia sp. et de parasites s'apparentant à Marteilia chez les coques et myes suivantes : Cerastoderma edule provenant de la Bretagne, en France (Comps et al. 1975, Poder et al. 1983, Auffret et Poder 1987); Venerupis corrugata (= Tapes pullastra), Polititapes (=Venerupis, =Tapes) rhomboides provenant de la Bretagne, en France (Poder et al. 1983, Auffret et Poder 1987); Polititapes (= Tapes) rhomboides et Ruditapes decussatus en Galice, au nord-ouest de l'Espagne (Villalba et al. 1999, Carrasco et al. 2015); Ensis minor, Ensis siliqua provenant de la côte nord-est de l'Italie, dans la mer Adriatique (Ceschia et al. 2001, Berthe et al. 2004, Carrasco et al. 2015); Ruditapes philippinarum provenant du Japon et de la Corée (Itoh et al. 2005, 2014); et Tridacna maxima provenant de l'île Makogai, aux îles Fidji (Norton et al. 1993).
Impact sur les hôtes
- Non signalé. Les infections chez les Scrobicularia plana examinées par Comps (1983 [1985]) étaient toutes bénignes et ne présentaient aucune lésion grave associée. Depuis 1983, aucune information n'a été enregistrée sur M. christenseni ou son hôte (Carrasco et al. 2015).
- Sur la côte méditerranéenne de l'Espagne, un épisode de mortalité chez les coques (Cerastoderma edule) au cours du mois d'août 2008 a été potentiellement associé au parasite Marteilia sp. (identifié par la suite comme M. cochillia) où la prévalence de l'infection était significative (40 % des 30 coques échantillonnées) et où la plupart des individus présentait une forte intensité de l'infection (Carrasco et al. 2011, 2013). En mai 2010 et janvier et mars 2013, un parasite Marteilia sp. (vraisemblablement M. cochillia) avec une prévalence d'environ 23 %, 33 % et 100 % respectivement, a été observé chez C. edule provenant de la baie des Alfacs, dans le delta de l'Èbre, lors d'un dépistage prévu. À partir de l'automne 2012, la mortalité progressive des C. edule dans la plupart des bancs a été enregistrée par les pêcheurs de mollusques dans les deux baies du delta de l'Èbre, et elle a eu une incidence sur le commerce local de C. edule en 2013. Ainsi, l'incidence de M. cochillia sur les bancs de coques, en termes écologiques et économiques, semble être digne d'intérêt, car elle a entraîné des mortalités et des pertes économiques élevées (Carrasco et al. 2013). Dans la Ría de Arousa, en Galice, au nord-ouest de l'Espagne, le parasite M. cochillia a été détecté pour la première fois dans un banc de C. edule en février 2012. Il a atteint une prévalence de 100 % en avril 2012, a été associé à des épisodes de mortalité massive sur ce banc en mai 2012 et a causé un effondrement total de la pêche dans toute la Ría de Arousa en septembre 2012 (Villalba et al. 2014). Ce parasite continue de causer de graves problèmes à la coque sur les gisements et la pêche commerciale à la coque est fortement touchée (Carrasco et al. 2015). Dans la Ria de Arousa, la coque Cerastoderma glaucum, qui est sympatrique avec C. edule dans certaines zones, semble résister à M. cochillia peut-être en raison de tubes digestifs dont la morphologie diffère (Carballa et al. 2016). Plus précisément, les tubules digestifs de C. glaucum contenaient simultanément des cellules épithéliales à différentes phases (c.-à-d. phases de maintien, d'absorption, de digestion ou d'excrétion) et on observait une proportion importante de tubules digestifs dans la phase de décomposition désintégrée (c.-à-d. perte d'intégrité épithéliale s'accompagnant d'une faible distinction entre les cellules individuelles qui étaient habituellement dépourvues de noyaux et qui contenaient des dépôts brunâtres et autres débris cellulaires), tandis que les tubules digestifs de C. edule présentaient une synchronicité et on observait une absence de tubules complètement désintégrés. Ces différences pourraient influer sur la vulnérabilité à l'égard de M. cochillia, car la principale localisation de ce parasite chez C. edule est l'épithélium des tubules de la glande digestive (Carballa et al. 2016). Cependant, Marteilia cochillia représente une menace notable pour une espèce importante de la pêche en Europe (Alfjorden et al. 2017). La microsporidie hyperparasite Hyperspora aquatica a été décrite à partir de cellules primaires de M. cochillia qui infectent les C. edule et qui ont été prélevées dans la Ría de Arousa, en Galice, au nord-ouest de l'Espagne (Stentiford et al. 2017).
- Le parasite Eomarteilia (= Marteilia) granula a été détecté en 2011 et 2012, mais aucune mortalité remarquable n'a été observée même si certains individus des myes Ruditapes philippinarum ont été fortement infectés. Une espèce différente non identifiée de Marteilia a été détectée pour la première fois en octobre 2003 dans l'épithélium des tubules digestifs parmi les 40 myes implantées expérimentalement en avril 2002 pour étudier le déclin abrupt des stocks commerciaux de R. philippinarum dans la région. Dans les deux cas, aucune réaction de l'hôte telle que l'infiltration hémocytaire, la dégénérescence tissulaire ou la nécrose n'a été observée en association avec l'infection (Itoh et al. 2005, 2014). Comme les autres espèces de Marteilia sont connues pour être pathogènes pour leurs hôtes respectifs, des recherches supplémentaires sont nécessaires avant que l'incidence de ces Marteilia spp. sur R. philippinarum soit établie.
- En Galice (Espagne), aucune mortalité chez Solen marginatus n'a été associée à une infection par Marteilia octospora. Des enquêtes sur les parasites et les maladies chez S. marginatus dans 17 gisements répartis le long de la côte galicienne entre 2008 et 2011 ont permis de détecter Marteilia sp. chez 6 d'entre eux. Dans tous ces cas, ce parasite présentait une faible prévalence, une intensité modérée et aucun effet négatif n'avait été détecté sur les populations de S. marginatus (Ruiz et al., 2015). López et Darriba (2006) ont affirmé que la prévalence et l'intensité de l'infection étaient plus élevées en été et qu'une forte intensité de l'infection n'avait été détectée qu'en août, lorsque la prévalence avait varié de 38 à 42 %.
- La prévalence de l'infection par Marteilia tapetis chez les myes (R. philippinarum) de la Corée du Sud était faible (de 0,5 à 13,3 %) au cours des études histopathologiques menées entre 2009 et 2014. Aucun signe pathologique, notamment aucune altération des tissus hôtes, comme l'infiltration hémocytaire et la nécrose tissulaire, n'a été observé dans les tissus des myes infectées (Kang et al. 2019).
- Bien que Marteilia refringens soit un pathogène connu des huîtres et des moules, on dispose de peu d'information sur l'incidence de M. refringens sur les myes (Carrasco et al. 2015). Le parasite Marteilia refringens a été détecté chez 20 % (9 sur 46 analysés en examinant des frottis de la glande digestive) de Solen marginatus (López-Flores et al. 2008a). Ce parasite a aussi été détecté chez 4,4 % (3 sur 69) de l'espèce Chamelea gallina examinée au cours d'une étude histopathologique menée pour découvrir la cause d'une mortalité massive chez cette espèce de mye (López-Flores et al. 2008b). Dans les deux cas, différents stades de développement de M. refringens ont été observés dans la glande digestive, ce qui indique la présence d'une infection comme celle constatée chez les huîtres et les moules.
- Comps et al. (1975) ont détecté Marteilia sp chez 10 % de Cerastoderma edule provenant d'un emplacement sur la côte sud de la Bretagne, en France, où de nombreuses coques étaient moribondes à la surface de la plage. Villalba et al. (1999) ont détecté un parasite de l'ordre des Paramyxea de type Marteilia chez 7 % du naissain de Polititapes (= Venerupis) rhomboides (longueur de coquille de 22,6 ± 1,21 mm) provenant d'un emplacement en Galice (Espagne). La faible prévalence des infections par le parasite de l'ordre des Paramyxea s'apparentant à Marteilia chez ces myes a indiqué qu'il n'était pas impliqué dans les mortalités faisant l'objet d'une enquête (Villalba et al. 1999). Le parasite Marteilia sp. a été détecté chez un tridacne d'apparence normale Tridacna maxima(longueur de coquille de 18 cm) sélectionné aléatoirement parmi plusieurs qui ont été prélevés dans la nature pour être utilisés aux fins de reproduction (Norton et al. 1993). Le déplacement de la majeure partie du tissu rénal par les structures kystoïdes semblait indiquer que cet organisme s'apparentant à Marteilia est potentiellement pathogène pour T. maxima (Norton et al. 1993).
Notez que les stades de développement de ces Marteilia sont semblables à ceux décrits pour M. refringens. Pour obtenir des détails, consultez la description fournie dans la page sur la marteiliose (maladie des Abers) des huîtres et le dessin schématique qui illustre les stades.
Techniques de diagnostic
Diagnostic brut
a. to f. Aucun signe de pathologie macroscopique n'a été signalé.
g. À l'autopsie, de nombreux foyers blanc crayeux ont été observés dans les reins rouge-brun foncé d'un tridacne Tridacna maxima (Norton et al. 1993).
Histologie
- Le parasite Marteilia christenseni présentait tous les stades de développement caractéristiques de Marteilia spp. et était présent dans les cellules épithéliales des tubules de la glande digestive. L'image publiée d'une coupe semi-fine en résine époxy, colorée à l'aide de borate de méthylène bleu, a montré des « jeunes parasites » (probablement la cellule primaire aussi appelée sporangiosorus), des « stades de la sporogenèse » (probablement les premiers stades de développement de la cellule secondaire aussi appelés primordiums des sporanges, sporontes ou sporanges) et des « stades contenant des spores matures » (probablement à l'intérieur de cellules secondaires matures) (Comps 1983 [1985]).
- Les stades de développement de M. cochillia dans la glande digestive de C. edule étaient similaires à ceux de M. refringens chez les huîtres et les moules (Carrasco et al. 2011, 2013). Marteilia cochillia a jusqu'à huit cellules ellipsoïdales secondaires (jusqu'à 15 µm de long) dans chaque cellule ellipsoïdale primaire (33 µm de long et 21 µm de large) et chaque cellule secondaire contient jusqu'à trois masses protéiques dont chacune contient deux spores (Carrasco et al. 2013, Villalba et al. 2014). Il existe donc au plus six spores par cellule secondaire. Darriba Couñago (2017) a publié des images des premiers et derniers stades de développement de M. cochillia dans les tubules de la glande digestive de C. edule. Comme c'est souvent le cas du genre, les spores sont tricellulaires et chacune de ces cellules est mononucléée. Il convient de noter qu'il est difficile de déterminer, par histologie, les caractères taxonomiques tels que le nombre de cellules secondaires et de spores, même pour un chercheur expérimenté (Carrasco et al. 2013). Comps et al. (1975) et Poder et al. (1983) ont indiqué que le parasite ressemblait à Marteilia refringens dans les coupes histologiques. Villalba et al. (2014) ont détecté les spores d'une microsporidie s'apparentant à un hyperparasite dans le cytoplasme de la cellule primaire de M. cochillia qui contenait également au moins une cellule secondaire dans laquelle des spores de M. cochillia se développaient. Des microsporidies hyperparasites ont également été signalées dans Marteilia sp. qui parasite les coques en France (Comps et al. 1975), et dans M. refringens qui infecte Ostrea edulis dans l'ouest de la France (Comps et al. 1979) et Mytilus galloprovincialis en Galice (Espagne) (Villalba et al. 1993).
- Des coupes transversales du tube digestif montrent le parasite Eomarteilia (= Marteilia) granula dans les cellules épithéliales de l'estomac, des tubules de la glande digestive et de l'intestin de R. philippinarum. Des cellules secondaires matures contenant des spores n'ont été observées que dans les tubules de la glande digestive et des spores libres matures étaient présentes dans la lumière de l'estomac et de l'intestin (Itoh et al. 2014). La caractéristique unique du clivage interne permettant de produire des cellules à l'intérieur d'autres cellules pendant la sporulation, qui différencie les Marteilia spp. de tous les autres protistes, était visible chez E. granula. Les cellules primaires (sporangiosorus) étaient de 18,9 ± 2,5 µm (Itoh et al. 2014). Les cellules primaires les plus développées contenaient huit cellules secondaires avec quatre spores dans chacune d'elles (Itoh et al., 2014). Le parasite Marteilia sp. (possiblement M. tapetis) observé dans la glande digestive d'une mye R. philippinarum de Yamaguchi, dans l'ouest du Japon, avait quatre cellules secondaires (sporontes) contenant chacune deux spores dans chaque cellule primaire (sporanges) (Itoh et al. 2005) et ce parasite avait moins de granules éosinophiles (« réfringents ») que E. granula (Carrasco et al. 2015).
- Les cellules primaires de Marteilia octospora étaient de forme éosinophile, sphérique ou allongée, uninucléées ou multinucléées et elles se trouvaient dans ou entre les cellules épithéliales digestives des conduits et des tubules digestifs de S. marginatus. Des stades de développement plus avancés, y compris des cellules secondaires (sporanges) contenant différents stades de sporulation, ont également été observés dans ces tissus et ils étaient plus abondants que les cellules primaires. Le stade de maturité a été trouvé libre dans la lumière des tubules digestifs (López et Darriba 2006, Ruiz et al. 2016). Pour obtenir des images en couleur, voir López et al. (2011).
- Des stades de développement de Marteilia tapetis ont été observés dans les cellules épithéliales du tubule digestif de R. philippinarum. Les cellules primaires au premier stade étaient de forme ovale (de 4,6 à 14,0 μm de diamètre), et les cellules primaires matures avaient un petit nombre de granules éosinophiles et contenaient quatre cellules secondaires, dans lesquelles deux à quatre spores étaient observées. Les spores matures mesuraient de 11,9 à 17,4 μm de diamètre et étaient parfois observées dans les lumières des tubules digestifs (Kang et al. 2019). Kang et al. (2019) ont également remarqué que toutes les myes infectées par M. tapetis étaient co-infectées par les trophozoïtes du protozoaire parasite, Perkinsus olseni que l'on trouvait surtout dans les branchies et les tissus du manteau des myes.
- Des stades de développement classiques de M. refringens n'ont été constatés que dans l'épithélium des diverticules digestifs de S. marginatus (López-Flores et al. 2008a) et de C. gallina (López-Flores et al. 2008b). Des stades morphologiques habituels de Marteilia ont été observés dans l'épithélium de la glande digestive de diverses myes infectées par un parasite Marteilia sp. non identifié (Poder et al. 1983, Auffret et Poder 1987, Villalba et al. 1999, Berthe et al. 2004, Carrasco et al. 2015). Des stades morphologiques habituels de Marteilia ont été observés dans l'épithélium de la glande digestive de diverses myes infectées par un parasite Marteilia sp. non identifié (Poder et al. 1983, Auffret et Poder 1987, Villalba et al. 1999, Berthe et al. 2004, Carrasco et al. 2015).
- Cependant, Norton et al. (1993) ont signalé que dans des coupes histologiques, les reins de Tridacna maxima infectés par un parasite s'apparentant à Marteilia apparaissaient comme de nombreuses structures kystoïdes bordées d'épithélium cylindrique cilié. Ces structures semblaient être le résultat d'une prolifération de la paroi épithéliale ciliée des conduits dans le rein. À l'intérieur des kystes se trouvaient des groupes de cellules protistes s'apparentant à Marteilia. Les plus petites cellules mesuraient environ 2 µm de diamètre et étaient ponctuées de noyaux foncés et comportaient des cytoplasmes gris (coloration à l'hématoxyline et à l'éosine). Ces cellules étaient incluses dans une unité cellulaire d'environ 4 µm de diamètre qui se colorait également en gris. À une certaine distance de la paroi épithéliale, ces cellules étaient d'une couleur éosinophile, elles présentaient des traits indistincts et contenaient des corps d'inclusion réfringents de forme irrégulière (Norton et al. 1993).
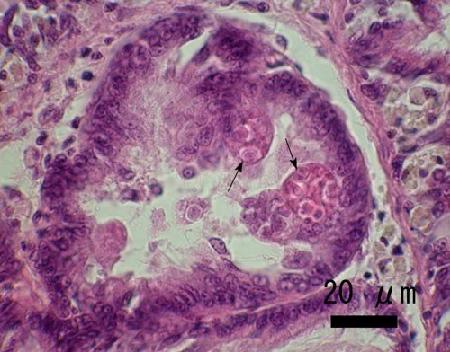
Figure 1. Des cellules secondaires matures (flèches) contenant des spores de Marteilia sp. en développement dans l'épithélium des tubules de la glande digestive d'une mye Ruditapes (= Venerupis) philippinarum provenant d'Iwakuni, dans la préfecture de Yamaguchi, au Japon.
Empreintes tissulaires
Les empreintes tissulaires sont une technique rapide qui peut convenir pour déterminer le nombre de spores par cellule secondaire, une caractéristique qui permet de différencier les espèces de Marteilia. Le procédé consiste à faire des empreintes ou des frottis d'empreinte avec un morceau de tissu frais infecté sur une lame de microscope en verre, à sécher la préparation à l'air, puis à la fixer à l'acétone (ou au méthanol). Une fois que la lame a séché, appliquer une coloration Wright, Wright-Giemsa, May-Grunwald-Giemsa ou une coloration équivalente (p. ex. Hemacolor, Merck; Diff-QuiK, Baxter). Le montage d'une lamelle sur la préparation réduira la réfraction de la lumière, ce qui rendra les parasites plus visibles.
- Non signalées pour Marteilia christenseni.
- Les cellules secondaires libres (= primordiums des sporanges, sporontes ou sporanges) de M. cochillia ont un cytoplasme finement granulé et contiennent six spores, chacune ayant jusqu'à trois noyaux très petits, et jusqu'à trois noyaux de spores supplémentaires (Villalba et al. 2014). Il convient de noter que dans les endroits géographiques où le parasite M. cochillia était relevé chez les C. edule, Villalba et al. (2014), ont détecté une prévalence de l'infection plus élevée dans des coupes histologiques que dans des empreintes tissulaires.
- Itoh et al. (2014) ont utilisé des empreintes tissulaires pour quantifier la taille des cellules secondaires (axes majeurs et mineurs de 11,2 ± 1,2 X 8,5 ± 0,8 µm), des spores (5,0 ± 0,9 µm de diamètre) et des granules éosinophiles (réfringents?) (9 à 18 par cellule secondaire mesurant chacun 2,1 ± 0,7 µm de diamètre) pour E. granula. Cependant, le procédé d'empreintes tissulaires a entraîné la rupture des cellules primaires, ce qui a nécessité l'utilisation de techniques histologiques pour caractériser cette étape du cycle vital au niveau de grossissement du microscope optique. Les cellules secondaires matures du parasite E. granula contenaient quatre spores et de gros granules (équivalents à des granules « réfringents ») qui se coloraient en bleu foncé avec Diff-QuiK.
- Les empreintes tissulaires étaient essentielles pour Ruiz et al. (2016) pour confirmer la présence de huit spores par cellule secondaire (sporange) pour le parasite M. octospora, un nombre jamais signalé pour d'autres parasites Marteilia spp. En plus des spores, chaque cellule secondaire contenait également quatre noyaux (Ruiz et al. 2016). Le rapport initial de six spores par cellule secondaire selon López et Darriba (2006) a été déterminé à partir de coupes histologiques de S. marginatus infectées.
- Les empreintes tissulaires des tubules digestifs d'une mye (R. philippinarum) infectée par Marteilia tapetis ont montré l'existence du premier stade uninucléé (cellule primaire), ainsi que d'autres stades de développement. En revanche, des spores matures n'ont pas été observées, peut-être en raison du faible niveau d'infection (Kang et al. 2019).
- Les résultats des empreintes tissulaires (le cas échéant) n'ont pas été déclarés.
- Les résultats des empreintes tissulaires (le cas échéant) n'ont pas été déclarés.
Microscopie électronique
- À maturité, les cellules secondaires de M. christenseni contiennent des granules « réfringents » et quatre spores chacune. Les spores (entre 3,5 et 4,5 µm de diamètre) contiennent des haplosporosomes (90 à 200 nm) et ont des parois épaisses (40 à 50 nm) avec des digitations complexes qui confèrent aux spores un profil de grande variabilité. Des caractéristiques ultrastructurelles ont été utilisées pour différencier Marteilia christenseni des quatre espèces de Marteilia décrites avant 1983 (M. refringens, M. lengehi, M. sydneyi et M. maurini) (Comps 1983 [1985]). Ces caractéristiques comprenaient la morphologie de la spore (avec des dilatations des parois en forme de doigts) ainsi que la taille et le nombre de granules réfringents associés aux spores dans la cellule secondaire. Le tableau publié par Comps (1983 [1985]) indiquait que dans les parasites M. refringens, M. maurini et M. sydneyi, on observait deux à six granules réfringents par cellule secondaire dont la taille variait de 1,7 à 3,4 µm, la cellule secondaire de Marteilia sp. chez C. edule de la côte atlantique française avait environ 100 granules réfringents mesurant environ 0,3 µm, tandis que M. christenseni comptait environ 10 à 22 granules réfringents dont la taille variait de 0,5 à 0,8 µm.
- Les premiers stades parasitaires de M. cochillia comportaient des cellules primaires immatures avec des haplosporosomes et des inclusions striées et ils comprenaient une à quatre cellules secondaires entourées d'un système membraneux. Les cellules primaires aux dernières étapes de maturation (sporangiosorus) étaient ovoïdes (24 μm de longueur et 15 μm de largeur environ). Elles bourgeonnaient de façon endogène pour former environ quatre cellules secondaires (11 μm de longueur et 8 μm de largeur environ). L'apparence des cellules secondaires (primordiums des sporanges, sporontes ou sporanges) était typique de celle des Marteilia spp. avec des granules réfringents proéminents de nature potentiellement glycoprotéique, de nombreux ribosomes et un manque d'haplosporosomes (Carrasco et al. 2013). Les granules limités par une membrane, opaques aux électrons (réfringents), avaient un diamètre de 0,34 µm environ et comptaient jusqu'à 147 granules dans une coupe ultrafine de cellules secondaires matures (Villalba et al. 2014). Chaque cellule secondaire contenait également trois et potentiellement quatre « masses protéiques amorphes » (environ 8 μm de long et 6 μm de large) qui se développaient en spores (cellules tertiaires) avec jusqu'à six spores par cellule secondaire. Les spores (4,5 μm de diamètre) présentaient des haplosporosomes, des ribosomes et de longs réseaux parallèles de réticulum endoplasmique lisse, un bourgeonnement endogène de sporoplasmes (trois au total : externe, intermédiaire et interne) et une paroi des spores épaissie. Le sporoplasme intermédiaire (2,7 μm de diamètre) avait un noyau réniforme, des haplosporosomes proéminents en forme de tige et ressemblait aux sporoplasmes matures et aux spores en maturation de M. sydneyi (Carrasco et al. 2013).
- La cellule secondaire (sporonte) du parasite E. granula contenait des granules réfringents, des inclusions striées et un réticulum endoplasmique. D'ordinaire, huit cellules secondaires (sporocystes) se trouvaient dans chaque cellule primaire sporangiosorus, et quatre spores se trouvaient dans chaque cellule secondaire. Les spores matures étaient constituées de trois cellules : la cellule externe avec des haplosporosomes et des mitochondries dans le cytoplasme, la cellule intermédiaire avec des structures vésiculaires dans le cytoplasme et la cellule interne. Les spores matures étaient entourées des restes de verticilles de myéline de la cellule secondaire, la membrane interne de la spore était recouverte d'une monocouche opaque aux électrons (0,35 à 0,64 µm) qui n'a pas été signalée dans d'autres parasites Marteilia spp. et le noyau de la cellule externe était dégénéré (Itoh et al. 2014). Le parasite Marteilia sp. chez R. philippinarum d'Iwakuni, dans la préfecture de Yamaguchi, au Japon avait quatre cellules secondaires (sporontes) dans chaque cellule primaire (sporangiosorus) et deux spores étaient contenues dans chaque cellule secondaire (Itoh et al. 2005).
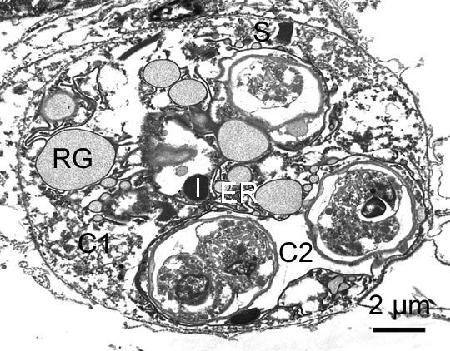
Figure 2. Cellule secondaire (sporonte) de Marteilia sp. (peut-être M. tapetis) contenant des spores en développement chez l'espèce Ruditapes philippinarum provenant d'Iwakuni, dans la préfecture de Yamaguchi, au Japon. RG, granules réfringents; S, inclusions striées; C1 et C2, cytoplasme de cellule secondaireI, corps d'inclusion; et ER, réticulum endoplasmique.
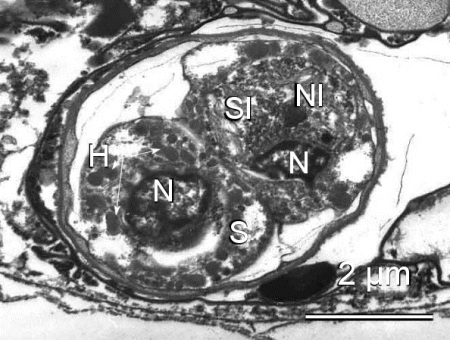
Figure 3. Spore de Marteilia sp. provenant d'une Ruditapes philippinarum du Japon. Remarquez l'épaisseur de la paroi de la spore, les haplosporosomes (H), les noyaux (N), le cytoplasme de la cellule externe (S), le cytoplasme de la cellule intermédiaire(SI) et le noyau de la cellule interne (NI).
- Les caractéristiques ultrastructurelles propres à Marteilia octospora comprennent la taille (0,6 µm de diamètre environ) et le nombre (jusqu'à 50 par coupe ultrafine) de granules opaques aux électrons (équivalents aux granules réfringents) dans le cytoplasme des cellules secondaires matures (sporanges contenant des spores matures) et l'absence d'une couche de membranes concentriques entourant la spore mature. De plus, les structures membranaires concentriques observées à différents stades du parasite n'ont jamais été mentionnées chez d'autres espèces du genre Marteilia (Ruiz et al. 2016). Les détails morphologiques signalés par López et Darriba (2006) et Ruiz et al. (2016) sont les suivants. Les cellules primaires de M. octospora étaient uninucléées, délimitées par une enveloppe (25 nm d'épaisseur environ) et souvent entourées de nombreuses mitochondries hôtes. Le cytoplasme des cellules primaires contenait de nombreux ribosomes, haplosporosomes de forme aplatie (0,07 ± 0,01 µm de long) et vermiforme (0,25 ± 0,06 µm de long et 0,06 ± 0,01 µm de large), des inclusions paracrystallines, des grands corps multivésiculaires sphériques (2,5 ± 0,8 µm de diamètre avec un intérieur sombre et granuleux contenant un nombre variable de vésicules amorphes et de membranes linéaires libres) et une multitude de structures membraneuses concentriques. Cependant, les mitochondries n'ont pas été observées à l'intérieur des cellules du parasite. Le cytoplasme de la cellule secondaire était plus dense que celui de la cellule primaire et contenait de nombreux ribosomes, haplosporosomes de taille et de forme similaires à ceux dans la cellule primaire; des corps multivésiculaires n'ont pas été constatés et des structures membranaires concentriques étaient rarement observées. Le noyau de la cellule secondaire était visible par la présence de structures membranaires concentriques. Cependant, la membrane nucléaire des cellules primaire et secondaire était similaire, avec une double membrane interrompue par des pores nucléaires et de rares membranes parallèles près de la membrane nucléaire ressemblant à un réticulum endoplasmique. La taille et le nombre de granules opaques aux électrons (« réfringents ») dans les cellules secondaires augmentaient pendant la maturation. Dans les cellules secondaires (sporanges) à spores matures, leur diamètre se situait entre 0,51 et 0,90 µm (0,65 ± 0,11 µm) et jusqu'à 50 granules étaient dénombrés dans une coupe ultrafine de cellules secondaires matures. Les spores matures (4,17 ± 0,32 µm de diamètre) étaient entourées d'une enveloppe épaisse (41,4 ± 12,8 nm) et présentaient trois sporoplasmes uninucléés ou protoplastes (externe, intermédiaire et interne) imbriqués les uns dans les autres. Le sporoplasme externe contenait des haplosporosomes sphériques (95 ± 28 nm de diamètre) et des structures membranaires concentriques. Le cytoplasme plus dense du sporoplasme intermédiaire contenait des vésicules aplaties, vermiformes et limitées par une double membrane (220 ± 37 nm de long et 54 ± 5 nm de large), de nombreux ribosomes, une inclusion sombre arrondie (195 ± 49 nm de diamètre) et un noyau. Le sporoplasme interne était le plus dense avec de nombreux ribosomes et un noyau présumé. Pour obtenir un grossissement plus élevé d'une micrographie électronique des spores, voir López et al. (2011).
- Les cellules primaires (diamètre moyen de 16,6 × 14,4 μm, n = 3) de Marteilia tapetis contenaient quatre cellules secondaires, de nombreuses inclusions striées opaques aux électrons bien réparties et quelques granules réfringents. Les cellules secondaires (diamètre moyen de 8,9 × 7,6 μm, n = 4) contenaient quatre cellules de spores tricellulaires (diamètre moyen de 4,6 × 3,8 μm, n = 13). Les spores matures étaient de forme sphérique ou ellipsoïdale et entourées d'une vésicule lisse. Le cytoplasme de la cellule sporale externe était moins dense et semblait avoir des structures vésiculaires à l'intérieur du cytoplasme, bien qu'un type de vésicule vermiforme aplatie, comme signalé pour le parasite Marteilia octospora, n'ait pas été observé. On a observé une structure de type haplosporosome opaque aux électrons dans le cytoplasme de la cellule sporale intermédiaire (Kang et al. 2019).
- L'ultrastructure de Marteilia refringens détectée chez les myes Solen marginatus, Chamelea gallina et Ruditapes decussatus n'a pas été examinée (López-Flores et al.; 2008 a, b; Boyer et al. 2013).
- L'ultrastructure de Marteilia spp. signalée chez diverses myes (à l'exception de celles indiquées ci-dessus) n'a pas été signalée, sauf pour Marteilia sp. trouvé chez les Tridacna maxima(Norton et al. 1993). En pareil cas, les cellules de 2 µm contenaient des organites vermiformes et des haplosporosomes semblables à ceux signalés dans les spores de Marteilia sydneyi et Marteilia refringens. Le cytoplasme contenant les haplosporosomes représentait le sporoplasme externe et le cytoplasme contenant des organites vermiformes avec une structure formée d'une double membrane représentait le sporoplasme intermédiaire (Norton et al. 1993).
Sondes à ADN
Les techniques moléculaires sont de plus en plus utilisées principalement comme techniques de confirmation de la présence d'un agent pathogène et dans les programmes de surveillance des maladies. Souvent, la recherche se concentre sur l'optimisation des techniques déjà décrites pour augmenter la sensibilité et la spécificité d'une analyse et sur le développement de nouvelles techniques moléculaires (p. ex. les réactions en chaîne de la polymérase [qPCR]) quantitative en temps réel, qui sont plus rapides et plus faciles à appliquer et qui permettent un diagnostic positif même aux premiers stades de l'infection. Cependant, comme l'indiquent clairement Aranguren et Figueras (2016), les outils moléculaires détectent les séquences d'ADN de l'agent pathogène, ce qui ne signifie pas que ce dernier est viable chez l'hôte et que l'infection est établie. De plus, un résultat positif de la réaction en chaîne de la polymérase (PCR) ne confirme une infection chez un hôte testé que si l'essai a été correctement validé pour la région géographique et pour les hôtes examinés(Burreson 2008). Par conséquent, les techniques moléculaires doivent être validées par rapport à d'autres techniques, comme l'histologie ou l'hybridation in situ, afin que la fiabilité d'un essai moléculaire puisse être déterminée (Aranguren et Figueras 2016).
- Aucun signalement pour M. christenseni.
- Des séquences partielles de la région de la petite sous-unité de l'ADNr 18S, de l'espaceur-transcrit interne 1 (ITS-1) et de l'espaceur intergénique de l'ADNr (IGS) de M. cochillia ont été déposées comme un parasite Marteilia sp. de type « C » dans GenBank (numéros d'accès JN820083 à JN820092 et KF314809 à KF314811) (Carrasco et al. 2012, 2013). L'analyse BLAST de ces séquences a révélé des identités maximales de 98 %, 86 % et 83 % avec M. refringens infectant l'huître plate Ostrea edulis et Chamelea gallina, pour le gène 18S, l'ITS-1 et l'IGS, respectivement (Carrasco et al. 2012). Les analyses phylogénétiques ont fourni un support de bootstrap de 100 % pour distinguer les groupes M. cochillia et M. refringens. Un diagnostic différentiel est possible par réaction en chaîne de la polymérase-polymorphisme de longueur des fragments de restriction (PCR-RFLP) à l'aide de l'enzyme de restriction Bgl II après l'amplification de l'espaceur intergénique (IGS), comme le décrivent López-Flores et al. (2004). L'enzyme coupe l'amplicon de 358 paires de bases du parasite M. cochillia en deux fragments de 192 et 166 paires de base, tandis qu'aucune digestion n'est observée pour M. refringens (Carrasco et al. 2012, 2013). Villalba et al. (2014) ont créé un essai de PCR pour le diagnostic précis de M. cochillia.L'analyse par hybridation in situ peut servir à confirmer la présence de Marteilia spp. dans les tissus de la glande digestive de C. edule (Carrasco et al. 2011).
- Un segment de 1 784 paires de bases du génome de l'ARN ribosomique de la petite sous-unité (SSU ou 18S) a été identifié pour E. granula (Itoh et al. 2014). La recherche BLAST a révélé que ce segment avait 79 % et 75 % d'identités appartenant à M. refringens chez Ostrea edulis et M. chungmuensis, respectivement. Une analyse phylogénétique plus approfondie (méthode Neighbour-joining et probabilité maximale) a permis de clairement distinguer E. granula de toutes les autres espèces connues de Marteilia (Itoh et al. 2014). Ward et al (2016) ont comparé l'ADNr 18S du parasite E. granula à celui d'autres espèces des lignées des Paramyxea et ont suggéré de transférer cette espèce à un nouveau genre, Eomarteilia, pour éviter que le genre Marteilia ne soit dit paraphylétique. Une réaction en chaîne de la polymérase (PCR) a été conçue pour amplifier un produit de 260 paires de bases à partir d'ADN d'E. granula qui n'a pas amplifié l'ADN d'autres espèces de Marteilia. Une des sondes utilisées dans cette PCR et deux autres ont été conçues pour un essai d'hybridation in situ qui ne réagissait pas non plus avec les autres espèces de Marteilia qui étaient soumises aux essais (Itoh et al. 2014).
- L'analyse moléculaire de l'espaceur intergénique (IGS) de l'ADNr ribosomique et de l'espaceur transcrit interne (ITS-1) de M. octospora a montré des différences avec les séquences disponibles d'autres espèces de Marteilia spp. Plus précisément, l'analyse phylogénétique a suggéré une homologie de 84 % et de 86 % avec l'ITS-1 et l'IGS, respectivement, pour le parasite M. refringens chez les huîtres et une homologie de 82 % avec l'IGS pour le parasite M. refringens chez le même hôte (S. marginatus) dans le sud de l'Espagne (Ruiz et al. 2016). La comparaison avec M. cochillia a montré une homologie plus élevée dans les régions de l'ITS-1 (96 %) et de l'IGS (97 %), mais la requête ne couvrait que 62 % du gène dans la comparaison avec l'IGS. Bien que López-Flores et al. (2004) aient considéré l'IGS comme un marqueur utile pour différencier les espèces de Marteilia en raison de sa grande variabilité et de l'évolution plus rapide de sa séquence par rapport aux régions de l'ITS de l'ADNr, Carrasco et al. (2015) ont déclaré que la base de données en matière de séquences d'ADN disponible pour les parasites des Paramyxea demeure faible et nécessite des recherches supplémentaires. De plus, le court fragment du gène 18S disponible pour M. octospora, bien qu'il ne se trouve pas dans la région la plus variable du gène, est presque identique à la région correspondante de M. cochillia (Ward et al. 2016). Ainsi, Ruiz et al. (2016) ont indiqué que les différences morphologiques étaient plus concluantes que l'analyse moléculaire pour l'identification de M. octospora. Cependant, les amorces spécifiques basées sur la région de l'ITS1 conçue par Villalba et al. (2014) pour détecter M. cochillia n'ont pas amplifié l'ADN extrait du mollusque S. marginatus infecté par M. octospora (Ruiz et al., 2016).
- Un segment de 1 741 paires de bases du génome de l'ARN ribosomique de la petite sous-unité (SSU ou 18S) (numéro d'accès AB823743 dans GenBank) a été identifié pour Marteilia tapetis (Kang et al. 2019). L'analyse BLAST a révélé que la séquence de M. tapetis affichait des similitudes importantes (89,9 %) avec les séquences de l'ADNr de la petite sous-unité de Marteilia sydneyi (AB823742) chez les huîtres de roche de Sydney en Australie et qu'elle était moins similaire aux séquences de l'ADNr de la petite sous-unité d'autres espèces de Marteilia : elle était similaire à 89,6 % aux séquences du parasite M. refringens de type M (AB889894) provenant d'Espagne, à 89,5 % aux séquences du parasite M. cochillia (AB889895) provenant d'Espagne et à 78,8 % aux séquences du parasite E. (M.) granula (AB856587) provenant du Japon. De plus, des analyses phylogénétiques (inférées à partir d'évaluations par la méthode du Neighbor-joining et de parcimonie maximale) ont révélé que les trois endroits différents dans le sud-est de la Corée, regroupés pour former un clade unique duquel les séquences de l'ADNr de la petite sous-unité de six isolats de M. tapetis provenaient, était un groupe génétiquement distinct de toutes les espèces décrites de Marteilia spp. (Kang et al. 2019).
- Des outils moléculaires décrits pour la détection de M. refringens ont été utilisés pour détecter ce parasite chez diverses espèces de myes. Plus précisément, l'analyse de l'IGS de l'ADNr produit indiquait qu'il s'agissait entre 98,2 et 99,5 % de M. refringens se trouvant dans la variante contenant des souches de parasites principalement isolées chez des moules (López-Flores et al. 2008a). L'analyse d'hybridation in situ a montré différents stades de développement du parasite dans l'épithélium des diverticules digestifs, ce qui suggérait un véritable parasitisme chez ces individus (López-Flores et al. 2008a). Un fragment de l'IGS de l'ADNr, extrait des tissus de l'espèce infectée Chamelea gallina incrustés dans un bloc de paraffine, a indiqué qu'il s'agissait à 99,1 % de M. refringens isolé à partir de l'huître O. edulis (López-Flores et al. 2008b). Une analyse par hybridation in situ a confirmé la présence de Marteilia sp. dans les tissus de la glande digestive de C. gallina (López-Flores et al. 2008b). Boyer et al. (2013) ont détecté l'ADN de M. refringens chez les R. decussatus à l'aide de l'essai de PCR pour l'espaceur-transcrit interne 1 (ITS1) décrit par Le Roux et al. (2001) et ont vérifié les résultats en se servant de l'essai de PCR par amorces incluses ciblant l'espaceur intergénique (IGS) de l'ADNr selon López-Flores et al. (2004). Cependant, l'hybridation in situ a révélé la présence de cellules nécrotiques de M. refringens dans l'épithélium du tube digestif de certaines myes R. decussatus, ce qui semble indiquer la non-implication de cette espèce dans le cycle vital du parasite (Boyer et al. 2013).
- L'identité moléculaire n'est pas connue pour la majorité des parasites Marteilia sp. signalés chez les myes. Néanmoins, une séquence partielle (1 741 paires de bases) de l'ADNr 18S de la petite sous-unité du parasite Marteilia sp. signalé chez les Ruditapes philippinarum provenant de la Corée a été séquencée (numéro d'accès AB823743 dans GenBank initialement identifié comme Marteilia sp. MC, mais désormais appelé Marteilia tapetis [Kang et al. 2019]). D'après l'analyse moléculaire de cette séquence par rapport aux séquences homologues d'autres espèces des lignées des Paramyxea, Ward et al. (2016) ont indiqué que ce parasite était présent dans le même clade que d'autres espèces de Marteilia spp., mais qu'il appartenait à un clade différent de celui du parasite Eomarteilia (=Marteilia) granula. De plus, ce parasite ne réagissait pas avec les amorces particulières développées pour E. granula (Itoh et al. 2014).
Méthodes de contrôle
On ne connaît pas de méthode de prévention ou de contrôle. Les palourdes infectées ne devraient pas être transportées dans des zones dont on sait qu'elles sont exemptes de maladie.
Références
- Alfjorden, A., M. Areskog, D. Bruno, R. Carnegie, D. Cheslett, S. Feist, S. Ford, S. Jones, A. Lillehaug, L. Madsen, T. Renault, N. Ruane et P. Vennerström. 017. New Trends in Important Diseases Affecting the Culture of Fish and Molluscs in the ICES Area 2002 – 2015. Dans : Anderson, E.D., N. Ruane, R. Carnegie (eds.) ICES Cooperative Research Report No. 337, International Council for the Exploration of the Sea, Conseil International pour l'Exploration de la Mer, Copenhagen, Denmark. 50 pp.
- Aranguren, R. et A. Figueras. 2016. Moving from histopathology to molecular tools in the diagnosis of molluscs diseases of concern under EU Legislation. Frontiers in Physiology 7: Article 538, 10 pp.
- Arzul, I., B. Chollet, S. Boyer, D. Bonnet, J. Gaillard, Y. Baldi, M. Robert, J.-P. Joly, C. Garcia and M. Bouchoucha. 2014. Contribution to the understanding of the cycle of the protozoan parasite Marteilia refringens. Parasitology 141: 227-240.
- Auffret, M. et M. Poder. 1987. Pathology of the main bivalve mollusc species from oyster rearing areas in Brittany (France). Aquaculture 67: 255-257.
- Berthe, F.C.J., F. Le Roux, R.D. Adlard et A. Figueras. 2004. Marteiliosis in molluscs: A review. Aquatic Living Resources 17: 433-448.
- Boyer, S., B. Chollet, D. Bonnet et I. Arzul. 2013. New evidence for the involvement of Paracartia grani (Copepoda, Calanoida) in the life cycle of Marteilia refringens (Paramyxea). International Journal for Parasitology 43: 1089-1099.
- Burreson, E.M. 2008. Misuse of PCR assay for diagnosis of mollusc protistan infections. Diseases of Aquatic Organisms 80: 81-83.
- Carballal, M.J., D. Iglesias, S. Darriba, A. Cao, J.C. Mariño, A. Ramilo, E. No et A. Villalba. 2016. Parasites, pathological conditions and resistance to Marteilia cochillia in lagoon cockle Cerastoderma glaucum from Galicia (NW Spain). Diseases of Aquatic Organisms 122: 137-152.
- Cavalier-Smith, T. et E.E.Y. Chao. 2003. Phylogeny and Classification of Phylum Cercozoa (Protozoa). Protist 154: 341-358.
- Carrasco, N., A. Roque, K.B. Andree, C. Rodgers, B. Lacuesta et M.D. Furones. 2011. A Marteilia parasite and digestive epithelial virosis lesions observed during a common edible cockle Cerastoderma edule mortality event in the Spanish Mediterranean coast. Aquaculture 321: 197-202.
- Carrasco, N., K.B. Andree, B. Lacuesta, A. Roque, C. Rodgers et M.D. Furones. 2012. Molecular characterization of the Marteilia parasite infecting the common edible cockle Cerastoderma edule in the Spanish Mediterranean coast. A new Marteilia species affecting bivalves in Europe? Aquaculture, 324-325: 20-26.
- Carrasco, N., P.M. Hine, M. Durfort, K.B. Andree, N. Malchus, B. Lacuesta, M. González, A. Roque, C. Rodgers et M.D. Furones. 2013. Marteilia cochillia sp. nov., a new Marteilia species affecting the edible cockle Cerastoderma edule in European waters. Aquaculture 412–413: 223-230.
- Carrasco, N., T.J. Green et N. Itoh. 2015. Marteilia spp. parasites in bivalves: A revision of recent studies. Journal of Invertebrate Pathology 131: 43-57.
- Ceschia, G., S. Zanchetta, M. Sello, F. Montesi, P. Antonetti et A. Figueras. 2001. Presenza di parassiti in cannolicchi (Ensis minor e Ensis siliqua) pescati nell'area costiera del Mar Tirreno meridionale e del Mar Adriatico. Presence of parasites in razor clam (Ensis minor and Ensis siliqua) harvested from coastal areas of the southern Tyrrhenian and Adriatic Seas. Bollettino Societa Italiana di Patologia Ittica 30: 20-27.
- Comps, M. 1983 (1985). Etude morphologique de Marteilia christenseni sp. n. parasite du lavignon Scrobicularia piperata P. (mollusque pélécypode) (Morphological study of Marteilia christenseni sp. n. parasite of Scrobicularia piperata P. (mollusc pelecypod).) Revue des Travaux de l'Institut des Pêches Maritimes 47: 99-104. (En français avec la version en accès libre du résumé en anglais).
- Comps, M., H. Grizel, G. Tig‚ et J.L. Duthoit. 1975. Parasites nouveaux de la glande digestive des mollusques marins Mytilus edulis L. et Cardium edule L. (New parasites in the digestive gland of Mytilus edulis L. and Cardium edule L.). Comptes Rendus Académie des Sciences de Paris, Série D281: 179-181.
- Comps, M., Y. Pichot et J.P. Deltreil. 1979. Mise en evidence d'une microsporidie parasite de Marteilia refringens agent de la maladie de la glande digestive de Ostrea edulis L. Revue des Travaux de l'Institut des Pêches Maritimes. 43: 409-412. (En français).
- Darriba Couñago, S. 2017. Atlas de Histopatoloxía, Moluscos bivalvos mariños Histopathological Atlas, Marine bivalve molluscs. Published by Intecmar. Xunta de Galicia (Consellería do Mar), Edificios administrativos – San Caetano, s/n, Santiago de Compostela, Espagne.
- Feist, S.W., P.M. Hine, K.S. Bateman, G.D. Stentiford et M. Longshaw. 2009. Paramarteilia canceri sp. n. (Cercozoa) in the European edible crab (Cancer pagurus) with a proposal for the revision of the order Paramyxida Chatton 1911. Folia Parasitologica 56: 73-85.
- Itoh, N., K. Momoyama et K. Ogawa. 2005. First report of three protozoan parasites (a haplosporidian, Marteilia sp. and Marteilioides sp.) from the Manila clam, Venerupis (=Ruditapes) philippinarum in Japan. Journal of Invertebrate Pathology 88: 201-206.
- Itoh, N., T. Yamamoto, H.-S. Kang, K.-S. Choi, T.J. Green, N. Carrasco, M. Awaji et S. Chow. 2014. A novel paramyxean parasite, Marteilia granula sp. nov. (Cercozoa), from the digestive gland of Manila clam Ruditapes philippinarum in Japan. Fish Pathology 49: 181-193.
- Kang, H.-S., N. Itoh, Y. Limpanont, H.-M. Lee, I. Whang et K.-S. Choi. 2019. A novel paramyxean parasite, Marteilia tapetis sp. nov. (Cercozoa) infecting the digestive gland of Manila clam Ruditapes philippinarum from the southeast coast of Korea. Journal of Invertebrate Pathology 163: 86-93.
- Kerr, R., G.M. Ward, G.D. Stentiford, A. Alfjorden, S. Mortensen, J.P. Bignell, S.W. Feist, A. Villalba, M.J. Carballal, A. Cao, I. Arzul, D. Ryder et D. Bass. 2018. Marteilia refringens and Marteilia pararefringens sp. nov. are distinct parasites of bivalves and have different European distributions. Parasitologie, Publication en ligne : 11 June 2018: pp. 1-10.
- López, C. et S. Darriba. 2006. Presence of Marteilia sp. (Paramyxea) in the razor clam Solen marginatus (Pennántt 1777) in Galicia (NW Spain). Journal of Invertebrate Pathology 92: 109-111.
- López, C., S. Darriba, D. Iglesias, M. Ruiz et R. Rodríguez. 2011. Chapter 7: Pathology of sword razor shell (Ensis arcuatus) and grooved razor shell (Solen marginatus), Dans : Guerra, A., C. Lodeiros, M. Gaspar, F. da Costa (eds.) Razor clams: Biology, Aquaculture and Fisheries. Xunta de Galicia, Consellería do Mar., pp. 131-168.
- López-Flores, I., R. de la Herrán, M.A. Garrido-Ramos, J.I. Navas et M. Ruiz Rejón. 2004. The molecular diagnosis of Marteilia refringens and differentiation between Marteilia strains infecting oysters and mussels based on the rDNA IGS sequence. Parasitology 129: 411-419.
- López-Flores, I., M.A. Garrido-Ramos, R. de la Herran, C. Ruiz-Rejón, M. Ruiz-Rejón et J.I. Navas. 2008a. Identification of Marteilia refringens infecting the razor clam Solen marginatus by PCR and in situ hybridization. Molecular and Cellular Probes 22: 151-155.
- López-Flores, I., F. Robles, J.M. Valencia, A. Grau, A. Villalba, R. de la Herrán, M.A. Garrido-Ramos, C. Ruiz-Rejón, M. Ruiz-Rejón et J.I. Navas. 2008b. Detection of Marteilia refringens using nested PCR and in situ hybridisation in Chamelea gallina from the Balearic Islands (Spain). Diseases of Aquatic Organisms 82: 79-87.
- Norton, J.H., F.O. Perkins et E. Ledua. 1993. Marteilia-like infection in a giant clam, Tridacna maxima in Fiji. Journal of Invertebrate Pathology 61: 328-330.
- Poder, M., M. Auffret et G. Balouet. 1983. Etudes pathologiques et epidemiologiques des lésions parasitaires chez Ostrea edulis : Premiers résultats d'un recherche prospective comparative chez les principales espèces de mollusques des zones ostreicoles de Bretagne nord. (Pathological and epidemiological studies of parasitic diseases of Ostrea edulis: First results from a retrospective and comparative research of main species of molluscs in oyster farm in North Brittany.). Bases biologiques de l'aquaculture, Montpellier, 12-16 décembre 1983, IFREMER. Actes de Colloques 1: 125-138.
- Ruiz, M., S. Darriba, R. Rodríguez et C. López. 2015. Marteilia sp. and other parasites and pathological conditions in Solen marginatus populations along the Galician coast (NW Spain). Diseases of Aquatic Organisms 112: 177-184.
- Ruiz, M., C. López, R.-S. Lee, R. Rodríguez et S. Darriba. 2016. A novel paramyxean parasite, Marteilia octospora n. sp. (Cercozoa) infecting the Grooved Razor Shell clam Solen marginatus from Galicia (NW Spain). Journal of Invertebrate Pathology 135: 34-42.
- Stentiford, G.D., A. Ramilo, E. Abollo, R. Kerr, K.S. Bateman, S.W. Feist, D. Bass et A. Villalba. 2017. Hyperspora aquatica n.gn., n.sp. (Microsporidia), hyperparasitic in Marteilia cochillia (Paramyxida), is closely related to crustacean-infecting microspordian taxa. Parasitology 144: 186-199.
- Villalba, A., S.G. Mourelle, M.C. López, M.J. Carballal et C. Azevedo. 1993. Marteiliasis affecting cultured mussels Mytilus galloprovincialis of Galicia (NW Spain). I. Etiology, phases of the infection, and temporal and spatial variability in prevalence. Diseases of Aquatic Organisms 16: 61-72.
- Villalba, A., M.J. Carballal, C. López, A. Cabada, L. Corral et C. Azevedo. 1999. Branchial rickettsia-like infection associated with clam Venerupis rhomboides mortality. Diseases of Aquatic Organisms 36: 53-60.
- Villalba, A., D. Iglesias, A. Ramilo, S. Darriba, J.M. Parada, E. No, E. Abollo, J. Molares et M.J. Carballal. 2014. Cockle Cerastoderma edule fishery collapse in the Ría de Arousa (Galicia, NW Spain) associated with the protistan parasite Marteilia cochillia. Diseases of Aquatic Organisms 109: 55-80.
- Ward, G.M., M. Bennett, K. Bateman, G.D. Stentiford, R. Kerr, S.W. Feist, S.T. Williams, C. Berney et D. Bass. 2016. A new phylogeny and environmental DNA insight into paramyxids: an increasingly important but enigmatic clade of protistan parasites of marine invertebrates. International Journal of Parasitology 46: 605-619.
Information de citation
Bower, S.M., Itoh, N. (2019): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Marteiliosis of clams and cockles
Les coordonnées du co-auteur
Naoki Itoh, École supérieure des sciences agricoles, l'Université de Tokyo, 1-1-1 Yayoi, Bunkyo-ku, 113-8657, Tokyo, Japan.
Date de la dernière révision : Novembre 2020
Faire parvenir les commentaires à Susan Bower
- Date de modification :