Mikrocytos spp. de l'huître
Sur cette page
Catégorie
Catégorie 2 (au Canada et d'intérêt régional)
Noms courants et généralement admis de l'organisme ou de l'agent pathogène
Mikrocytose, parasite microcellulaire de l'huître creuse du Pacifique, maladie de l'île Denman de M. mackini.
Nom scientifique ou classification taxonomique
Le premier parasite microcellulaire énigmatique (Abbott et Meyer 2014) qui a été identifié était Mikrocytos mackini chez l'espèce Crassostrea gigas en provenance de Colombie-Britannique, au Canada (Farley et al. 1988). Depuis 1988 deux nouvelles espèces ont été décrites, Mikrocytos boweri chez les espèces Ostrea lurida et Crassostrea gigas , également de Colombie-Britannique, au Canada (Abbott et al. 2014), et Mikrocytos mimicus chez l'espèce Crassostrea gigas de la côte du comté de Norfolk, au Royaume-Uni (Hartikainen et al. 2014). l'analyse génétique initiale indique que M. mackini pourrait être un eucaryote basal et qu'il ne serait peut-être pas apparenté à d'autres taxons connus (Carnegie et al. 2003, Abbott et al. 2012). Avec l'arrivée de méthodes de séquençage de nouvelle génération, Burki et al. (2013) ont présenté des preuves solides permettant d'affirmer que M. mackini appartenait au supergroupe eucaryote des Rhizaria, et qu'il abritait très vraisemblablement un organite lié à la mitochondrie. Cette interprétation a été soutenue par plusieurs chercheurs (van der Giezen 2013, Abbott 2014, Abbott et Meyer 2014, Carnegie et Engelsma 2014). Hartikainen et al. (2014) ont proposé une nouvelle famille (Mikrocytiidae) et un nouvel ordre (Mikrocytida) au sein de la classe des Ascetospora (Rhizaria : Cercozoa) pour Mikrocytos spp. et Paramikrocytos canceri , un taxon sœur qu'ils ont observé chez le crabe comestible européen (Cancer pagurus) (Hartikainen et al. 2014). En outre, chez les huîtres des protistes de type Mikrocytos génétiquement différents ont été observés chez Ostrea lurida (= conchaphila) dans la Baie de San Francisco, en Californie (États-Unis) (Friedman et al. 2005), dans l'Atlantique Nord chez des Ostrea edulis du Canada atlantique importées en France aux fins de recherche (Gagné et al. 2008), des C. gigas de la côte nord de la mer Jaune, en Chine (Wang et al. 2010), et des C. gigas provenant d'un seul endroit (bras Lemmens) sur la côte ouest de l'île de Vancouver, en Colombie-Britannique, au Canada (Abbott et al. 2011).Outre les huîtres, des microcellules ont été signalées chez les palourdes. Mikrocytos veneroïdes et Mikrocytos donaxi ont été décrits dans les clovisses Donax trunculus provenant de France (Garcia et al. 2012, 2018) et un parasite de type Mikrocytos a été signalé chez les palourdes japonaises Venerupis (= Ruditapes) philippinarum sur la côte de Galice, en Espagne (Ramilo et al. 2014). Hartikainen et al. (2014) ont détecté la séquence ADN de Mikrocytos dans un échantillon composé d'un mélange d'espèces de copépodes prélevées dans l'Atlantique sud.
D'autres recherches sur les protistes de type Mikrocytos sont nécessaires pour comprendre les relations taxonomiques entre les espèces de Mikrocytos (Abbott et al. 2012). Abbott et Meyer (2014) semblent indiquer qu'au minimum, les descriptions relatives aux nouvelles espèces de Mikrocytos intègrent des données sur la séquence du gène 18S de l'ADN ribosomique ainsi que des renseignements à propos de l'histopathologie et des hôtes. Ils ont également indiqué qu'il était souhaitable d'intégrer des renseignements relatifs à la microscopie électronique dans les descriptions taxonomiques des Mikrocytos , mais que cela n'était pas réalisable lorsque la prévalence et l'intensité des infections étaient faibles (p. ex. Gagné et al. 2008; Wang et al. 2010; Abbott et al. 2011, 2014). Il convient de remarquer que les Mikrocytos spp. n'ont pas de lien avec d'autres microcellules du genre Bonamia (p. ex. B. ostreae, B. exitiosa, B. roughleyi et d'autres Bonamia spp.) connues pour appartenir au taxon sœur du phylum Haplosporidia des Rhizaria (Carnegie et Cochennec-Laureau 2004; Abbott et al. 2012, Hartikainen et al. 2014, Abbott et al. 2014, Abbott et Meyer 2014).
Répartition géographique
Les protistes identifiés positivement sous la forme de Mikrocytos mackini sont présents chez Crassostrea gigas sur la côte ouest du Canada, probablement omniprésents dans tout le détroit de Georgie et confinés à d'autres localités spécifiques autour de l'île de Vancouver, et de zones adjacentes de l'État de Washington, aux États-Unis (Elston et al. 2015). Récemment, M. mackini a été détecté chez des spécimens de Crassostrea sikamea dans la baie de Humboldt en Californie, aux États-Unis, et la séquence d'ADN de la région complète de l'espaceur transcrit interne (ITS) de l'ADN ribosomique (c.-à-d., essai ITS1-5.8S-ITS2) était totalement conforme à la séquence de M. mackini publiée (Elston et al. 2012). Abbott et al. (2011) ont formulé l'hypothèse que l'absence totale de variation génétique du parasite M. mackini dans la région complète des séquences ITS1-5.8S-ITS2 sur plus de 70 échantillons collectés dans son aire de répartition connue dans la côte sud de la Colombie-Britannique et à Puget Sound, Washington, pourrait être le résultat d'un effet fondateur si le parasite avait été introduit dans la côte ouest d'Amérique du Nord en même temps que des C.gigas , qui ont été importées de la côte est de l'Asie à partir de 1914 jusqu'aux années 1961. Dans la description initiale de M. mackini , Farley et al. (1988) ont indiqué qu'un candidat à l'inclusion dans cette espèce, étroitement apparenté, a été trouvé chez des spécimens de C. gigas provenant d'Hawaï, États-Unis, en septembre 1972. Hill et al. (2014) ont signalé qu'un échantillon archivé de 1972 initialement identifié comme un spécimen de Mikrocytos mackini chez un individu de C. gigas provenant de la baie de Kaneohe, à Hawaï (Farley et al. 1988) s'est hybridé pour donner des sondes génériques pour le parasite Bonamia spp. lorsqu'un test a été réalisé par l'intermédiaire d'une technique d'hybridation in situ au moyen de sondes marquées à la digoxigénine.
Mikrocytos boweri a été décelé chez deux Ostrea lurida indigènes (sauvages) prélevées dans la lagune Swy-a-lana à Nanaimo, sur la côte est de l'île de Vancouver, en Colombie-Britannique, au Canada (Abbott et al. 2014). Une microcellule conspécifique a été identifiée chez des C. gigas provenant d'un seul endroit (bras Lemmen) sur la côte ouest de l'île de Vancouver, en Colombie-Britannique, au Canada (Abbott et al. 2011, 2014).
Mikrocytos mimicus a été identifié chez une population de C. gigas d'élevage à proximité de Brancaster, sur la côte nord du comté de Norfolk, au Royaume-Uni (Hartikainen et al. 2014). L'espèce Mikrocytos mimicus a également été observée par histopathologie et séquençage d'ADN dans l'espèce C. gigas présentant une mortalité de 90 % en mai près de l'île Schiermonnikoog, dans la mer des Wadden, aux Pays-Bas (CIEM 2018).
Friedman et al. (2005) ont observé un protiste de type Mikrocytos chez des Ostrea lurida (= conchaphila) dans la baie de San Francisco, en Californie, États-Unis. D'autres isolats de protistes de type Mikrocytos ont été signalés dans l'Atlantique Nord, chez des Ostrea edulis du Canada atlantique qui avaient été importées en France à des fins scientifiques (Gagné et al. 2008), et chez des C. gigas provenant de la côte nord de la mer Jaune, en Chine (Wang et al. 2010).
Espèces hôtes
Mikrocytos mackini a été signalé chez des Crassostrea gigas, des Ostrea lurida lurida (auparavant appelés Ostrea (= Ostreola) conchaphila dont on sait aujourd'hui qu'il s'agit d'une espèce distincte (Polson et al. 2009) dont la vulnérabilité à l'égard de M. mackini) est inconnue ainsi que chez Crassostrea sikamea. Il peut infecter, dans un cadre expérimental, des Crassostrea virginica et des Ostrea edulis (Bower et al. 1997, Elston et al. 2012). Des expositions par immersion en laboratoire ont clairement indiqué que les C. gigas juvéniles étaient prédisposées aux infections par M. mackini , tandis que les Panope abrupta (panope du Pacifique) juvéniles (Bower et al. 2005) et matures Venerupis philippinarum (palourde japonaise, coquille de 28 mm de longueur environ) (Meyer et al. 2008) y résistaient (Bower et al. 2005 et Meyer et al. 2008, respectivement)
Mikrocytos boweri a été signalé chez des O. lurida et des C. gigas (Abbott et al. 2014) tandis que M. mimicus n'a été signalé que chez des C. gigas (Hartikainen et al. 2014).
Des organismes protozoaires de type Mikrocytos ont été signalés chez des huîtres O. lurida (= conchaphila) de la baie de San Francisco, en Californie, aux États-Unis (Friedman et al. 2005), chez des O. edulis en provenance du Canada atlantique importées en France à des fins scientifiques (Gagné et al. 2008), et chez des C. gigas provenant de la côte nord de la mer Jaune, en Chine (Wang et al. 2010).
Impact sur les hôtes
Infection intracellulaire focale des cellules des tissus conjonctifs vésiculaires qui aboutissent à une infiltration hémocytaire et à une nécrose des tissus. Les pustules verdâtres qui en résultent peuvent réduire la qualité marchande des huîtres malades. Seules les huîtres plus âgées (plus de 2 ans) semblent développer des infections graves liées à M. mackini , et les mortalités (touchant souvent environ 30 % des huîtres plus âgées à marée basse) se produisent le plus souvent en avril et en mai, après une période de 3 à 4 mois au cours de laquelle les températures sont inférieures à 10 °C. À la suite de l'élaboration de techniques de détection moléculaire sensibles et précises (Polinski et al. 2015), Polinski et al. (2017) ont confirmé le potentiel de transmission extracellulaire dans l'eau de mer de M. mackini et ont également déterminé que la branchie de l'hôte présentait la prévalence précoce et continue la plus élevée pour l'ADN de M. mackini par rapport aux échantillons d'estomac, de manteau, de palpes labiaux ou de muscle adducteur. Toutefois, dans des conditions de laboratoire, les infections consécutives à une immersion étaient lentes à se développer malgré une exposition importante (> 106 M. mackini l-1 pendant 24 heures) et des recherches plus poussées ont démontré que l'occurrence et l'infectivité de M. mackini diminuaient fortement après une incubation extracellulaire dans l'eau de mer de plus de 24 heures (Polinski et al. 2017).
Près de 10 % des C. gigas infectées semblent récupérer. Les Crassostrea gigas sont vraisemblablement plus résistantes à la maladie que les autres espèces d'huîtres exposées à titre expérimental sous des conditions de laboratoire et sur le terrain (Bower et al. 1997). Dans l'État de Washington, aux États-Unis, aucune mortalité n'a été attribuée au parasite M. mackini (Elston et al. 2015).
Seules de faibles prévalences de M. boweri (2 huîtres sur 40 en avril et 0 huître sur 60 en juillet 2012) sans aucun signe général de maladie ont été observées chez l'espèce O. lurida (Abbott et al. 2014). La même faible prévalence des infections sans signe de maladie macroscopique a été rapportée pour M. boweri (initialement identifié comme Mikrocytos sp. – Colombie-Britannique) chez C. gigas (Abbott et al. 2011, Abbott et Meyer 2014). Cependant, des infiltrations d'hémocytes diffuses et focales correspondant à des infections de faible intensité par des parasites intracellulaires Mikrocytos (< 50 M. boweri détectés par coupe de tissus) ont été observées par examen histologique (Abbott et al. 2014).
Mikrocytos mimicus a été associé à des phénomènes de mortalité (environ 20 % d'huîtres mortes ou mourantes) dans une population d'élevage de C. gigas , d'un établissement conchylicole en zone intertidale (Hartikainen et al. 2014). Les huîtres touchées étaient jugées minces et aqueuses, et présentaient des pustules vertes visibles principalement à la surface du tissu du manteau et du muscle adducteur. Sur les 35 spécimens du stock touché ayant subi un examen histologique, 12 abritaient M. mimicus et présentaient une infiltration d'hémocytes intense ainsi que des zones de nécrose dans les tissus conjonctifs (Hartikainen et al. 2014 – résultats complémentaires).
Des stratégies d'évaluation et de gestion des risques axées sur le danger que présente le parasite M. mackini ont été mises au point dans le cadre d'un atelier coordonné par R. E. Elston et animé par le Pacific Shellfish Institute de Tacoma, État de Washington, aux États-Unis, en 2004. Cet atelier a permis de conclure que le risque d'exporter le parasite M. mackini dans des produits conchycoles vivants vers les États de Washington, d'Oregon et de Californie était négligeable. Cependant, la hausse de la pathogénicité apparente de M. mackini ou la hausse de la prédisposition des huîtres aux maladies à des températures fraîches laisse entendre que M. mackini pose un risque pour les huîtres élevées dans l'eau sur des périodes prolongées (plusieurs mois) à des températures inférieures à 10 °C. La dernière observation de M. mackini chez des C. sikamea de la baie Humboldt, en Californie, a révélé une plus grande prévalence des infections chez les huîtres qui ont passé plus de temps dans la baie, et celles provenant de sites où la température de l'eau était plus froide que celle observée habituellement en hiver (Elston et al. 2012). Abbott et Meyer (2014) ont présenté des renseignements qui indiquent que la dépendance à l'égard de la température de la pathologie liée à M. mackini concernait tous les genres, de sorte que les infections cliniques induites par les espèces de Mikrocytos dépendent généralement de températures d'eau froides.
Techniques de diagnostic
Observations générales
Lésions focales (ulcérations, abcès, pustules habituellement de couleur verte, mais pouvant être jaune-brun ou incolores) mesurant jusqu'à 5 mm de diamètre, dans la paroi corporelle, le muscle adducteur ou sur les surfaces des palpes labiaux ou le manteau. Souvent, on constate une encoche sur la coquille, à proximité de l'abcès à la surface du manteau. Cependant, les lésions seules ne peuvent pas être utilisées pour confirmer qu'un Mikrocytos est l'agent responsable. Par exemple, les pustules verdâtres résultant de la nocardiose ne se distinguent pas de celles qui sont causées par M. mackini (Bower et Meyer 2004). Il convient de remarquer que les C. gigas infectées par M. mackini ont tendance à sembler être en très bonne condition (à savoir, elles présentent un corps lisse et rond de couleur crème ainsi qu'un manteau épais et ridé– se reporter aux figures 1 à 3 ci-dessous). En revanche, les C. gigas infectées par M. mimicus étaient jugées minces et aqueuses (Hartikainen et al. 2014 – résultats complémentaires).


Figure 1 and 1a. Crassostrea gigas retirée de sa coquille et montrant les lésions (flèches) caractéristiques de Mikrocytos mackini , lorsque la microcellule est surtout abondante dans les cellules des tissus conjonctifs vésiculaires immédiatement autour des lésions.

Figure 1b. Trois lésions (flèches) caractéristiques de M. mackini sur les palpes labiaux de C. gigas.

Figure 2. Huître creuse du Pacifique (Crassostrea gigas) extraite de sa coquille et montrant des lésions (flèches) observées aux derniers stades de la maladie de l'île Denman. Normalement, on ne retrouve plus Mikrocytos mackini dans les huîtres par histologie à ce stade avancé de la maladie.

Figure 3. Huître plate européenne (Ostrea edulis) après l'extraction de la coquille supérieure, montrant de nombreuses lésions du muscle adducteur (flèche) causées par Mikrocytos mackini.

Figure 3a. Crassostrea gigas removed from shell and illustrating lesions in the adductor muscle (arrows) caused by M. mackini.

Figure 3b and 3c. Muscles adducteurs de C. gigas présentant des lésions cryptiques (3b, flèches) et des lésions très prononcées (3c, flèches) causées par M. mackini.
Histologie
Examen microscopique à haute résolution (grossissement x1 000 sous un film d'huile) des cellules des tissus conjonctifs vésiculaires immédiatement adjacentes au foyer de l'infiltration hémocytaire intense (lésions) pour détecter la présence d'organismes protozoaires intracellulaires de 2-3 µm de diamètre. Des parasites Mikrocytos spp. ont également été observés dans les cellules musculaires et occasionnellement dans les hémocytes à l'intérieur des lésions. Les Mikrocytos spp. ont tendance à présenter une forme sphérique. Souvent, les noyaux de M. mackini et de M. boweri se situent à proximité du centre de la cellule et se présentent sous une forme sphérique (S. M. Bower, observations personnelles; Abbott et al. 2014), alors que le noyau de M. mimicus est habituellement excentrique et souvent de forme allongée lorsqu'il fait l'objet d'un examen histologique et des empreintes tissulaires (Hartikainen et al. 2014 – résultats complémentaires). Il convient de noter que la petite taille et les habitudes intracellulaires de M. mackini , combinées à ses caractéristiques de faible coloration dans le cadre des techniques histologiques de routine, rendent souvent sa détection au microscope difficile (Meyer et al. 2005). En outre, la petite taille de la cellule et la faible quantité de traits morphologiques caractéristiques rendent impossible la distinction fiable, au moyen d'un microscope optique, entre les espèces de Mikrocytos et entre ces dernières et les microcellules du genre Bonamia (Abbott et Meyer 2014). Le parasite Bonamia (= Microcytos) roughleyi, seule autre espèce classée au départ dans le même genre, mais dont on sait maintenant qu'elle appartient à un autre genre, responsable de la maladie de l'hiver australien chez les Saccostrea commercialis , diffère de M. mackini en ce qu'il possède une vacuole dans son cytoplasme. Ni M. mackini ni les autres types de Bonamia spp. ne présentent de telle vacuole.

Figure 4. Coupe histologique d'une lésion causée par Mikrocytos mackini sur le manteau de Crassostrea gigas. Cet organisme protozoaire intracellulaire (non visible à ce grossissement) apparaît habituellement dans les cellules intactes des tissus conjonctifs vésiculaires entourant immédiatement la lésion (flèches). Coloration à l'hématoxyline et à l'éosine.

Figure 5. De nombreux Mikrocytos mackini (flèches) dans les cellules des tissus conjonctifs vésiculaires adjacentes à une lésion caractérisée par une accumulation d'hémocytes et de cellules nécrotiques. Coloration à l'hématoxyline et à l'éosine.

Figure 6. Grossissement de 1 000x sous un film d'huile de Mikrocytos mackini (flèches) dans le cytoplasme des cellules des tissus conjonctifs vésiculaires de Crassostrea gigas. Coloration à l'hématoxyline et à l'éosine.

Figure 7. Comme pour la figure 6, mais sur un autre spécimen de Crassostrea gigas. Compte tenu de la taille réduite de M. mackini , il est très difficile de le visualiser et de le photographier dans les préparations histologiques. Coloration à l'hématoxyline et à l'éosine.

Figure 8. Mikrocytos mackini (A) within fibres of the adductor muscle of Crassostrea gigas. One M. mackini is located close to the nucleus (B) of a muscle cell. Haematoxylin and eosin stain. Mikrocytos mackini (A) dans les fibres du muscle adducteur de Crassostrea gigas. Un parasite M. mackini se trouve à proximité du noyau (B) d'une cellule musculaire. Coloration à l'hématoxyline et à l'éosine.
Empreintes tissulaires
Des empreintes de lésions sont séchées à l'air, fixées et colorées comme pour la préparation d'un frottis de tissus d'huîtres Bonamia ostreae, et examinées à un grossissement x 1 000 (sous un film d'huile) pour y détecter les petites microcellules que l'on observe souvent à l'extérieur des cellules hôtes. Il est impossible de faire la distinction entre M. mackini et Bonamia spp. à partir de ces préparations. Dans les empreintes tissulaires, les spécimens de M. mimicus étaient généralement ovoïdes à sphériques, mesurant de 3 à 5 μm de diamètre et présentant un cytoplasme basophile ainsi qu'un noyau éosinophile. Les noyaux étaient principalement sous-centraux ou périphériques et leur forme variable : parfois sphériques, parfois ovoïdes et occasionnellement piriformes (Hartikainen et al. 2014 – résultats complémentaires).

Figure 9. Mikrocytos mackini (flèches) au milieu des débris de la cellule hôte dans une empreinte tissulaire d'une lésion du muscle adducteur d'une Crassostrea gigas infectée en laboratoire. Coloration Hemacolor®.
Microscopie électronique
L'analyse de la morphologie ultrastructurale différencie Mikrocytos spp. de Bonamia spp.; le nucléole de Mikrocytos spp. est situé vers le centre du noyau, tandis que celui de B. ostreae est plus excentré, et il n'y a pas d'haplosporosome et de mitochondrie chez Mikrocytos spp (Hine et al. 2001). Cependant, Burki et al. (2013) ont séquencé une partie des transcriptomes de M. mackini et ont découvert chez cette espèce quatre gènes issus des mitochondries, ce qui indique qu'elle abrite un organite réduit à double liaison lié à la mitochondrie qui n'a pas encore été décrit (Abbott et Meyer 2014). l'ultrastructure cellulaire de M. mimicus (Hartikainen et al. 2014) s'est avérée très similaire à celle de M. mackini.

Figure 11. Mikrocytos mackini (flèches) contenant chacun un noyau avec un nucléole prononcé et sans mitochondrie. Acétate d'uranyle et colorant au citrate de plomb

Figure 11. Mikrocytos mackini (flèches) contenant chacun un noyau avec un nucléole prononcé et sans mitochondrie. Acétate d'uranyle et colorant au citrate de plomb
Des études approfondies sur l'ultrastructure de M. mackini ont permis d'identifier trois formes morphologiques (Hine et al. 2001). Ces trois formes morphologiques ont également été rapportées chez M. mimicus (Hartikainen et al. 2014 – résultats complémentaires). Les cellules quiescentes avaient un noyau central rond ou ovoïde, moins de sept citernes de Golgi liées à la membrane nucléaire inactive, quelques vésicules et des organismes identiques à des lysosomes. Elles se sont produites dans les cellules du tissu conjonctif vésiculaire, les hémocytes (hyalinocytes), les myocytes du muscle adducteur et du cœur et à l'extérieur des cellules. Les cellules vésiculaires (VC) contenaient de nombreuses petites vésicules enrobées et non enrobées, ne présentaient pas d'amas de type Golgi lié à la membrane nucléaire, et la membrane nucléaire était parfois dilatée pour former une enveloppe cisternale. Elles étaient rarement extracellulaires et apparaissaient généralement dans les myocytes du muscle adducteur et du cœur, en association étroite avec les mitochondries de la cellule hôte. Les endosomes avaient une membrane nucléaire dilatée, un réticulum endoplasmique anastomosique bien développé reliant les membranes nucléaires et plasmiques, et des endosomes étaient présents dans le cytoplasme. Elles se sont produites dans les cellules du tissu conjonctif vésiculaire, les hémocytes (hyalinocytes) et à l'extérieur des cellules. Quelques organites sont apparues dans toutes les formes de M. mackini , ce qui peut être attribuable au parasitisme obligatoire et à l'utilisation des organites de la cellule hôte, réduisant ainsi le besoin d'organites des parasites.
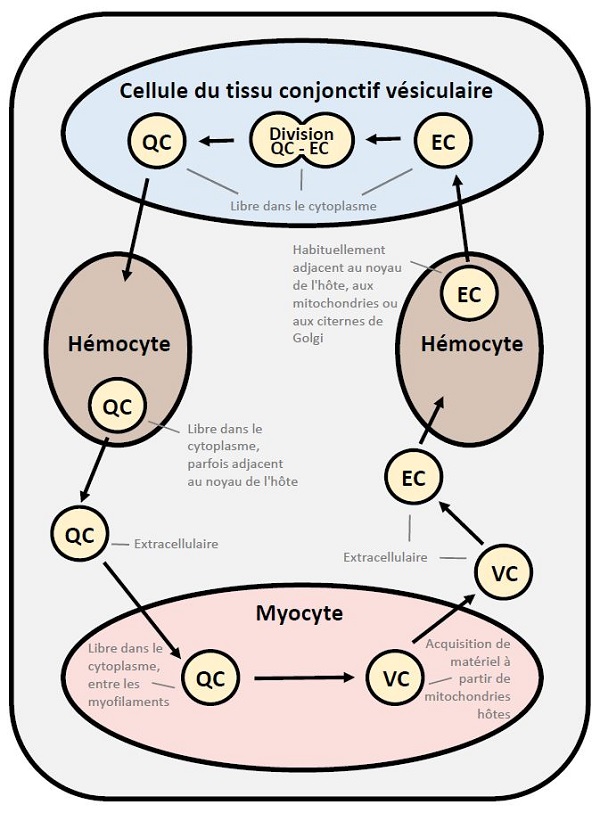
Figure 12. Cycle de développement proposé de Mikrocytos mackini indiquant le type de cellule de l'hôte et l'appartenance de l'organite hôte, pour les trois formes morphologiques reconnues comprenant la cellule quiescente (QC), la cellule vésiculaire (VC) et les endosomes (CE).
Essai immunologique
Des hybridomes qui produisent des anticorps monoclonaux spécifiques pour M. mackini ont été produits (S. M. Bower) et peuvent être mis à disposition pour le développement d'outils de diagnostic semblables à ceux qui ont été élaborés pour Bonamia ostreae (ELISA, IFA).
Sondes à ADN
Des analyses de réaction en chaîne par polymérase (PCR) et fluorescence dans des essais d'hybridation (FISH) in situ ont été développées sur la base d'un segment de 1 457 paires de bases de la petite sous-unité de gène d'ADN ribosomique (SSU ADNr ou 18S) (numéro d'accession GenBank AF477623). l'analyse moléculaire de M. mackini a en partie été rendue possible par une méthode d'enrichissement qui a permis de concentrer les microcellules dans un tube Eppendorf de 1,5 ml après plusieurs étapes de filtration en vue de retirer la majeure partie du tissu hôte (Joly et al. 2001). Les amorces utilisées dans un premier temps pour identifier l'ADN de M. mackini amplifient plutôt différents ADNr SSU de protistes parasites à partir des tissus de métazoaires par PCR (Bower et al. 2004). Une analyse PCR améliorée pour M. mackini a détecté de 3 à 4 fois plus d'infections par M. mackini que l'histopathologie standard (Carnegie et al. 2003). Toutefois, l'analyse PCR a eu une réaction croisée avec des protistes de type Mikrocytos venant de l'océan Atlantique, de la mer Jaune et de la côte ouest de l'île de Vancouver (respectivement Gagné et al. 2008, Wang et al. 2010, et Abbott et al. 2011) et avec M. boweri (Abbott et Meyer 2014). Bien que le segment du protiste de type Microcytos ayant été amplifié représente une petite portion (environ 500 paires de bases) du gène 18S, il était étonnamment identique (100 %) aux échantillons provenant des O. edulis de l'océan Atlantique et des C. gigas de la mer Jaune et de la côte ouest de l'île de Vancouver, mais se distinguait de ceux des M. mackini d'environ 10 à 20 % (Gagné et al. 2008; Wang et al. 2010; Abbott et al. 2011, 2014; Abbott et Meyer 2014). Comme l'ont recommandé Abbott et al. (2011) le séquençage d'une portion plus longue d'ADNr comprenant à la fois le gène 18S et des régions de l'ITS dont l'évolution est plus rapide serait plus révélateur et plus utilisé pour la caractérisation future des organismes Microcytos sp. (Abbott et al. 2011). Les différences observées dans les séquences du gène 18S ont été utilisées pour déterminer les critères d'importation relatifs à M. boweri et à M. mimicus , car la discrimination en fonction de la morphologie est limitée par les espèces de Mikrocytos spp. (Abbott et al. 2014, Hartikainen et al. 2014 – résultats complémentaires). Néanmoins, on a utilisé l'analyse de la courte séquence d'ADN du protiste de type Microcytos pour démontrer les différences avec M. mackini. Ensuite, la toute la longueur des régions des espaceurs transcrits internes (ITS1 et ITS2) et le gène intermédiaire 5.8S de l'ADNr de M. mackini ont été séquencés (numéro d'accession GenBank HM563060). Dans cette séquence, on a constaté la présence de parties très divergentes (dans les ITS1 et ITS2) par rapport aux protistes de type Mikrocytos de Colombie-Britannique (connu maintenant comme M. boweri, voir Abbott et al. 2014), qui pourraient être exploitées pour le diagnostic moléculaire différentiel (Abbott et al. 2011). Cette même région (c.-à-d. l'ensemble de la séquence ITS1-5.8S-ITS2) était étonnamment homologue (100 % identique) parmi de nombreux isolats de M. mackini provenant de l'ensemble de son aire de répartition connue (Abbott et al. 2011, Elston et al. 2012).
Un essai de PCR quantitative (qPCR) TaqMan ciblant l'ITS2-28S spécifique de M. mackini a été développé, et l'analyse statistique a montré que le tissu d'une tranche du corps des huîtres était optimal pour détecter le parasite (Lowe et al. 2012). Par la suite, une méthode quantitative sensible, fondée sur la détection d'ADN spécifique de M. mackini provenant de tissus de l'hôte à l'aide des dosages par PCR quantitative en temps réel de la technologie a été élaboré et s'est révélée être supérieure aux méthodes existantes fondées sur la PCR conventionnelle, l'histologie ou la pathologie macroscopique, et constitue le premier test de diagnostic spécifique pour M. mackini (Polinski et al. 2015). Une évaluation supplémentaire a permis de déterminer que cet essai qPCR présentait la plus grande sensibilité diagnostique tout en conservant une spécificité diagnostique semblable à celle de la PCR classique et de l'histopathologie, et qu'il était donc généralement bien adapté à la plupart des applications (Polinski et al. 2021). Cette méthode a été utilisée pour détecter M. mackini dans l'eau de mer et a confirmé le potentiel de transmission extracellulaire de ce parasite dans l'eau de mer (Polinski et al. 2017).
Carnegie et al. (2003) a élaboré une méthode d'hybridation in situ (ISH) qui utilise des sondes marquées par fluorescence pour détecter M. mackini par hybridation de l'ADNr 18S. Plus tard, Meyer et al. (2005) ont utilisé le marquage à la digoxigénine d'une des sondes d'ADN conçues par Carnegie et al. (2003) et ont constaté que cette méthode d'hybridation in situ permettait de détecter facilement M. mackini à faible grossissement avec une sensibilité beaucoup plus élevée que l'histologie de routine. Une sonde d'ADN marquée à la digoxigénine utilisée dans une analyse d'hybridation in situ (DIG-ISH) a été utilisée pour révéler M. mackini dans les tissus de la glande digestive. En effet, ce parasite n'avait jamais été observé dans cet organe (Meyer et al. 2005).

Figure 13. Coupes consécutives de la même zone de la glande digestive d'une Crassostrea gigas adulte infectée par Microcytose mackini (taches sombres à gauche). La section sur la gauche a été colorée à l'aide d'une sonde d'ADN marquée à la digoxigénine (DIG-ISH) et a révélé le parasite dans le tubule à des grossissements relativement faibles. Les parasites n'étaient pas visibles dans les tissus similaires colorés à l'hématoxyline et à l'éosine (coupe de droite), même à un fort grossissement (x1 000, sous un film d'huile).
La sonde pour hybridation in situ (ISH) pour M. mackini a eu une réaction croisée avec le protiste de type Microcytos de l'océan Atlantique et de la mer Jaune (Gagné et al. 2008, Wang et al. 2010, respectivement), mais pas avec le protiste de type Microcytos de la baie de San Francisco (Friedman et al. 2005). De même, l'essai ISH développé pour le protiste de type Microcytos n'était pas spécifique. Ainsi, la sonde destinée au protiste de type Microcytos s'est hybridisée pour M. mackini et le protiste de type Microcytos (Gagné et al. 2008)
Méthodes de contrôle
Les huîtres provenant de zones infectées (actuellement ou historiquement) ne devraient pas être déplacées vers des zones où la maladie de l'île Denman n'a pas été constatée, surtout si ces zones ont un profil de température d'eau plus fraîche. Dans la moitié méridionale de la Colombie-Britannique où la présence de la maladie est avérée, son effet sur les populations infectées peut être réduit à un niveau gérable, en récoltant ou en déplaçant de grandes huîtres vers des emplacements élevés en zone intertidale avant mars, et en évitant leur ensemencement à des niveaux plus bas de la marée avant juin (Quayle 1982, 1988). Les huîtres retenues au cours d'un cycle de production ostréicole de deux ans dans les zones où la maladie est active peuvent subir au printemps suivant un accroissement de la mortalité et un développement de lésions évidentes (fig. 2 ci-dessus), se traduisant par une réduction de la commercialisation.
Les études en laboratoire de Polinski et al. (2017) ont confirmé que la transmission dans l'eau de mer de M. mackini entre les huîtres creuses du Pacifique est possible et que l'ADN de M. mackini est naturellement excrété par les huîtres vivantes pendant l'infection. Cependant, la faible efficacité de l'infection et la courte stabilité environnementale de M. mackini limiteraient géographiquement l'efficacité de ce mode de transmission dans les milieux naturels. Des études sur l'exposition ont également démontré que M. mackini peut persister pendant de longues périodes une fois à l'intérieur de l'hôte (Hervio et al. 1996, Polinski et al. 2017). Ainsi, des quantités modestes de transmission dans l'eau de mer, associées à une persistance à long terme, pourraient être à l'origine des zones localisées sporadiques où la maladie de l'île Denman est actuellement observée. Il est important de prendre ces renseignements en compte lors de l'évaluation des mesures de biosécurité et de dépistage diagnostique concernant M. mackini (Polinski et al. 2017). Néanmoins, l'application d'essais de diagnostic sensibles et précis récemment élaborés devrait grandement aider à établir des programmes de gestion des maladies (Polinski et al. 2015, 2021).
Références
Abbott, C.L. 2014. Evolution: hidden at the end of a very long branch. Current Biology 24: 807-812.
Abbott, C.L. et G.R. Meyer. 2014. Review of Mikrocytos microcell parasites at the dawn of a new age of scientific discovery. Diseases of Aquatic Organisms 110: 25-32.
Abbott, C.L., S.R. Gilmore, G. Lowe, G. Meyer et S. Bower. 2011. Sequence homogeneity of internal transcribed spacer rDNA in Mikrocytos mackini and detection of Mikrocytos sp. in a new location. Diseases of Aquatic Organisms 93: 243–250.
Abbott, C.L., N. Corradi, G. Meyer, F. Burki, S.C. Johnson et P. Keeling. 2012. Multiple gene segments isolated by next-generation sequencing indicate extreme divergence of Mikrocytos mackini. Journal of Shellfish Research 31: 257. (Résumé).
Abbott, C.L., G.R. Meyer, G. Lowe, E. Kim et S.C. Johnson. 2014. Molecular taxonomy of Mikrocytos boweri sp. nov. from Olympia oysters Ostrea lurida in British Columbia, Canada. Diseases of Aquatic Organisms 110: 65-70.
Bower, S.M. 1988. Circumvention of mortalities caused by Denman Island Oyster Disease during mariculture of Pacific Oysters. American Fisheries Society Special Publication 18: 246-248.
Bower, S.M. 2003. Mikrocytosis (Mikrocytos mackini). Annual Reports of OIE Reference Laboratories and Collaborating Centres 2002: 403-405.
Bower, S.M. 2001. Hazards and risk management of Mikrocytos mackini in oysters. In: Rodgers, C.J. (eds), Proceedings of the OIE International Conference on Risk anaysis in aquatic animal health. World Organisation for Animal Health, Paris, pp. 164-166.
Bower, S.M. 2005. Mikrocytos mackini (microcell). In: Rohde, K. (ed.), Marine Parasitology. CSIRO Publishing, Collingwood, pp. 34-37.
Bower, S. M. et G. R. Meyer. 1999. Effects of cold water on limiting or exacerbating some oyster diseases. Journal of Shellfish Research 18: 296. (Résumé).
Bower, S.M. and G.R. Meyer. 2004. 5.2.5 Mikrocytosis (Denman Island Disease of Oysters), In: AFS-FHS (American Fisheries Society-Fish Health Section). 2014. FHS blue book: suggested procedures for the detection and identification of certain finfish and shellfish pathogens, 2020 edition.
Bower S.M., S.E. McGladdery, et I.M. Price. 1994. Synopsis of infectious diseases and parasites of commercially exploited shellfish. Annual Review of Fish Diseases 4: 36–39.
Bower, S. M., D. Hervio et G. R. Meyer. 1997. Infectivity of Mikrocytos mackini, the causative agent of Denman Island disease in Pacific oysters Crassostrea gigas, to various species of oysters. Diseases of Aquatic Organisms 29: 111-116.
Bower, S.M., R.B. Carnegie, B. Goh, S.R.M. Jones, G.J. Lowe et M.W.S. Mak. 2004. Preferential PCR amplification of parasitic protistan small subunit rDNA from metazoan tissues. The Journal of Eukaryotic Microbiology 51: 325-332.
Bower, S.M., K. Bate et G.R. Meyer. 2005. Susceptibility of juvenile Crassostrea gigas and resistance of Panope abrupta to Mikrocytos mackini. Journal of Invertebrate Pathology 88: 95-99.
Burki, F., N. Corradi, R. Sierra, J. Pawlowski, G.R. Meyer, C.L. Abbott et P.J. Keeling. 2013. Phylogenomics of the intracellular parasite Mikrocytos mackini reveals evidence for a mitosome in Rhizaria. Current Biology 23: 1541-1547.
Carnegie, R.B. et N. Cochennec-Laureau. 2004. Microcell parasites of oysters: recent insights and future trends. Aquatic Living Resources 17: 519-528.
Carnegie, R.B., G.R. Meyer, J. Blackbourn, N. Cochennec-Laureau, F.C.J. Berthe et S.M. Bower. 2003. Molecular detection of the oyster parasite Mikrocytos mackini and a preliminary phylogenetic analysis. Diseases of Aquatic Organisms 54: 219-227.
CIEM. 2018. Report of the Working Group on Pathology and Diseases of Marine Organisms (WGPDMO), 13-17 February 2018 (en anglais seulement), Riga, Latvia. ICES CM 2018/ASG:01. 42 pp. (Voir page 9).
Elston, R.A. 1993. Infectious diseases of the Pacific oyster, Crassostrea gigas. Annual Review of Fish Diseases 3: 259-276.
Elston, R.A., J. Moore et C.L. Abbott. 2012. Denman Island disease (causative agent Mikrocytos mackini) in a new host, Kumamoto oysters Crassostrea sikamea. Diseases of Aquatic Organisms 102: 65-71.
Elston, R., C. Friedman, L. Gustafson, G. Meyer et R. Rogers. 2015. Denman Island disease in Washington State, USA: distribution and prevalence in Pacific and Olympia oysters. Diseases of Aquatic Organisms 114: 147-154.
Farley, C.A., P.H. Wolf et R.A. Elston. 1988. A long-term study of "microcell" disease in oysters with a description of a new genus, Mikrocytos (g.n.) and two new species Mikrocytos mackini (sp.n.) and Mikrocytos roughleyi (sp.n.). U.S. National Marine Fish Service Bulletin 86: 581-593.
Friedman, C.S., H.M. Brown, T.W. Ewing, F.J. Griffin et G.N. Cherr. 2005. Pilot study of the Olympia oyster Ostrea conchaphila in the San Francisco Bay estuary: description and distribution of diseases. Diseases of Aquatic Organisms 65: 1-8.
Garcia, C., I. Arzul, J.P. Joly, B. Guichard, B. Chollet, E. Omnes, C. Haond, M. Robert, C. Lupo et C. Francois. 2012. Mikrocytos like protozoans and the shellfish Donax trunculus mortality events in France. Journal of Shellfish Research 31: 273. (Résumé).
Garcia, C.,C. Haond, B. Chollet, M. Nerac, E. Omnes, J.-P. Joly, C. Dubreuil, D. Serpin, A. Langlade, D. Le Gal, A. Terre-Terrillon, O. Courtois, B. Guichard et I. Arzul. 2018. Descriptions of Mikrocytos veneroïdes n. sp. and Mikrocytos donaxi n. sp. (Ascetosporea: Mikrocytida: Mikrocytiidae), detected during important mortality events of the wedge clam Donax trunculus Linnaeus (Veneroida: Donacidae), in France between 2008 and 2011 (en anglais seulement). Parasites & Vectors 11: 119, 16 pp.
Gagné, N., N. Cochennec, M. Stephenson, S. S. McGladdery, G.R. Meyer et S.M. Bower. 2008. First report of a Mikrocytos -like parasite in European oysters Ostrea edulis from Canada after transport and quarantine in France. Diseases of Aquatic Organisms 80: 27-35.
Hartikainen, H., Grant D. Stentiford, Kelly S. Bateman, C. Berney, Stephen W. Feist, M. Longshaw, B. Okamura, D. Stone, G. Ward, C. Wood et D. Bass. 2014. Mikrocytids are a broadly distributed and divergent radiation of parasites in aquatic invertebrates (en anglais seulement). Current Biology 24: 807-812 and Supplemental Information.
Hervio, D., S. M. Bower et G. R. Meyer. 1995a. Life cycle, distribution and lack of host specificity of Mikrocytos mackini , the cause of Denman Island disease in Pacific oysters, Crassostrea gigas. Journal of Shellfish Research 14: 228. (Résumé)
Hervio, D., G. R. Meyer, S. M. Bower et R. D. Adlard. 1995b. Development of specific molecular probes for serological and PCR assays for the identification and diagnosis of Mikrocytos mackini , the cause of Denman Island disease in the Pacific oyster Crassostrea gigas. Journal of Shellfish Research 14: 268. (Résumé).
Hervio, D., S.M. Bower et G.R. Meyer. 1996. Detection, isolation and experimental transmission of Mikrocytos mackini , a microcell parasite of Pacific oysters Crassostrea gigas (Thunberg). Journal of Invertebrate Pathology 67: 72-79.
Hill, K.M., N.A. Stokes, S.C. Webb, P.M. Hine, M.A. Kroeck, J.D. Moore, M.S. Morley, K.S. Reece, E.M. Burreson et R.B. Carnegie. 2014. Phylogenetics of Bonamia parasites based on small subunit and internal transcribed spacer region ribosomal DNA sequence data. Diseases of Aquatic Organisms 110: 33-54.
Hine, P.M., S.M. Bower, G.R. Meyer, N. Cochennec-Laureau et F.C.J. Berthe. 2001. Ultrastructure of Mikrocytos mackini , the cause of Denman Island disease in oysters Crassostrea spp. and Ostrea spp. in British Columbia, Canada. Diseases of Aquatic Organisms 45: 215-227.
Joly, J.-P., S.M. Bower et G.R. Meyer. 2001. A simple technique to concentrate the protozoan Mikrocytos mackini, causative agent of Denman Island disease in oysters. The Journal of Parasitology 87: 432-434.
Lowe, G., G. Meyer, M.G. Abbott, S.C. Johnson et C.L. Abbott. 2012. Development of a q-PCR assay to detect Mikrocytos mackini and assessment of optimum tissue for diagnostic testing. Journal of Shellfish Research 31: 315. (Résumé).
Meyer, G.R., S.M. Bower et R.B. Carnegie. 2005. Sensitivity of a digoxigenin-labelled DNA probe in detecting Mikrocytos mackini , causative agent of Denman Island disease (mikrocytosis) in oysters. Journal of Invertebrate Pathology 88: 89-94.
Meyer, G.R., S.M. Bower, G. Lowe et S. Davies. 2008. Resistance of the Manila clam (Venerupis philippinarum) to infection with Mikrocytos mackini. Journal of Invertebrate Pathology 98: 54-57.
Polinski, M., G. Lowe, G. Meyer, S. Corbeil, A. Colling, C. Caraguel et C.L. Abbott. 2015. Molecular detection of Mikrocytos mackini in Pacific oysters using quantitative PCR. Molecular and Biochemical Parasitology 200: 19-24.
Polinski, M.P., G.R. Meyer, G.J. Lowe et C.L. Abbott. 2017. Seawater detection and biological assessments regarding transmission of the oyster parasite Mikrocytos mackini using qPCR. Diseases of Aquatic Organisms 126: 143-153.
Polinski, M.P., E. Laurin, M.K.V.C. Delphino, G.J. Lowe, G.R. Meyer et C.L. Abbott. 2021. Evaluation of histopathology, PCR, and qPCR to detect Mikrocytos mackini in oysters Crassostrea gigas using Bayesian latent class analysis. Diseases of Aquatic Organisms 144: 21-31.
Polson, M.P., W.E. Hewson, D.J. Eernisse, P.K. Baker et D.C. Zacherl. 2009. You Say Conchaphila, I Say Lurida: Molecular Evidence for Restricting the Olympia Oyster (Ostrea lurida Carpenter 1864) to Temperate Western North America. Journal of Shellfish Research 28: 11-21.
Quayle, D.B. 1961. Denman Island disease and mortality, 1960. Fisheries Research Board of Canada Manuscript Report 713. Ottawa.
Quayle, D.B. 1969. Pacific oyster culture in British Columbia. Fisheries Research Board of Canada Bulletin 169: 192 p. (For information on Denman disease see pages 166-168).
Quayle, D.B. 1982. Denman Island oyster disease 1960-1980. British Columbia Shellfish Mariculture Newsletter 2(2): 1-5. (Victoria, Canada).
Quayle, D.B. 1988. Pacific oyster culture in British Columbia. Canadian Bulletin of Fisheries and Aquatic Sciences 218: 241 p. (For information on Denman disease see pages 115-117).
Ramilo, A., D. Iglesias, E. Abollo, M. González, S. Darriba et A. Villalba. 2014. Infection of Manila clams Ruditapes philippinarum from Galicia (NW Spain) with a Mikrocytos-like parasite. Diseases of Aquatic Organisms 110: 71-79.
van der Giezen, M. 2013. Evolution: one thread to unite them all. Current Biology 23: R679-R681.
Wang, Z., Y. Liang et X. Lu. 2010. Use of histopathology, PCR and in situ hybridization methods to detect the parasite Mikrocytos sp. in Pacific oyster Crassostrea gigas from the northern coast of the Yellow Sea, China. Aquatic Living Resources 23: 125-130.
Information de citation
Bower, S.M. (2021): Synopsis of Infectious Diseases and Parasites of Commercially Exploited Shellfish: Mikrocytos spp. of Oysters.
Date de la dernière révision: Février 2021
Faire parvenir les commentaires à Susan Bower
- Date de modification :